名校
1 .  与人类息息相关。近年来,为了缓解温室效应,
与人类息息相关。近年来,为了缓解温室效应, 的资源化利用是化学研究热点之一。科学家提出了多种回收和利用
的资源化利用是化学研究热点之一。科学家提出了多种回收和利用 的方案。
的方案。
(1)人体血液中存在平衡 ,当人呼吸过快或过深,体内失去二氧化碳太多,引发呼吸性碱中毒,导致手脚发麻、头晕。试用平衡移动原理解释上述现象:
,当人呼吸过快或过深,体内失去二氧化碳太多,引发呼吸性碱中毒,导致手脚发麻、头晕。试用平衡移动原理解释上述现象:_______ 。
(2)利用 制备
制备 可以实现变废为宝,300℃时,向2L恒容密闭容器中充入2mol
可以实现变废为宝,300℃时,向2L恒容密闭容器中充入2mol 和8mol
和8mol 发生反应:
发生反应:
 ,混合气体中
,混合气体中 的浓度与反应时间的关系如图所示,回答下列问题:
的浓度与反应时间的关系如图所示,回答下列问题:
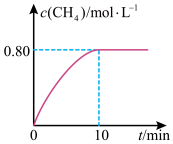
①下列说法正确的是_______ 。
A.容器内密度不变,说明反应达到平衡状态
B.容器内压强不变,说明反应达到平衡状态
C.断开2mol C=O键的同时断开4mol C-H键,说明反应达到平衡状态
D.300℃时,向平衡后的容器中再充入2mol 和8mol
和8mol ,重新达到平衡时
,重新达到平衡时 的浓度小于1.6mol/L
的浓度小于1.6mol/L
②从反应开始到10min, 的平均反应速率
的平均反应速率
_______ 。
③300℃时,反应的平衡常数K=_______ 。
④500℃该反应达到平衡时,上述容器中有1.6mol 、2.0mol
、2.0mol 、5.6mol
、5.6mol 、4.0mol
、4.0mol 。
。
则
_______ 0(填“>”“<”或“=”)
(3)化工废水中常常含有以二甲胺(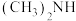 )为代表的含氮有机物,可以通过电解法将二甲胺转化为无毒无害的气体排放,装置如图所示。
)为代表的含氮有机物,可以通过电解法将二甲胺转化为无毒无害的气体排放,装置如图所示。
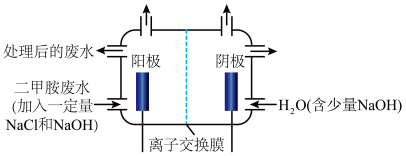
反应原理是:(i) 在阳极转化为
在阳极转化为 ;
;
(ii) 在碱性溶液中歧化为
在碱性溶液中歧化为 ;
;
(iii) 将二甲胺氧化为
将二甲胺氧化为 ,
, 和
和 。
。
①写出电解池中阴极发生反应的方程式_______ 。
②电解池中选择阴离子交换膜而不选择阳离子交换膜的原因是_______ 。
③当阴极区收集到6.72L(标况下) 时,阳极区收集到
时,阳极区收集到 的体积(标况下)是
的体积(标况下)是_______ L。
 与人类息息相关。近年来,为了缓解温室效应,
与人类息息相关。近年来,为了缓解温室效应, 的资源化利用是化学研究热点之一。科学家提出了多种回收和利用
的资源化利用是化学研究热点之一。科学家提出了多种回收和利用 的方案。
的方案。(1)人体血液中存在平衡
 ,当人呼吸过快或过深,体内失去二氧化碳太多,引发呼吸性碱中毒,导致手脚发麻、头晕。试用平衡移动原理解释上述现象:
,当人呼吸过快或过深,体内失去二氧化碳太多,引发呼吸性碱中毒,导致手脚发麻、头晕。试用平衡移动原理解释上述现象:(2)利用
 制备
制备 可以实现变废为宝,300℃时,向2L恒容密闭容器中充入2mol
可以实现变废为宝,300℃时,向2L恒容密闭容器中充入2mol 和8mol
和8mol 发生反应:
发生反应:
 ,混合气体中
,混合气体中 的浓度与反应时间的关系如图所示,回答下列问题:
的浓度与反应时间的关系如图所示,回答下列问题:
①下列说法正确的是
A.容器内密度不变,说明反应达到平衡状态
B.容器内压强不变,说明反应达到平衡状态
C.断开2mol C=O键的同时断开4mol C-H键,说明反应达到平衡状态
D.300℃时,向平衡后的容器中再充入2mol
 和8mol
和8mol ,重新达到平衡时
,重新达到平衡时 的浓度小于1.6mol/L
的浓度小于1.6mol/L②从反应开始到10min,
 的平均反应速率
的平均反应速率
③300℃时,反应的平衡常数K=
④500℃该反应达到平衡时,上述容器中有1.6mol
 、2.0mol
、2.0mol 、5.6mol
、5.6mol 、4.0mol
、4.0mol 。
。则

(3)化工废水中常常含有以二甲胺(
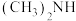 )为代表的含氮有机物,可以通过电解法将二甲胺转化为无毒无害的气体排放,装置如图所示。
)为代表的含氮有机物,可以通过电解法将二甲胺转化为无毒无害的气体排放,装置如图所示。
反应原理是:(i)
 在阳极转化为
在阳极转化为 ;
;(ii)
 在碱性溶液中歧化为
在碱性溶液中歧化为 ;
;(iii)
 将二甲胺氧化为
将二甲胺氧化为 ,
, 和
和 。
。①写出电解池中阴极发生反应的方程式
②电解池中选择阴离子交换膜而不选择阳离子交换膜的原因是
③当阴极区收集到6.72L(标况下)
 时,阳极区收集到
时,阳极区收集到 的体积(标况下)是
的体积(标况下)是
您最近一年使用:0次
2 . 已知磷酸(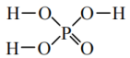 )与NaOH反应生成的正盐为Na3PO4,次磷酸(H3PO2)与NaOH反应生成的正盐为NaH2PO2。下列说法不正确的是
)与NaOH反应生成的正盐为Na3PO4,次磷酸(H3PO2)与NaOH反应生成的正盐为NaH2PO2。下列说法不正确的是
 )与NaOH反应生成的正盐为Na3PO4,次磷酸(H3PO2)与NaOH反应生成的正盐为NaH2PO2。下列说法不正确的是
)与NaOH反应生成的正盐为Na3PO4,次磷酸(H3PO2)与NaOH反应生成的正盐为NaH2PO2。下列说法不正确的是| A.H3PO2属于一元酸 |
| B.NaH2PO2溶液可能呈酸性 |
| C.H3PO2可能既有氧化性又有还原性 |
D.H3PO2的结构式为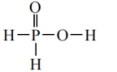 |
您最近一年使用:0次
名校
解题方法
3 . 下表为元素周期表的一部分。回答下列问题:
(1)表中元素原子半径最小的是(写元素符号)_______ 。
(2)Y元素在周期表中的位置为_______ 。
(3)硫的气态氢化物的电子式为_______ ,其水溶液在空气中放置易变浑浊,该变化说明硫的非金属性比氧_______ (填“强”或“弱”)
(4)25℃,两种酸的电离平衡常数如下表。
①HSO 的电离平衡常数表达式K=
的电离平衡常数表达式K=_______ 。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_______ 。
| 碳 | 氮 | Y | M |
| X | 硫 | Z |
(1)表中元素原子半径最小的是(写元素符号)
(2)Y元素在周期表中的位置为
(3)硫的气态氢化物的电子式为
(4)25℃,两种酸的电离平衡常数如下表。
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO
 的电离平衡常数表达式K=
的电离平衡常数表达式K=②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为
您最近一年使用:0次
名校
解题方法
4 . 下列根据实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
| A | 向Na2HPO4溶液中滴入酚酞 | 溶液变红色 | HPO 水解程度大于电离程度 水解程度大于电离程度 |
| B | 向浓度均为0.1000 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2] > Ksp[Cu(OH)2] |
| C | 向Na2CO3溶液中加入醋酸,将反应后的气体通入硅酸钠溶液中 | 产生白色浑浊 | 酸性:醋酸 > 碳酸 > 硅酸 |
| D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在I ⇌I2+ I-平衡 ⇌I2+ I-平衡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . 已知人体体液中存在如下平衡:CO2+H2O H2CO3
H2CO3 H++
H++ ,以维持体液pH的相对稳定。下列说法
,以维持体液pH的相对稳定。下列说法不合理 的是
 H2CO3
H2CO3 H++
H++ ,以维持体液pH的相对稳定。下列说法
,以维持体液pH的相对稳定。下列说法| A.当强酸性物质进入体液后,上述平衡向左移动,以维持体液pH的相对稳定 |
| B.当强碱性物质进入体液后,上述平衡向右移动,以维持体液pH的相对稳定 |
| C.若静脉滴注大量生理盐水,则体液的pH减小 |
| D.进行呼吸活动时,如果CO2进入血液,会使体液的pH减小 |
您最近一年使用:0次
2020-11-02更新
|
756次组卷
|
10卷引用:重庆市第七中学校2021-2022学年高二上学期期中考试化学试题
重庆市第七中学校2021-2022学年高二上学期期中考试化学试题(已下线)练习9 弱电解质的电离平衡-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)(已下线)第03章 水溶液中的离子反应与平衡(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)(已下线)考点23 弱电解质的电离-备战2022年高考化学一轮复习考点帮(全国通用)四川省广安友谊中学2021-2022学年高二上学期11月质量检测化学试题(已下线)考点26 弱电解质的电离-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)3.2.1 弱电解质的电离平衡-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)湖北省武汉市常青联合体2022-2023学年高二上学期期中考试化学试题(已下线)第八章 水溶液中的离子反应与平衡 第46练 弱电解质的电离平衡第1讲 弱电解质的电离平衡
名校
6 . 物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种,请根据所学化学知识回答下列问题:
(1)①在25℃条件下将pH=12的氨水稀释过程中,下列关系式正确的_________ 。
A.能使溶液中c(NH4+):c(OH-)增大
B.溶液中c(H+)·c(OH-)不变
C.能使溶液中 比值增大
比值增大
D.此过程中Kw增
②25℃时,向0.1 mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是_________ 。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了一水合氨的电离,使c(OH-)减小
(2)①室温下,如果将0.2 mol NH4Cl和0.1 mol NaOH全部溶于水,形成混合溶液(假设无损失),_____ 和______ 两种粒子的物质的量之和比 多0.1 mol。
多0.1 mol。
②已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系,若关系中C是正确的,则该溶质的化学式是__________ 。
A. c(Cl-)>c(NH4+)>c(H+)>c(OH-) B. c(Cl-)=c(NH4+)>c(H+)=c(OH-)
C. c(Cl-)>c(H+)>c(NH4+)>c(OH-) D. c(NH4+)>c(Cl-)>c(OH-)>c(H+)
(3)如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-(配离子)物质的量浓度的对数。回答下列问题:
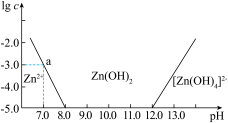
①向ZnCl2溶液中加入足量的氢氧化钠溶液,用离子方程式表示出反应的过程:_________________ 。
②从图中数据计算可得Zn(OH)2的溶度积(Ksp)=_______________ 。
(1)①在25℃条件下将pH=12的氨水稀释过程中,下列关系式正确的
A.能使溶液中c(NH4+):c(OH-)增大
B.溶液中c(H+)·c(OH-)不变
C.能使溶液中
 比值增大
比值增大D.此过程中Kw增
②25℃时,向0.1 mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了一水合氨的电离,使c(OH-)减小
(2)①室温下,如果将0.2 mol NH4Cl和0.1 mol NaOH全部溶于水,形成混合溶液(假设无损失),
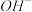 多0.1 mol。
多0.1 mol。②已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系,若关系中C是正确的,则该溶质的化学式是
A. c(Cl-)>c(NH4+)>c(H+)>c(OH-) B. c(Cl-)=c(NH4+)>c(H+)=c(OH-)
C. c(Cl-)>c(H+)>c(NH4+)>c(OH-) D. c(NH4+)>c(Cl-)>c(OH-)>c(H+)
(3)如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-(配离子)物质的量浓度的对数。回答下列问题:

①向ZnCl2溶液中加入足量的氢氧化钠溶液,用离子方程式表示出反应的过程:
②从图中数据计算可得Zn(OH)2的溶度积(Ksp)=
您最近一年使用:0次
2020-09-12更新
|
266次组卷
|
3卷引用:重庆市第二十九中学2020-2021学年高二10月月考化学试题
7 . 已知人体体液中存在如下平衡:CO2+ H2O H2CO3
H2CO3 H++HCO3-,以维持体液pH的相对稳定。下列说法不合理的是()
H++HCO3-,以维持体液pH的相对稳定。下列说法不合理的是()
 H2CO3
H2CO3 H++HCO3-,以维持体液pH的相对稳定。下列说法不合理的是()
H++HCO3-,以维持体液pH的相对稳定。下列说法不合理的是()| A.静脉滴注大量生理盐水,体液的pH减小 |
| B.如果CO2进入血液,会使体液的pH减小 |
| C.当强酸性物质进入体液后,平衡向左移动 |
| D.当强碱性物质进入体液后,平衡向右移动 |
您最近一年使用:0次
2020-09-11更新
|
473次组卷
|
4卷引用:重庆市部分区2019-2020学年高二上学期期末考试化学试题
重庆市部分区2019-2020学年高二上学期期末考试化学试题(已下线)第03章 物质在水溶液中的行为(A卷基础强化卷)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材鲁科版)2020年全国卷Ⅱ化学真题变式题【精品卷】3.1.2 弱电解质的电离平衡课堂例题-人教版2023-2024学年选择性必修1
名校
8 . 硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀,实验室常用Na2SiO3溶液制备硅酸。某小组同学进行了如下实验:
下列结论正确的是
| 编号 | Ⅰ | Ⅱ |
| 实验 | 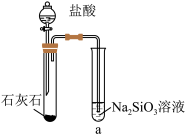 | 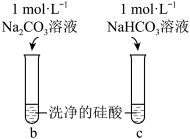 |
| 现象 | a中产生凝胶状沉淀 | b中凝胶状沉淀溶解,c中无明显变化 |
下列结论正确的是
| A.Na2SiO3溶液碱性比Na2CO3溶液强 |
| B.实验Ⅰ说明酸性H2CO3>H2SiO3 |
| C.实验Ⅱ说明同浓度时Na2CO3溶液的碱性强于NaHCO3溶液 |
D.向Na2SiO3溶液中通入过量CO2,发生反应: +CO2+H2O= +CO2+H2O= +H2SiO3↓ +H2SiO3↓ |
您最近一年使用:0次
2020-09-02更新
|
55次组卷
|
2卷引用:重庆市第二十九中学2020-2021学年高二10月月考化学试题



