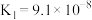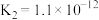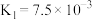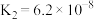名校
解题方法
1 . 已知:
(1)浓度均为0.1mol/L的下列四种溶液,pH由小到大排列的顺序是___________ (填标号)。
A.CH3COONa B.Na2CO3 C.NaClO D.NaHCO3
(2)①0.1mol/L CH3COOH溶液加水稀释过程中,下列数据变大的是___________ (填标号)。
A.c(H+) B. C.
C. D.
D. E.
E.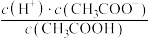
②25℃时,将pH=2的醋酸和盐酸各1mL分别加水稀释至100mL,稀释后溶液中水的电离程度:
醋酸___________ 盐酸(填“>”、“<”或“=”)。
③25℃时,a mol/L CH3COOH溶液与b mol/L NaOH溶液等体积混合,反应后溶液恰好显中性,用含a、b的代数式表示CH3COOH的电离平衡常数Ka =___________ 。
④向10 mL浓度为0.01mol/L的H2C2O4溶液中加入5 mL 0.02 mol/L的NaOH溶液,充分反应后溶液呈___________ (填标号)。
a.酸性 b.碱性 c.中性
(3)25℃时,pH=4和pH=11的强酸和强碱混合后溶液pH=10,则酸、碱溶液的体积比为___________ (忽略溶液混合时体积的变化)。
(4)将少量CO2通入NaClO溶液发生反应的离子方程式为___________ 。
| CH3COOH | H2CO3 | HClO | H2C2O4 | NH3·H2O | |
| 电离平衡常数 (25℃) |  |   | Ka= | Ka1=5.6×10-2 Ka2=5.4×10-5 |  |
A.CH3COONa B.Na2CO3 C.NaClO D.NaHCO3
(2)①0.1mol/L CH3COOH溶液加水稀释过程中,下列数据变大的是
A.c(H+) B.
 C.
C. D.
D. E.
E.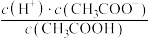
②25℃时,将pH=2的醋酸和盐酸各1mL分别加水稀释至100mL,稀释后溶液中水的电离程度:
醋酸
③25℃时,a mol/L CH3COOH溶液与b mol/L NaOH溶液等体积混合,反应后溶液恰好显中性,用含a、b的代数式表示CH3COOH的电离平衡常数Ka =
④向10 mL浓度为0.01mol/L的H2C2O4溶液中加入5 mL 0.02 mol/L的NaOH溶液,充分反应后溶液呈
a.酸性 b.碱性 c.中性
(3)25℃时,pH=4和pH=11的强酸和强碱混合后溶液pH=10,则酸、碱溶液的体积比为
(4)将少量CO2通入NaClO溶液发生反应的离子方程式为
您最近一年使用:0次
2 . 结合下表回答下列问题(均为常温下的数据):请回答下列问题:
(1)同浓度的CH3COO-、 、
、 、
、 、ClO-、S2-中结合H+的能力最强的是
、ClO-、S2-中结合H+的能力最强的是___ .
(2)常温下0.1mol/L的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_____(填字母)。
(3)取等体积物质的量浓度相等的CH3COOH、HClO两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(CH3COOH) ______ V(HClO) (填“>”、“<”或“=”)
(4)在新制氯水中加入少量的NaCl固体,水的电离平衡_______ 移动(填“向右”、“向左”、或“不”)。
(5)四位同学根据表中数据写出以下几个反应方程式
甲:H2S+Na2CO3=NaHS+NaHCO3
乙:H2C2O4+Na2CO3=Na2C2O4+CO2↑+H2O
丙:HClO+Na2S=NaClO+NaHS
丁:CH3COOH+NaHCO3=CH3COONa+H2O+CO2↑
上述反应可以成功进行的是___________ 。
| 酸 | CH3COOH | HClO | H2CO3 | H2C2O4 | H2S |
| 电离常数(Ka) | 1.8×10-5 | 3×10-8 | K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.4×10-5 | K1=1.3×10-7 K2=7.1×10-15 |
 、
、 、
、 、ClO-、S2-中结合H+的能力最强的是
、ClO-、S2-中结合H+的能力最强的是(2)常温下0.1mol/L的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_____(填字母)。
| A.c(H+) | B.c(H+)/c(CH3COOH) | C.c(H+)/c(OH-) | D.c(OH-) |
(4)在新制氯水中加入少量的NaCl固体,水的电离平衡
(5)四位同学根据表中数据写出以下几个反应方程式
甲:H2S+Na2CO3=NaHS+NaHCO3
乙:H2C2O4+Na2CO3=Na2C2O4+CO2↑+H2O
丙:HClO+Na2S=NaClO+NaHS
丁:CH3COOH+NaHCO3=CH3COONa+H2O+CO2↑
上述反应可以成功进行的是
您最近一年使用:0次
3 . 根据表格中电离常数判断下列反应可以发生的是
| 化学式 | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | 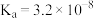 | 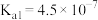 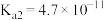 | 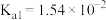 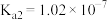 |
A.NaClO溶液中通入少量CO2: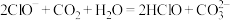 |
B.Na2SO3溶液中通入足量CO2: |
C.Na2CO3溶液中通入少量SO2: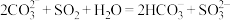 |
D.NaClO溶液中通入足量SO2: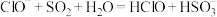 |
您最近一年使用:0次
名校
4 . 已知25℃时,部分弱电解质的电离平衡常数如表:
下列离子方程式或守恒关系正确的是
| 弱电解质 | HClO | H2CO3 | H2SO3 | NH3·H2O |
| 电离平衡常数 | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.5×10-2 Ka2=6.0×10-8 | Kb=1.75×10-5 |
A.将Cl2通入到过量Na2CO3溶液中:Cl2+H2O+CO =HCO =HCO +HClO+Cl- +HClO+Cl- |
B.将SO2通入到NaClO溶液中:ClO-+H2O+SO2=HClO+HSO |
C.向亚硫酸溶液中加入氨水至中性:c(NH )=c(SO )=c(SO )+c(H2SO3)+c(HSO )+c(H2SO3)+c(HSO ) ) |
D.向过量Na2CO3溶液中通入少量SO2:SO2+H2O+2CO =2HCO =2HCO +SO +SO |
您最近一年使用:0次
2022-03-13更新
|
349次组卷
|
3卷引用:湖北省武汉市部分重点中学2021-2022学年高二上学期期末联考化学试题
名校
5 . 下表是几种弱酸常温下的电离平衡常数:
则下列说法中不正确的是
|
|
|
|
|
|
|
|
| A.碳酸的酸性强于氢硫酸 |
| B.多元弱酸的酸性主要由第一步电离决定 |
C.常温下,加水稀释醋酸, 增大 增大 |
| D.向弱酸溶液中加少量NaOH溶液,电离平衡常数不变 |
您最近一年使用:0次
2021-12-02更新
|
414次组卷
|
21卷引用:湖北省黄冈市2019-2020学年高二10月月考化学试题
湖北省黄冈市2019-2020学年高二10月月考化学试题河北省邯郸市永年县第二中学2017-2018学年高二10月月考化学试题河北省邯郸市第二中学2017-2018学年高二上学期期中考试化学试题河南省南阳市省示范性高中联谊学校2017-2018学年高二上学期第二次月考化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高二下学期期中考试化学试题江苏省宿迁市沭阳县修远中学2018-2019学年高二下学期第二次月考化学试题广东省中山市第一中学2019-2020学年高二上学期第一次段考化学试题黑龙江省大庆铁人中学2019-2020学年高二10月月考化学试题吉林省吉林市蛟河市第一中学2019-2020学年高二上学期期中考试化学试题夯基提能2020届高三化学选择题对题专练——选修四化学反应原理——弱电解质的电离四川省武胜烈面中学校2019-2020学年高二下学期开学考试化学试题(已下线)3.1.3 常见的弱电解质(基础练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)湖南省常德外国语学校2020-2021学年高二上学期期中考试化学试题黑龙江省大庆市大庆中学2021届高三上学期期中考试化学试题四川省峨眉第二中学2020-2021学年高二下学期4月月考化学试题江西省南昌市第三中学2020~2021学年高二上学期期中考试化学试题宁夏六盘山高级中学2021-2022学年高二上学期期中考试化学试题江西省宜春市万载中学2021-2022学年高一下学期第二次月考化学试题福建省泉州市石狮市石光中学2022-2023学年高二上学期期中考试化学试题河南省宏力学校2021-2022学年高二上学期期末考试化学试题江苏省无锡市江阴市两校联考2023-2024学年高二下学期3月月考化学试题
6 . 已知:硫酸、硒酸、亚磷酸等是二元酸。请根据所给信息完成下列问题。
(1)硒酸(H2SeO4)在水溶液中的电离如下: ,
, ,
,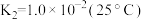 。
。
①向 溶液中滴加少量氨水,该反应的离子方程式为
溶液中滴加少量氨水,该反应的离子方程式为___________ 。
②已知 的电离平衡常数
的电离平衡常数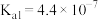 ,
, ,则
,则 和
和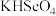 两溶液混合反应的离子方程式为:
两溶液混合反应的离子方程式为:___________ 。
(2)亚磷酸( )是二元弱酸,已知常温下
)是二元弱酸,已知常温下 的电离常数的值:
的电离常数的值: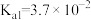 ,
, 。则
。则 溶液显
溶液显___________ 性。(选填“酸”、“碱”或“中”)
(3)某化学兴趣小组利用已知浓度的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。已知亚磷酸( )具有较强的还原性,能被酸性溶液氧化为磷酸,其反应原理为:
)具有较强的还原性,能被酸性溶液氧化为磷酸,其反应原理为: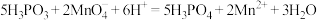 。
。
①该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,选用0.1mol/L的酸性KMnO4标准溶液进行滴定,则滴定终点的现象为:___________ 。
②已知三次滴定的测量数据如下表,该亚磷酸溶液的物质的量浓度为______  。(保留小数点后两位)
。(保留小数点后两位)
(4)某研究性学习小组在实验室中配制 的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是
的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是___________ 。
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大。
(1)硒酸(H2SeO4)在水溶液中的电离如下:
 ,
, ,
,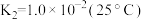 。
。①向
 溶液中滴加少量氨水,该反应的离子方程式为
溶液中滴加少量氨水,该反应的离子方程式为②已知
 的电离平衡常数
的电离平衡常数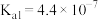 ,
, ,则
,则 和
和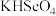 两溶液混合反应的离子方程式为:
两溶液混合反应的离子方程式为:(2)亚磷酸(
 )是二元弱酸,已知常温下
)是二元弱酸,已知常温下 的电离常数的值:
的电离常数的值: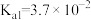 ,
, 。则
。则 溶液显
溶液显(3)某化学兴趣小组利用已知浓度的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。已知亚磷酸(
 )具有较强的还原性,能被酸性溶液氧化为磷酸,其反应原理为:
)具有较强的还原性,能被酸性溶液氧化为磷酸,其反应原理为: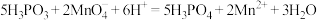 。
。①该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,选用0.1mol/L的酸性KMnO4标准溶液进行滴定,则滴定终点的现象为:
②已知三次滴定的测量数据如下表,该亚磷酸溶液的物质的量浓度为
 。(保留小数点后两位)
。(保留小数点后两位)| 试验编号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 22.00 |
| 2 | 0.50 | 22.50 |
| 3 | 0.50 | 25.50 |
(4)某研究性学习小组在实验室中配制
 的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是
的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大。
您最近一年使用:0次
名校
7 . 下列有关水溶液中的平衡相关的问题,请填空。
(1)泡沫灭火器是将Al2(SO4)3溶液和NaHCO3溶液混合,有白色沉淀产生同时释放出CO2,写出反应离子方程式___ 。
(2)NaClO溶液显碱性的原因是___ (用离子方程式说明);常温时pH=10的NaClO溶液中c(Na+)-c(ClO-)=___ (填准确数值)mol·L-1。
(3)25℃时,三种弱酸的电离平衡常数如表所示:
①少量CO2通入NaClO溶液中反应的离子方程式___ ;
②在某CH3COOH和CH3COONa的混合液中,当 =
= 时,溶液的pH=
时,溶液的pH=___ 。
③下列离子①CO ②HCO
②HCO ③ClO-④CH3COO-结合质子能力由强到弱的顺序为
③ClO-④CH3COO-结合质子能力由强到弱的顺序为___ 。
(4)已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。取一定量含有I-、Cl-的溶液向其中滴加AgNO3溶液,当AgCl和AgI同时沉淀时,溶液中 为
为___
(1)泡沫灭火器是将Al2(SO4)3溶液和NaHCO3溶液混合,有白色沉淀产生同时释放出CO2,写出反应离子方程式
(2)NaClO溶液显碱性的原因是
(3)25℃时,三种弱酸的电离平衡常数如表所示:
| 分子式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①少量CO2通入NaClO溶液中反应的离子方程式
②在某CH3COOH和CH3COONa的混合液中,当
 =
= 时,溶液的pH=
时,溶液的pH=③下列离子①CO
 ②HCO
②HCO ③ClO-④CH3COO-结合质子能力由强到弱的顺序为
③ClO-④CH3COO-结合质子能力由强到弱的顺序为(4)已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。取一定量含有I-、Cl-的溶液向其中滴加AgNO3溶液,当AgCl和AgI同时沉淀时,溶液中
 为
为
您最近一年使用:0次
名校
8 . 已知人体体液中存在如下平衡:CO2+H2O H2CO3
H2CO3 H++
H++ ,以维持体液pH的相对稳定。下列说法
,以维持体液pH的相对稳定。下列说法不合理 的是
 H2CO3
H2CO3 H++
H++ ,以维持体液pH的相对稳定。下列说法
,以维持体液pH的相对稳定。下列说法| A.当强酸性物质进入体液后,上述平衡向左移动,以维持体液pH的相对稳定 |
| B.当强碱性物质进入体液后,上述平衡向右移动,以维持体液pH的相对稳定 |
| C.若静脉滴注大量生理盐水,则体液的pH减小 |
| D.进行呼吸活动时,如果CO2进入血液,会使体液的pH减小 |
您最近一年使用:0次
2020-11-02更新
|
756次组卷
|
10卷引用:湖北省武汉市常青联合体2022-2023学年高二上学期期中考试化学试题
湖北省武汉市常青联合体2022-2023学年高二上学期期中考试化学试题(已下线)练习9 弱电解质的电离平衡-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)(已下线)第03章 水溶液中的离子反应与平衡(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)(已下线)考点23 弱电解质的电离-备战2022年高考化学一轮复习考点帮(全国通用)重庆市第七中学校2021-2022学年高二上学期期中考试化学试题四川省广安友谊中学2021-2022学年高二上学期11月质量检测化学试题(已下线)考点26 弱电解质的电离-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)3.2.1 弱电解质的电离平衡-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)第八章 水溶液中的离子反应与平衡 第46练 弱电解质的电离平衡第1讲 弱电解质的电离平衡
9 . 某同学查阅资料得知25℃时部分弱酸的电离常数如下表:
据此回答以下几个问题:
(1)四位同学根据表中数据写出以下几个反应方程式
甲:
乙:
丙:
丁:
上述反应可以成功进行的是______ (填同学代号)。
(2)甲同学为证明 HCOOH 为弱酸,采用以下方法一定能证明的是_______ (填序号)。
①常温下测得HCOONa溶液的pH大于7
②用HCOOH 溶液做导电实验,灯泡很暗
③HCOOH与Na2S能发生反应产生臭鸡蛋气味的气体
④采用pH计测得常温下 0.1 mol/L HCOOH 溶液的pH=1.37
⑤HCOONa和H3PO4反应,生成 HCOOH
⑥pH=2的HCOOH溶液稀释至100倍后,测得pH约为3.4
(3)乙同学取10.00 mL 0.1 mol/L H2C2O4在室温下用0.1 mol/L NaOH 溶液进行滴定,并使用氢离子浓度监测仪进行实时监控,当电脑显示 pH=7并稳定时停止滴定,此时测得消耗NaOH 溶液体积为V mL。
①该实验可使用________ 量取10.00 mL 0.1 mol/L H2C2O4(填仪器名称)。
②V____ 10.00 mL(填“>”“="或“<”)。
③滴定结束后溶液中所含离子浓度由大到小为:_________ (书写离子浓度符号并用“>”连接)。
④丙同学与甲同学做同样实验。但他将0.1 mol/L H2C2O4换成0.1 mol/L H2S溶液,丙同学实验结束后溶液c(HS-)___ c(S2-)(填">""<"或“=”)。
(4)已知酸性高锰酸钾可将甲酸氧化成二氧化碳,丁采用 HCOOH 溶液对某KMnO4样品进行纯度测定(杂质不参导反应),取0.200 g KMnO4样品(M=158 g/mol)在锥形瓶中溶解并酸化后,用0.100 mol/L的标准HCOOH溶液进行滴定,滴定至终点时消耗 HCOOH 溶液20.00 mL。
①对 KMnO4溶液进行酸化时,通常选用的酸是__________ 。
②确定达到滴定终点的判断方法是_________ 。
③该样品中KMnO4的纯度为_______ (用百分数表示)。
| 酸 | HCOOH | HClO | H2CO3 | H2C2O4 | H2S |
| 电离常数(Ka) | 1.8×10-4 | 3×10-8 | K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.4×10-5 | K1=1.3×10-7 K2=7.1×10-15 |
(1)四位同学根据表中数据写出以下几个反应方程式
甲:

乙:

丙:

丁:

上述反应可以成功进行的是
(2)甲同学为证明 HCOOH 为弱酸,采用以下方法一定能证明的是
①常温下测得HCOONa溶液的pH大于7
②用HCOOH 溶液做导电实验,灯泡很暗
③HCOOH与Na2S能发生反应产生臭鸡蛋气味的气体
④采用pH计测得常温下 0.1 mol/L HCOOH 溶液的pH=1.37
⑤HCOONa和H3PO4反应,生成 HCOOH
⑥pH=2的HCOOH溶液稀释至100倍后,测得pH约为3.4
(3)乙同学取10.00 mL 0.1 mol/L H2C2O4在室温下用0.1 mol/L NaOH 溶液进行滴定,并使用氢离子浓度监测仪进行实时监控,当电脑显示 pH=7并稳定时停止滴定,此时测得消耗NaOH 溶液体积为V mL。
①该实验可使用
②V
③滴定结束后溶液中所含离子浓度由大到小为:
④丙同学与甲同学做同样实验。但他将0.1 mol/L H2C2O4换成0.1 mol/L H2S溶液,丙同学实验结束后溶液c(HS-)
(4)已知酸性高锰酸钾可将甲酸氧化成二氧化碳,丁采用 HCOOH 溶液对某KMnO4样品进行纯度测定(杂质不参导反应),取0.200 g KMnO4样品(M=158 g/mol)在锥形瓶中溶解并酸化后,用0.100 mol/L的标准HCOOH溶液进行滴定,滴定至终点时消耗 HCOOH 溶液20.00 mL。
①对 KMnO4溶液进行酸化时,通常选用的酸是
②确定达到滴定终点的判断方法是
③该样品中KMnO4的纯度为
您最近一年使用:0次
10 . 完成并分析下列化学原理
(1)在配制三氯化铁溶液时,为了防止发生水解,可以加入少量的________ 。
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是____________ ;
(3)除去CuCl2溶液中少量的FeCl3,加入的试剂可以是_____________ 。
(4)在常温下,稀释等PH值的HCl、HF两种酸的稀溶液时,溶液pH随加水量的变化如图所示,能表示HF的稀释过程的曲线是:_____________

(5)amol·L-1(NH4)2SO4溶液pH=5,其原因是_______ (用相应的方程式说明)。
(6)有4种混合溶液,分别由等体积0.1 mol·L-1的两种溶液混合而成:①NH4Cl与CH3COONa ②NH4Cl与HCl ③NH4Cl与NaCl ④NH4Cl与NH3·H2O(混合液呈碱性)。溶液中c(H+)由小到大 的顺序为:(填混合溶液的编号)____________
(7)在做Zn与稀H2SO4反应制取H2的实验中,向溶液中滴加几滴CuSO4溶液,反应放出H2速度加快的原因是:__________________________
(1)在配制三氯化铁溶液时,为了防止发生水解,可以加入少量的
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(3)除去CuCl2溶液中少量的FeCl3,加入的试剂可以是
(4)在常温下,稀释等PH值的HCl、HF两种酸的稀溶液时,溶液pH随加水量的变化如图所示,能表示HF的稀释过程的曲线是:

(5)amol·L-1(NH4)2SO4溶液pH=5,其原因是
(6)有4种混合溶液,分别由等体积0.1 mol·L-1的两种溶液混合而成:①NH4Cl与CH3COONa ②NH4Cl与HCl ③NH4Cl与NaCl ④NH4Cl与NH3·H2O(混合液呈碱性)。溶液中c(H+)
(7)在做Zn与稀H2SO4反应制取H2的实验中,向溶液中滴加几滴CuSO4溶液,反应放出H2速度加快的原因是:
您最近一年使用:0次