名校
解题方法
1 . 下列实验能达到预期目的是
A.向含有酚酞的 溶液中加入少量 溶液中加入少量 固体,溶液红色变浅,证明 固体,溶液红色变浅,证明 溶液中存在水解平衡 溶液中存在水解平衡 |
B.室温下,用pH试纸测定浓度为0.1mol/LNaClO溶液和 溶液的pH,比较HClO和 溶液的pH,比较HClO和 的酸性强弱 的酸性强弱 |
C.等体积 的HX和HY两种酸分别与足量的锌粒反应,排水法收集气体,HX反应结束后放出的氢气多且反应过程中反应速率快,证明HX酸性比HY强 的HX和HY两种酸分别与足量的锌粒反应,排水法收集气体,HX反应结束后放出的氢气多且反应过程中反应速率快,证明HX酸性比HY强 |
D.向10mL0.2mol/LNaOH溶液中滴加2滴 溶液,产生白色沉淀后,再滴加2滴 溶液,产生白色沉淀后,再滴加2滴 溶液,又生成红褐色沉淀,证明在相同温度下Ksp: 溶液,又生成红褐色沉淀,证明在相同温度下Ksp: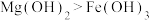 |
您最近一年使用:0次
2023-06-21更新
|
131次组卷
|
16卷引用:山西省长治市第二中学2019-2020学年高二上学期第一次月考化学试题
山西省长治市第二中学2019-2020学年高二上学期第一次月考化学试题鲁科版(2019)选择性必修1 模块综合测评人教版(2019)高二选择性必修第一册 模块综合测评广东省梅州市2021-2022学年高二上学期期末考试化学试题河南省南乐县第一高级中学2021-2022学年高二下学期3月月考化学试题江苏省泰州中学2021-2022学年高二下学期期中考试化学试题河南省安阳市第一中学2020-2021学年高二上学期期末考试化学试题湖南省长沙市南雅中学2022-2023学年高二上学期第三次月考化学试题江苏省南通市海安李堡中学2021-2022学年高二上学期期中考试化学试题宁夏回族自治区银川一中2022-2023学年高二上学期期末考试化学试题江苏省徐州市沛县2022-2023学年高二下学期5月月考化学试题广西南宁市2022-2023学年高二下学期开学考试化学试题四川省遂宁市射洪中学校2023-2024学年高二上学期(强基班)11月月考化学试题新疆石河子第一中学2023-2024学年高二上学期12月月考化学试题安徽省合肥市第一中学2023-2024学年高二上学期12月月考化学试题湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题
名校
解题方法
2 . 如图是用0.1000mol•L-1NaOH溶液滴定20.00mL未知浓度盐酸(酚酞做指示剂)的滴定曲线。下列说法正确的是
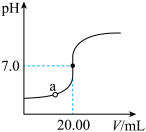

| A.需使用量程为20mL的量筒量取盐酸 |
| B.a点时,c(Na+)<c(Cl-) |
| C.滴定达到终点时,溶液由粉色变为无色 |
| D.盐酸的物质的量浓度为0.0100mol•L-1 |
您最近一年使用:0次
2023-04-26更新
|
231次组卷
|
2卷引用:北京市中国人民大学附属中学2019-2020学年高三下学期月考化学试题
名校
解题方法
3 . 25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.0.1 mol/L(NH4)2Fe(SO4)2溶液中:c( )>c( )>c( )>c(Fe2+)>c(H+) )>c(Fe2+)>c(H+) |
B.pH=11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c( )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
C.在0.1 mol/LNa2CO3溶液中:2c(Na+)=c( )+c( )+c( )+c(H2CO3) )+c(H2CO3) |
| D.0.1 mol/L的醋酸钠溶液20 mL与0.1 mol/L盐酸10 mL混合后溶液显酸性:c(CH3COOH)>c(Cl-)>c(CH3COO-)>c(H+) |
您最近一年使用:0次
2023-04-22更新
|
141次组卷
|
7卷引用:辽宁省大连市普兰店区第三十八中学2020-2021学年高二上学期第三次月考化学试题
名校
解题方法
4 . 常温下a mol∙L−1稀氨水与b mol∙L−1稀盐酸等体积混合,下列判断一定正确的是
A.若a>b,则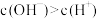 | B.若a>b,则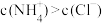 |
C.若a<b,则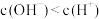 | D.若a=b,则 |
您最近一年使用:0次
2023-04-06更新
|
332次组卷
|
19卷引用:2014-2015学年江西省南昌二中高二上学期期中化学试卷
2014-2015学年江西省南昌二中高二上学期期中化学试卷2014-2015河北省唐山市一中高二下学期开学调研化学试卷2015-2016学年江西省铅山一中 、横峰中学高二上期中测试化学试卷2016-2017学年河北省涿鹿县涿鹿中学高二上调研三化学卷【全国百强校】福建省上杭县第一中学2018-2019学年高二上学期12月月考化学试题(已下线)2013届上海市浦东新区高三下学期二模化学试卷(已下线)2015届甘肃省兰州一中高三9月月考化学试卷2015届广西玉林市博白县高三下学期返校调研考试化学试卷2018版化学(苏教版)高考总复习专题八题型冲关--电解质溶液中粒子浓度关系上海市同济大学第一附属中学2019—2020学年高三上学期期中考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——溶液的酸碱性(强化练习)【懂做原理题】2020届高三化学选修4二轮专题练——溶液中微粒浓度大小比较分析【精编25题】(已下线)上海市浦东新区2013届高三4月高考预测(二模)化学试题上海市进才中学2021-2022学年高二上学期期中考试化学试题(已下线)四川省遂宁中学2022-2023学年高二下学期期中考试化学试题上海市育才中学2022-2023学年高二下学期第二次教学质量检测(等级考)化学调研卷上海师范大学附属中学2022-2023学年高三上学期期中考试化学试题上海市崇明区2022~2023学年高三下学期二模测试化学试题(已下线)专题17 水溶液中的离子平衡
名校
解题方法
5 . 常温下,向 溶液中逐滴加入
溶液中逐滴加入 的NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发)。下列说法中正确的是
的NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发)。下列说法中正确的是

 溶液中逐滴加入
溶液中逐滴加入 的NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发)。下列说法中正确的是
的NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发)。下列说法中正确的是
A.d点溶液中: |
B.c点溶液中: |
C.b点溶液中: |
D.a点溶液中:, |
您最近一年使用:0次
2023-02-28更新
|
98次组卷
|
3卷引用:湖南省株洲市茶陵县第三中学2019-2020学年高二上学期第三次月考化学(选考)试题
名校
解题方法
6 . 常温下,已知:
下列判断正确的是
| 物质 | CH3COOH | H2CO3 | CaCO3 |
| 平衡常数 | K=1.8×10-5 | Ka1=4.3×10-7,Ka2=5.6×10-11 | Ksp=2.8×10-9 |
A.向 溶液中滴入酚酞,溶液变红,原因是 溶液中滴入酚酞,溶液变红,原因是 |
B.常温时, 与 与 混合溶液的 混合溶液的 ,则 ,则 |
C. 溶液中, 溶液中, |
D. 的 的 溶液与 溶液与 溶液等体积混合出现沉淀,则 溶液等体积混合出现沉淀,则 溶液的浓度一定是 溶液的浓度一定是 (假设混合溶液体积为两溶液体积之和) (假设混合溶液体积为两溶液体积之和) |
您最近一年使用:0次
2023-02-15更新
|
344次组卷
|
18卷引用:山西省康杰中学2017-2018学年高二上学期期中考试化学试题
山西省康杰中学2017-2018学年高二上学期期中考试化学试题(已下线)2017-2018学年上学期期末复习备考之精准复习模拟题高二化学选修4(C卷)【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二上学期期中考试化学试题湖北省随州市第一中学2018-2019学年高二下学期期中考试化学试题辽宁省丹东市凤城市第一中学2019-2020学年高二上学期12月月考化学试题湖北省黄冈市黄梅国际育才高级中学2019-2020学年高二上学期期中考试化学试题山东省邹城市第一中学2020-2021学年高二上学期期中质量检测化学试题江西省景德镇一中2020-2021学年高二上学期期中考试化学(2班)试题山西省怀仁市第一中学云东校区2020-2021学年高二上学期第三次月考化学试题黑龙江省大庆实验中学2020-2021学年高二上学期期末考试化学试题江苏省镇江市第一中学2020-2021学年高二下学期4月分阶段测化学试题福建省仙游一中、莆田二中、莆田四中2020-2021学年高二上学期期末联考化学试题(已下线)综合复习与测试(2)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)四川省自贡市田家柄中学教育集团2021-2022学年高二下学期入学考试化学试题湖南省益阳市2022-2023学年高二上学期期末质量检测化学试题四川省巴中市恩阳区2022-2023学年高二上学期1月期末化学试题上海市控江中学2023-2024学年高二上学期等级班阶段测验卷二 化学试题(已下线)2023年高考浙江卷化学真题(6月)变式题(选择题11-16)
2009高二·湖南·学业考试
名校
解题方法
7 . 弱酸HA的溶液和等体积、等物质的量浓度的强碱MOH的溶液混合后,溶液中有关离子浓度的大小关系正确的是
| A.c(M+)>c(A-)>c(H+)>c(OH-) | B.c(A-)>c(M+)>c(OH-)>c(H+) |
| C.c(M+)>c(A-)>c(OH-)>c(H+) | D.c(M+)>c(OH-)>c(A-)>c(H+) |
您最近一年使用:0次
2023-02-11更新
|
362次组卷
|
55卷引用:湖南师大附中高二化学选修4结业考试理科试题
(已下线)湖南师大附中高二化学选修4结业考试理科试题(已下线)09—10年泰州中学高二下学期期末考试化学卷(已下线)2010-2011学年湖北省武汉市三角路中学高二上学期期末考试化学试卷(已下线)2011-2012学年山西省大同市实验中学高二上学期期中考试化学试卷(已下线)2011-2012学年云南省会泽县第一中学高二6月月考化学试卷2014-2015宁夏回族自治区银川一中高二上学期期末考试化学试卷2015-2016学年贵州省凯里一中高二上学期期末化学试卷(已下线)2018年11月11日——《每日一题》 人教 必修4-每周一测河北省承德市第一中学2018-2019学年高二上学期第三次月考化学试题吉林省长春市九台区师范高级中学2018-2019学年高二上学期期中考试化学试题海南省儋州市儋州一中2018-2019学年高二上学期期中考试化学试题【全国百强校】青海省西宁市第四高级中学2018-2019学年高二上学期期末考试化学试题云南省峨山彝族自治县第一中学2018-2019学年高二6月月考化学试题广西南宁市“4N”高中联合体2018-2019学年高二下学期期末考试化学试题(已下线)2019年11月2日 《每日一题》选修4-周末培优(已下线)2019年11月10日 《每日一题》选修4——每周一测黑龙江省牡丹江市第三高级中学2019-2020学年高二上学期期中考试化学(理)试题贵州省金沙中学2019年普通高中学生学业基础水平测试化学试题河北省石家庄市元氏县第四中学2019-2020学年高二下学期期末考试化学试题辽宁省葫芦岛市第八高级中学2020-2021学年高二上学期期中考试化学试题湖南省长郡中学2020-2021学年高二上学期期中考试化学试题吉林长春市榆树高级中学2019-2020学年高二下学期期末考试化学试题(已下线)北京市石景山区2010学年第一学期期末考试试卷吉林省汪清县第六中学2019届高三上学期第二次月考化学试题甘肃省兰州市第四片区2020-2021学年高二上学期期末考试化学试题青海省西宁市海湖中学2020-2021学年高二下学期开学考试化学试题安徽省六安市新安中学2020-2021学年高二上学期期末考试(普通班)化学试题湖南省长沙市长郡中学2021-2022学年高二上学期期中考试化学试题浙江省浙北G2(湖州中学、嘉兴一中)2021-2022学年高二上学期期中联考化学试题人教2019版选择性必修一第三章 第三节 盐类的水解 课后习题湘鄂冀三省益阳平高学校、长沙市平高中学等七校联考2021-2022学年高二上学期期中考试化学试题吉林省长春市农安县2021-2022学年高二上学期期末考试化学试题宁夏青铜峡市高级中学2021-2022学年高二上学期11月测试化学试题黑龙江省哈尔滨市第三十二中学校2021-2022学年高二下学期期中考试化学试题甘肃省武威市凉州区2021-2022学年高二上学期期末考试化学试题青海省西宁市大通回族土族自治县2021-2022学年高二上学期期末考试化学试题云南省玉溪市通海县第三中学2021-2022学年高二上学期期末考试化学试题甘肃省武威市凉州区2020-2021学年高二上学期期末考试化学试题新疆疏勒县实验学校2021-2022学年高二上学期期末考试化学试题天津市南开大学附属中学2022-2023学年高二上学期期末考试化学试卷天津市东丽区2021-2022学年高二上学期期末考试化学试题吉林省辽源市等2地高中友好学校2022-2023学年高二上学期期末联考化学试题山西省太原市2022-2023学年高二下学期2月期末考试化学试题吉林省辽源、通化等2市2022-2023学年高二上学期1月期末考试化学试题青海省海南藏族自治州高级中学2022-2023学年高二下学期期末考试化学试题湖南省长沙市明德中学2023-2024学年高二上学期第一次月考化学试题北京市第八十中学2023-2024学年高二上学期期中考试化学试题【精品卷】3.3.1 盐类的水解课堂例题-人教版2023-2024学年选择性必修1(已下线)专题06 盐类的水解-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(天津专用)福建省厦门市集美区2023-2024学年高二上学期12月月考化学试题湖南省张家界市民族中学2023-2024学年高二上学期期中考试化学试题四川省甘孜藏族自治州泸定中学2023-2024学年高二上学期11月期中考试化学试题(已下线)专题20 用守恒思想破解溶液中粒子浓度大小的比较-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)
8 . 常温下,向 溶液中缓慢加入少量
溶液中缓慢加入少量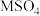 粉末(已知MS难溶,忽略溶液体积变化),溶液中
粉末(已知MS难溶,忽略溶液体积变化),溶液中 与
与 变化如图所示(坐标未按比例画出),已知:
变化如图所示(坐标未按比例画出),已知: ,
, 。
。 表示
表示 的平衡常数。下列有关说法正确的是
的平衡常数。下列有关说法正确的是

 溶液中缓慢加入少量
溶液中缓慢加入少量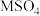 粉末(已知MS难溶,忽略溶液体积变化),溶液中
粉末(已知MS难溶,忽略溶液体积变化),溶液中 与
与 变化如图所示(坐标未按比例画出),已知:
变化如图所示(坐标未按比例画出),已知: ,
, 。
。 表示
表示 的平衡常数。下列有关说法正确的是
的平衡常数。下列有关说法正确的是
A.a点溶液中 约为 约为 |
B.a、b、c三点中由水电离的 最大的是c点 最大的是c点 |
C. 数量级为 数量级为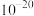 |
D.c点溶液中 |
您最近一年使用:0次
2022-12-28更新
|
437次组卷
|
7卷引用:安徽省安庆市2020届高三第三次模拟考试理综化学试题
安徽省安庆市2020届高三第三次模拟考试理综化学试题上海市嘉定区第二中学2023-2024学年高二上学期期中质量检测化学等级考试题(已下线)考点26 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)2021年高考全国乙卷化学试题变式题(已下线)考点29 沉淀溶解平衡-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)化学预测卷(八)-预测卷(浙江专版)(已下线)2023年1月浙江省普通高校招生选考变式题(选择题11-16)
名校
解题方法
9 . 下列离子方程式正确的是
A.NaHS溶于水:NaHS H++S2-+Na+ H++S2-+Na+ |
B.NaHCO3溶液中的水解平衡:HCO +H2O +H2O H3O++CO H3O++CO |
C.(NH4)2SO4溶于水:(NH4)2SO4 2NH 2NH +SO +SO |
D.HF溶于水:HF+H2O H3O++F- H3O++F- |
您最近一年使用:0次
2022-12-10更新
|
69次组卷
|
3卷引用:【全国百强校】四川省成都市石室中学2018-2019学年高二上学期期中考试化学试题
名校
解题方法
10 . 下列说法正确的是
A.常温下,0.1mol·L-1CH3COONa溶液加水稀释后,溶液中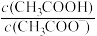 的值增大 的值增大 |
| B.常温下,等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同 |
| C.常温下,反应NH3(g)+HCl(g)=NH4Cl(s)能自发发生反应,则该反应的∆H>0 |
D.常温下,向BaCO3、BaSO4 的饱和溶液中加入少量BaCl2固体,溶液中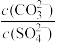 减小 减小 |
您最近一年使用:0次
2022-12-09更新
|
286次组卷
|
6卷引用:辽宁省大连市普兰店区第三十八中学2021届高三上学期第四次考试化学试题



