名校
解题方法
1 . 25℃时,关于浓度均为0.1 mol/L的三种溶液:①醋酸、②NaOH、③醋酸钠溶液,下列说法不正确 的是
| A.若测得0.1 mol/L CH3COONa溶液显碱性,则可证明醋酸是弱电解质 |
| B.①和③等体积混合后的溶液:c(CH3COO-)>c(Na+)> c(CH3COOH) > c(H+)>c(OH-) |
| C.①和②等体积混合后的溶液:c(OH-)=c(H+)+c(CH3COOH) |
| D.若用0.1 mol/L的某一元酸HA与②混合,若pH=7,则VHA≤VNaOH |
您最近一年使用:0次
名校
2 . 下列有关含碳微粒的说法,按要求填空:
(1)常温下,0.1mol·L-1的Na2CO3溶液的碱性___________ 0.1mol·L-1的 NaHCO3 溶液的碱性(填“大于”、“小于”、“等于”),请设计一个较简便的实验证明___________ 。
(2)相同温度下,将浓度均为0.1mol·L-1的Na2CO3和 NaHCO3 溶液按体积比1:1混合,则该混合溶液中物料守恒等式为___________ ;该混合溶液中离子浓度由大到小的顺序是___________ 。
(3)在25 ℃时,在10 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液20 mL,溶液中含碳微粒的物质的量随溶液pH的变化如图所示。
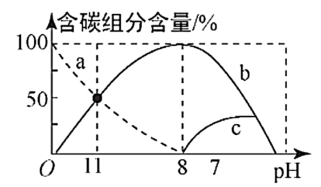
①HCl溶液滴加到一半时,溶液呈___________ (填“酸性”、“碱性”或“中性”),理由是___________ (用主要的离子方程式表示)。
②关于图象下列说法不正确的是___________ 。
A、b曲线代表CO
B、0.1 mol/L Na2CO3溶液中: c(OH-) = 2c(H2CO3) + c(HCO )+c(H+)
)+c(H+)
C、pH=11时,c(HCO ) > c(Cl-)
) > c(Cl-)
D、pH=11 时,c(Na+) + c(H+) = 3c(CO ) + c(OH-)
) + c(OH-)
E、在同一溶液中,H2CO3、HCO 、CO
、CO 不能大量共存
不能大量共存
(1)常温下,0.1mol·L-1的Na2CO3溶液的碱性
(2)相同温度下,将浓度均为0.1mol·L-1的Na2CO3和 NaHCO3 溶液按体积比1:1混合,则该混合溶液中物料守恒等式为
(3)在25 ℃时,在10 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液20 mL,溶液中含碳微粒的物质的量随溶液pH的变化如图所示。

①HCl溶液滴加到一半时,溶液呈
②关于图象下列说法不正确的是
A、b曲线代表CO

B、0.1 mol/L Na2CO3溶液中: c(OH-) = 2c(H2CO3) + c(HCO
 )+c(H+)
)+c(H+)C、pH=11时,c(HCO
 ) > c(Cl-)
) > c(Cl-)D、pH=11 时,c(Na+) + c(H+) = 3c(CO
 ) + c(OH-)
) + c(OH-)E、在同一溶液中,H2CO3、HCO
 、CO
、CO 不能大量共存
不能大量共存
您最近一年使用:0次
名校
3 . 25℃时,关于浓度均为0.1mol/L的三种溶液:①醋酸、②NaOH、③醋酸钠溶液,下列说法不正确 的是
| A.若测得0.1mol/LCH3COONa溶液显碱性,则可证明醋酸是弱电解质 |
| B.若用0.1mol/L的某一元酸HA与②混合,若pH=7,则VHA≤VNaOH |
| C.①和②等体积混合后的溶液:c(OH-)=c(H+)+c(CH3COOH) |
| D.①和③等体积混合后的溶液:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
您最近一年使用:0次
名校
4 . 下列表述中,说法正确的个数是( )
①pH=6的溶液一定是酸性溶液
②常温下某CH3COONa溶液的pH=8能证明CH3COOH是弱电解质
③CO2的水溶液导电能力很弱,所以CO2是弱电解质
④用未知浓度的盐酸滴定KOH标准溶液,若读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏高
⑤25℃时,水溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14
⑥氯化铵溶液中含有杂质氯化铁,可以加入氨水调节pH至7~8,使Fe3+生成Fe(OH)3沉淀而出除去
⑦如果Na2Y的水溶液显中性,该溶液中一定没有电离平衡
⑧Mg与NH4Cl溶液反应生成H2以及为保存FeCl3溶液,要在溶液中加少量盐酸都与盐类水解有关
⑨某温度下,在难溶电解质AB2的饱和溶液中,c(A2+)=amol/L,c(B-)=bmol/L,则该温度下,AB2的Ksp为ab2
①pH=6的溶液一定是酸性溶液
②常温下某CH3COONa溶液的pH=8能证明CH3COOH是弱电解质
③CO2的水溶液导电能力很弱,所以CO2是弱电解质
④用未知浓度的盐酸滴定KOH标准溶液,若读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏高
⑤25℃时,水溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14
⑥氯化铵溶液中含有杂质氯化铁,可以加入氨水调节pH至7~8,使Fe3+生成Fe(OH)3沉淀而出除去
⑦如果Na2Y的水溶液显中性,该溶液中一定没有电离平衡
⑧Mg与NH4Cl溶液反应生成H2以及为保存FeCl3溶液,要在溶液中加少量盐酸都与盐类水解有关
⑨某温度下,在难溶电解质AB2的饱和溶液中,c(A2+)=amol/L,c(B-)=bmol/L,则该温度下,AB2的Ksp为ab2
| A.3 | B.4 | C.5 | D.6 |
您最近一年使用:0次
名校
5 . 下列有关含碳微粒的说法,按要求填空:
(1)同温度,同浓度的Na2CO3溶液的碱性_________ NaHCO3溶液的碱性(填“大于”、“小于”或“等于”),请设计一个较简便的实验证明___________ 。
(2)在25 ℃时,在10 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液20 mL,溶液中含碳微粒的物质的量随溶液pH的变化如图所示。

①HCl溶液滴加到一半时,溶液呈___________ (填“酸性”、“碱性”或“中性”),理由是____________________ (用主要的离子方程式表示)。
②关于图象下列说法正确的是_________________ 。
A、0.1 mol/L Na2CO3溶液中:c(Na+) + c(H+) = c(OH-) + 2c(CO32-) + c(HCO3-)
B、b曲线代表CO32-
C、pH=11时,c(HCO3-) > c(Cl-)
D、pH=11 时,c(Na+) + c(H+) = 3c(CO32-) + c(OH-)
E、在同一溶液中,H2CO3、HCO3-、CO32-能大量共存
(3)草酸(H2C2O4)溶液具有还原性,将酸性KMnO4溶液滴入草酸溶液中,会产生气泡,且紫红色褪去,写出该反应的离子方程式________________ 。
(1)同温度,同浓度的Na2CO3溶液的碱性
(2)在25 ℃时,在10 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液20 mL,溶液中含碳微粒的物质的量随溶液pH的变化如图所示。

①HCl溶液滴加到一半时,溶液呈
②关于图象下列说法正确的是
A、0.1 mol/L Na2CO3溶液中:c(Na+) + c(H+) = c(OH-) + 2c(CO32-) + c(HCO3-)
B、b曲线代表CO32-
C、pH=11时,c(HCO3-) > c(Cl-)
D、pH=11 时,c(Na+) + c(H+) = 3c(CO32-) + c(OH-)
E、在同一溶液中,H2CO3、HCO3-、CO32-能大量共存
(3)草酸(H2C2O4)溶液具有还原性,将酸性KMnO4溶液滴入草酸溶液中,会产生气泡,且紫红色褪去,写出该反应的离子方程式
您最近一年使用:0次
名校
解题方法
6 . 草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。H2CO3 K1=4.5×10-7 K2= 4.7×10-11 , 草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
(1)写出水溶液中草酸的电离方程式:_____________________________________________ ;
(2)生活中,常用热纯碱溶液清洗油污,纯碱溶液遇酚酞显红色,请用离子方程式解释显红色的原因:________________________________________________________________ ;
(3)相同条件下等物质的量浓度的Na2C2O4溶液的pH比Na2CO3溶液的pH_____ (填“大”、“小”或“相等”);
(4)向1L 0.02mol/L H2C2O4溶液中滴加1L 0.01mol/L NaOH溶液。混合溶液中c(H+)>c(OH-),下列说法中正确的是( )
A.c(H2C2O4)>c(HC2O4-) B.c(Na+)+c(H+)=2c(C2O42-)+ c(HC2O4-)+c(OH-)
C.c(OH-)= c(H+)+2c(H2C2O4)+c(HC2O4-) D.c(H2C2O4)+c(C2O42-)+c(HC2O4-)=0.02mol/L
(5)甲同学按照图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象____________________ ,由此可知草酸晶体分解的产物中有__________________________ 。装置B的主要作用是_______________________________ 。

(6)设计实验证明:
①草酸的酸性比碳酸的强_________________________________________________________ 。
②草酸为二元酸_________________________________________________________________ 。
(1)写出水溶液中草酸的电离方程式:
(2)生活中,常用热纯碱溶液清洗油污,纯碱溶液遇酚酞显红色,请用离子方程式解释显红色的原因:
(3)相同条件下等物质的量浓度的Na2C2O4溶液的pH比Na2CO3溶液的pH
(4)向1L 0.02mol/L H2C2O4溶液中滴加1L 0.01mol/L NaOH溶液。混合溶液中c(H+)>c(OH-),下列说法中正确的是
A.c(H2C2O4)>c(HC2O4-) B.c(Na+)+c(H+)=2c(C2O42-)+ c(HC2O4-)+c(OH-)
C.c(OH-)= c(H+)+2c(H2C2O4)+c(HC2O4-) D.c(H2C2O4)+c(C2O42-)+c(HC2O4-)=0.02mol/L
(5)甲同学按照图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象

(6)设计实验证明:
①草酸的酸性比碳酸的强
②草酸为二元酸
您最近一年使用:0次
名校
7 . 短周期元素 a~g 在表中的位置如右表,请回答下列问题:
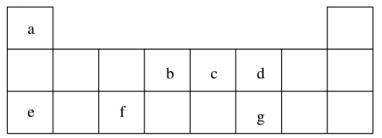
(1)d、e元素常见离子的半径由大到小的顺序为(用化学式表示)__________ ;b、c两元素非金属性较强的是(写元素符号)_________ ,写出能证明这一结论的一个化学方程式_____________ 。
(2)下列有关说法正确的是( )
A.e在 d2 中燃烧,生成e2d
B.加热熔化eda时不可用Al2O3坩埚,可用瓷坩埚
C.将 gd2 通入溴水中,溴水褪色,体现了gd2 的漂白性
D.将打磨过的 f 置于酒精灯上点燃,观察到f 熔化但未见液滴滴落
(3)上述元素可组成盐 R:ca4f(gd4)2和盐S:ca4agd4。
①相同条件下,0.1 mol·L-1盐R中 c(ca4+)_______ (填“=”、 “>”或“<”)0.1 mol·L-1盐S中c(ca4+)。
②R常用作净水剂,其原理为(用离子方程式表示)______________ 。
③向盛有 10 mL 1 mol·L-1盐S溶液的烧杯中滴加1 mol·L-1 NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是_____________ 。
④向盛有 10 mL 1 mol·L-1盐R溶液的烧杯中滴加 1 mol·L-1NaOH溶液 32 mL后,继续滴加至35 mL,写出此时段(32 mL~35 mL)间发生的离子方程式:_____________ 。

(1)d、e元素常见离子的半径由大到小的顺序为(用化学式表示)
(2)下列有关说法正确的是
A.e在 d2 中燃烧,生成e2d
B.加热熔化eda时不可用Al2O3坩埚,可用瓷坩埚
C.将 gd2 通入溴水中,溴水褪色,体现了gd2 的漂白性
D.将打磨过的 f 置于酒精灯上点燃,观察到f 熔化但未见液滴滴落
(3)上述元素可组成盐 R:ca4f(gd4)2和盐S:ca4agd4。
①相同条件下,0.1 mol·L-1盐R中 c(ca4+)
②R常用作净水剂,其原理为(用离子方程式表示)
③向盛有 10 mL 1 mol·L-1盐S溶液的烧杯中滴加1 mol·L-1 NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是
④向盛有 10 mL 1 mol·L-1盐R溶液的烧杯中滴加 1 mol·L-1NaOH溶液 32 mL后,继续滴加至35 mL,写出此时段(32 mL~35 mL)间发生的离子方程式:
您最近一年使用:0次
2017-10-21更新
|
707次组卷
|
3卷引用:四川省成都市第七中学2017-2018学年高二上学期第一次月考化学试题
名校
解题方法
8 . 下列实验能达到预期目的是
A.向含有酚酞的 溶液中加入少量 溶液中加入少量 固体,溶液红色变浅,证明 固体,溶液红色变浅,证明 溶液中存在水解平衡 溶液中存在水解平衡 |
B.室温下,用pH试纸测定浓度为0.1mol/LNaClO溶液和 溶液的pH,比较HClO和 溶液的pH,比较HClO和 的酸性强弱 的酸性强弱 |
C.等体积 的HX和HY两种酸分别与足量的锌粒反应,排水法收集气体,HX反应结束后放出的氢气多且反应过程中反应速率快,证明HX酸性比HY强 的HX和HY两种酸分别与足量的锌粒反应,排水法收集气体,HX反应结束后放出的氢气多且反应过程中反应速率快,证明HX酸性比HY强 |
D.向10mL0.2mol/LNaOH溶液中滴加2滴 溶液,产生白色沉淀后,再滴加2滴 溶液,产生白色沉淀后,再滴加2滴 溶液,又生成红褐色沉淀,证明在相同温度下Ksp: 溶液,又生成红褐色沉淀,证明在相同温度下Ksp: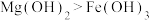 |
您最近一年使用:0次
2023-06-21更新
|
131次组卷
|
16卷引用:山西省长治市第二中学2019-2020学年高二上学期第一次月考化学试题
山西省长治市第二中学2019-2020学年高二上学期第一次月考化学试题鲁科版(2019)选择性必修1 模块综合测评人教版(2019)高二选择性必修第一册 模块综合测评广东省梅州市2021-2022学年高二上学期期末考试化学试题河南省南乐县第一高级中学2021-2022学年高二下学期3月月考化学试题江苏省泰州中学2021-2022学年高二下学期期中考试化学试题河南省安阳市第一中学2020-2021学年高二上学期期末考试化学试题湖南省长沙市南雅中学2022-2023学年高二上学期第三次月考化学试题江苏省南通市海安李堡中学2021-2022学年高二上学期期中考试化学试题宁夏回族自治区银川一中2022-2023学年高二上学期期末考试化学试题江苏省徐州市沛县2022-2023学年高二下学期5月月考化学试题广西南宁市2022-2023学年高二下学期开学考试化学试题四川省遂宁市射洪中学校2023-2024学年高二上学期(强基班)11月月考化学试题新疆石河子第一中学2023-2024学年高二上学期12月月考化学试题安徽省合肥市第一中学2023-2024学年高二上学期12月月考化学试题湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题
9 . 醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐,已知:25℃,醋酸与氨水的电离平衡常数数值均为1×10-5。请回答:
(1)0.1 mol/L的醋酸溶液的pH等于___________ (由于醋酸电离常数很小,平衡时c(CH3COOH)可近似视为0.1mol/L);
(2)用实验确定醋酸是弱电解质。两同学的方案是:
甲:①取一定量的醋酸配制0.1 mol·L-1的溶液100 mL;
②用pH试纸测出该溶液的PH,即可证明醋酸是弱电解质
乙:①用已知物质的量浓度的醋酸溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察,即可证明醋酸是弱电解质。
甲方案中,说明醋酸是弱电解质的理由是测得溶液的pH___________ 1(填“>”、“<”或“=”)。乙方案中,说明醋酸是弱电解质的现象是___________ 。
A.装HCl溶液的试管中放出H2的速率快;
B.装醋酸溶液的试管中放出H2的速率快;
C.两个试管中产生气体速率一样快。
乙方案存在不妥之处:锌粒的表面积可能不同,影响实验结果。方案中还有难以实现之处:___________ 。
(3)根据题干数据分析,0.1 mol/L 的醋酸铵溶液中,醋酸根离子浓度___________ 铵根离子浓度(填“大于”、“小于”或“等于”)。
(4)25 ℃时,向0.1 mol/L醋酸溶液中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。
对上述现象有两种不同的解释:
甲同学认为醋酸钠水解呈碱性,增大了[OH-],因而使溶液的pH增大;
乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使[H+]减小,因此溶液的pH值增大。为证实乙同学分析的合理性,设计如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中的___________ (填写编号),然后测定溶液的pH,其溶液的pH应___________ (填“增大”、“减小”或“不变”)。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
E.固体NaOH F.气体HCl
(5)25 ℃时,在醋酸钠溶液中离子浓度由大到小的顺序为___________ ;
(6)醋酸钠水解平衡常数表达式为:Kh=___________ ,25 ℃时,0.1 mol/L 的醋酸钠溶液的pH等于___________ (此空计算时可合理近似 );
(7)物质的量浓度均为0.1 mol/L的CH3COONa和CH3COOH溶液等体积混合后溶液的pH<7(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是___________ 。
A.[Na+]=2 [CH3COO-]+2[CH3COOH]
B.[Na+]+[H+]=[CH3COO-]+[OH-]
C.[CH3COO-]+[CH3COOH]=0.1mol/L
D.[Na+]> [CH3COO-]> [H+]> [OH-]
E.[Na+]+[OH-] =[CH3COOH]+[H+]
F.[CH3COOH]+[H+]=[CH3COO-]+[OH-]
(1)0.1 mol/L的醋酸溶液的pH等于
(2)用实验确定醋酸是弱电解质。两同学的方案是:
甲:①取一定量的醋酸配制0.1 mol·L-1的溶液100 mL;
②用pH试纸测出该溶液的PH,即可证明醋酸是弱电解质
乙:①用已知物质的量浓度的醋酸溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察,即可证明醋酸是弱电解质。
甲方案中,说明醋酸是弱电解质的理由是测得溶液的pH
A.装HCl溶液的试管中放出H2的速率快;
B.装醋酸溶液的试管中放出H2的速率快;
C.两个试管中产生气体速率一样快。
乙方案存在不妥之处:锌粒的表面积可能不同,影响实验结果。方案中还有难以实现之处:
(3)根据题干数据分析,0.1 mol/L 的醋酸铵溶液中,醋酸根离子浓度
(4)25 ℃时,向0.1 mol/L醋酸溶液中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。
对上述现象有两种不同的解释:
甲同学认为醋酸钠水解呈碱性,增大了[OH-],因而使溶液的pH增大;
乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使[H+]减小,因此溶液的pH值增大。为证实乙同学分析的合理性,设计如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中的
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
E.固体NaOH F.气体HCl
(5)25 ℃时,在醋酸钠溶液中离子浓度由大到小的顺序为
(6)醋酸钠水解平衡常数表达式为:Kh=
(7)物质的量浓度均为0.1 mol/L的CH3COONa和CH3COOH溶液等体积混合后溶液的pH<7(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是
A.[Na+]=2 [CH3COO-]+2[CH3COOH]
B.[Na+]+[H+]=[CH3COO-]+[OH-]
C.[CH3COO-]+[CH3COOH]=0.1mol/L
D.[Na+]> [CH3COO-]> [H+]> [OH-]
E.[Na+]+[OH-] =[CH3COOH]+[H+]
F.[CH3COOH]+[H+]=[CH3COO-]+[OH-]
您最近一年使用:0次
名校
10 . 下列实验能达到预期目的的是
| 实验内容 | 实验目的 | |
| A | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| B | 室温下,用pH试纸分别测定浓度为18 mol·L-1和0.1 mol·L-1H2SO4溶液的pH | 比较不同浓度硫酸的酸性强弱 |
| C | 配制FeCl2溶液时,先将FeCl2溶于适量浓盐酸中,再用蒸馏水稀释到所需浓度,最后在试剂瓶中加入少量铜粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
| D | 向盛有2 mL 0.01 mol·L-1 AgNO3溶液的试管中滴加2滴0.01 mol·L-1 NaCl溶液,有白色沉淀生成,再向其中滴加 2滴0.01 mol·L-1 NaI溶液,产生黄色沉淀 | 证明在相同温度下Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-12-21更新
|
346次组卷
|
5卷引用:湖北省孝感高级中学2017-2018学年高二上学期期末考试化学试题



