草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。H2CO3 K1=4.5×10-7 K2= 4.7×10-11 , 草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
(1)写出水溶液中草酸的电离方程式:_____________________________________________ ;
(2)生活中,常用热纯碱溶液清洗油污,纯碱溶液遇酚酞显红色,请用离子方程式解释显红色的原因:________________________________________________________________ ;
(3)相同条件下等物质的量浓度的Na2C2O4溶液的pH比Na2CO3溶液的pH_____ (填“大”、“小”或“相等”);
(4)向1L 0.02mol/L H2C2O4溶液中滴加1L 0.01mol/L NaOH溶液。混合溶液中c(H+)>c(OH-),下列说法中正确的是( )
A.c(H2C2O4)>c(HC2O4-) B.c(Na+)+c(H+)=2c(C2O42-)+ c(HC2O4-)+c(OH-)
C.c(OH-)= c(H+)+2c(H2C2O4)+c(HC2O4-) D.c(H2C2O4)+c(C2O42-)+c(HC2O4-)=0.02mol/L
(5)甲同学按照图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象____________________ ,由此可知草酸晶体分解的产物中有__________________________ 。装置B的主要作用是_______________________________ 。

(6)设计实验证明:
①草酸的酸性比碳酸的强_________________________________________________________ 。
②草酸为二元酸_________________________________________________________________ 。
(1)写出水溶液中草酸的电离方程式:
(2)生活中,常用热纯碱溶液清洗油污,纯碱溶液遇酚酞显红色,请用离子方程式解释显红色的原因:
(3)相同条件下等物质的量浓度的Na2C2O4溶液的pH比Na2CO3溶液的pH
(4)向1L 0.02mol/L H2C2O4溶液中滴加1L 0.01mol/L NaOH溶液。混合溶液中c(H+)>c(OH-),下列说法中正确的是
A.c(H2C2O4)>c(HC2O4-) B.c(Na+)+c(H+)=2c(C2O42-)+ c(HC2O4-)+c(OH-)
C.c(OH-)= c(H+)+2c(H2C2O4)+c(HC2O4-) D.c(H2C2O4)+c(C2O42-)+c(HC2O4-)=0.02mol/L
(5)甲同学按照图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象

(6)设计实验证明:
①草酸的酸性比碳酸的强
②草酸为二元酸
更新时间:2018-11-04 21:27:06
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】I.过氧化氢的性质:过氧化氢(H2O2)俗名双氧水,医疗上可作外科消毒剂,是一种二元弱酸且具有氧化性和还原性。
(1)请写出H2O2与Ba(OH)2溶液反应生成的酸式盐的电子式___________ 。
(2)水电离生成H3O+和OH-叫做水的自偶电离。同水一样,H2O2也有极弱的自偶电离,其自偶电离的方程式为___________ 。
(3)过氧化铬(CrO5,分子结构为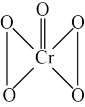 )中Cr的化合价为
)中Cr的化合价为___________ ;过氧化铬可通过酸性K2Cr2O7溶液与过氧化氢反应制得,写出该反应的离子方程式___________ 。
II.用过氧化氢制取过氧化钙:过氧化钙(CaO2)在室温下稳定,加热至350℃左右,迅速分解。微溶于水,不溶于乙醇,可溶于稀酸生成过氧化氢。实验室用如下方法制备CaO2并测定其纯度。过氧化钙的制备实验装置和步骤如下:

将盛有H2O2溶液和氨水混合液的三颈烧瓶置于冷水浴中,在搅拌下滴入CaCl2溶液,析出固体CaO2·8H2O。对所得固体过滤,用5mL无水乙醇洗涤2~3次,转移至坩埚于烘箱内105℃下脱水干燥,冷却后称重,得产品CaO2。回答下列问题:
(4)仪器 a的名称为___________ 。
(5)三颈烧瓶中发生反应的化学方程式为___________ 。
(6)判断脱水干燥是否完全,至少需要冷却后称重___________ 次。
(7)过氧化钙纯度的测定,装置如图所示。检查装置气密性后,精确称取m g过氧化钙样品加入试管中,调整甲管内液面读数在0~1 mL之间,并与乙管的液面相平,记下甲管内液面的初读数V1 mL。加热,过氧化钙逐渐分解放出氧气,完全分解,停止加热冷却至室温后,使甲乙两管的液面相平,记下甲管内液面的终读数V2 mL,设在此温度和压强下气体摩尔体积为Vm L·mol-1,则样品中CaO2的质量分数为___________ %。若甲管初始读数时俯视刻度,则测定结果___________ (填“偏高”、“偏低”或“无影响”)。

(1)请写出H2O2与Ba(OH)2溶液反应生成的酸式盐的电子式
(2)水电离生成H3O+和OH-叫做水的自偶电离。同水一样,H2O2也有极弱的自偶电离,其自偶电离的方程式为
(3)过氧化铬(CrO5,分子结构为
 )中Cr的化合价为
)中Cr的化合价为II.用过氧化氢制取过氧化钙:过氧化钙(CaO2)在室温下稳定,加热至350℃左右,迅速分解。微溶于水,不溶于乙醇,可溶于稀酸生成过氧化氢。实验室用如下方法制备CaO2并测定其纯度。过氧化钙的制备实验装置和步骤如下:

将盛有H2O2溶液和氨水混合液的三颈烧瓶置于冷水浴中,在搅拌下滴入CaCl2溶液,析出固体CaO2·8H2O。对所得固体过滤,用5mL无水乙醇洗涤2~3次,转移至坩埚于烘箱内105℃下脱水干燥,冷却后称重,得产品CaO2。回答下列问题:
(4)仪器 a的名称为
(5)三颈烧瓶中发生反应的化学方程式为
(6)判断脱水干燥是否完全,至少需要冷却后称重
(7)过氧化钙纯度的测定,装置如图所示。检查装置气密性后,精确称取m g过氧化钙样品加入试管中,调整甲管内液面读数在0~1 mL之间,并与乙管的液面相平,记下甲管内液面的初读数V1 mL。加热,过氧化钙逐渐分解放出氧气,完全分解,停止加热冷却至室温后,使甲乙两管的液面相平,记下甲管内液面的终读数V2 mL,设在此温度和压强下气体摩尔体积为Vm L·mol-1,则样品中CaO2的质量分数为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】纯过氧化氢是淡蓝色的黏稠液体,可与水以任意比混合,其水溶液俗称双氧水,为无色透明液体。实验室常用过氧化氢制取氧气,工业上过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组的同学围绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学习任务:
(1)写出过氧化氢的电子式:________ 。
(2)实验室中用过氧化氢制取氧气的化学方程式为_______________ ,当生成标准状况下1.12 L O2时,转移电子为________ mol。
(3)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在水溶液中的电离方程式:______________________ 。
(4)同学们用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2+6H+===2Mn2++8H2O+5O2↑。
①在该反应中,H2O2被________ (填“氧化”或“还原”)。
②滴定到达终点的现象是______________________________________ 。
③用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
则试样中过氧化氢的浓度为________ mol·L-1。
④若滴定前尖嘴中有气泡,滴定后消失,则测定结果____ (填“偏低”、“偏高”或“不变”)。
(5)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失。关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色。请设计一个简单的实验方案来判断甲、乙两位同学的说法是否正确_____________________ 。
(1)写出过氧化氢的电子式:
(2)实验室中用过氧化氢制取氧气的化学方程式为
(3)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在水溶液中的电离方程式:
(4)同学们用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2+6H+===2Mn2++8H2O+5O2↑。
①在该反应中,H2O2被
②滴定到达终点的现象是
③用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 17.00 | 16.90 |
④若滴定前尖嘴中有气泡,滴定后消失,则测定结果
(5)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失。关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色。请设计一个简单的实验方案来判断甲、乙两位同学的说法是否正确
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】硫化氢的转化是资源利用和环境保护的重要研究课题。
(1)工业上利用克劳斯法将H2S转化为硫单质回收。为实现硫的最大回收,部分 H2S燃烧先生成SO2,SO2和剩余的H2S反应的物质的量之比为_______ 。
(2)硫化氢(H2S)是一种有毒、有害的不良气体。处理某废气中的 H2S,是将废气与空气混合通入FeCl2、CuCl2、FeCl3的混合液中,其转化的流程如图所示。
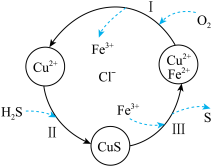
①参与循环的阳离子有Cu2+、_______ 。
②过程Ⅲ中发生的离子反应为:_______ 。
③H2S 是一种弱酸,试用化学原理解释过程Ⅱ能发生的原因是:_______ 。
④该循环过程总反应为:_______ 。
(3)将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2--2e-=S;(n-1)S+S2-=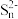
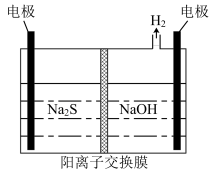
①写出电解时阴极的电极反应式:_______
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成_______ 。
(1)工业上利用克劳斯法将H2S转化为硫单质回收。为实现硫的最大回收,部分 H2S燃烧先生成SO2,SO2和剩余的H2S反应的物质的量之比为
(2)硫化氢(H2S)是一种有毒、有害的不良气体。处理某废气中的 H2S,是将废气与空气混合通入FeCl2、CuCl2、FeCl3的混合液中,其转化的流程如图所示。

①参与循环的阳离子有Cu2+、
②过程Ⅲ中发生的离子反应为:
③H2S 是一种弱酸,试用化学原理解释过程Ⅱ能发生的原因是:
④该循环过程总反应为:
(3)将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2--2e-=S;(n-1)S+S2-=
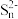

①写出电解时阴极的电极反应式:
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】用含砷氧化铜矿[含CuO、Cu2(OH)2CO3、As2O3、重金属盐及SiO2等]制取Cu2(OH)2SO4的工艺流程如下:
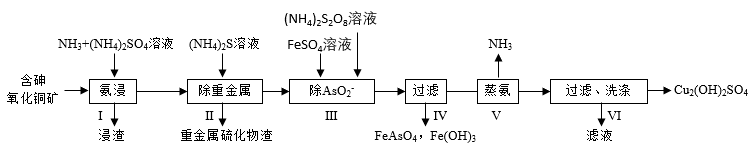
(1)步骤I“氨浸”时,控制温度为60〜65℃,pH约为9.5,含铜化合物转化为 溶液。
溶液。
①浸取温度不宜超过65℃,其原因是_________________ 。
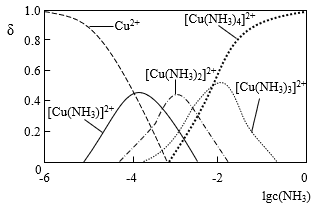
②Cu2+与NH3结合时,溶液中含铜微粒的物质的量分布分数( )与溶液中游离的c(NH3)的对数值的关系如图所示。若用1L浸取液(由等物质的量NH3和NH4+组成)将amolCu2(OH)2CO3全部浸出为
)与溶液中游离的c(NH3)的对数值的关系如图所示。若用1L浸取液(由等物质的量NH3和NH4+组成)将amolCu2(OH)2CO3全部浸出为 (
( 转变为
转变为 ,不考虑其他反应,溶液体积变化忽略不计),则Cu2(OH)2CO3被浸取的离子方程式为
,不考虑其他反应,溶液体积变化忽略不计),则Cu2(OH)2CO3被浸取的离子方程式为_________________ ,原浸取液中起始时c(NH3)应满足的条件是_________________ 。
(2)除重金属时,用到(NH4)2S溶液,写出该溶液中存在物料守恒式________ 。
(3)“除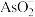 ”时,加入的试剂是(NH4)2S2O8和FeSO4。(NH4)2S2O8中S元素的化合价为
”时,加入的试剂是(NH4)2S2O8和FeSO4。(NH4)2S2O8中S元素的化合价为_________________ ,H2S2O8的结构式为_______ ;
(4)“蒸氨”时发生反应的化学方程式为_________________

(1)步骤I“氨浸”时,控制温度为60〜65℃,pH约为9.5,含铜化合物转化为
 溶液。
溶液。①浸取温度不宜超过65℃,其原因是
②Cu2+与NH3结合时,溶液中含铜微粒的物质的量分布分数(
 )与溶液中游离的c(NH3)的对数值的关系如图所示。若用1L浸取液(由等物质的量NH3和NH4+组成)将amolCu2(OH)2CO3全部浸出为
)与溶液中游离的c(NH3)的对数值的关系如图所示。若用1L浸取液(由等物质的量NH3和NH4+组成)将amolCu2(OH)2CO3全部浸出为 (
( 转变为
转变为 ,不考虑其他反应,溶液体积变化忽略不计),则Cu2(OH)2CO3被浸取的离子方程式为
,不考虑其他反应,溶液体积变化忽略不计),则Cu2(OH)2CO3被浸取的离子方程式为
(2)除重金属时,用到(NH4)2S溶液,写出该溶液中存在物料守恒式
(3)“除
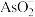 ”时,加入的试剂是(NH4)2S2O8和FeSO4。(NH4)2S2O8中S元素的化合价为
”时,加入的试剂是(NH4)2S2O8和FeSO4。(NH4)2S2O8中S元素的化合价为(4)“蒸氨”时发生反应的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】烟气的主要污染物为SO2和NO,是造成大气污染的重要因素,其治理方法主要有液体吸收法,固体吸收法,氧化反应法,电解法等。
(1)烟气中的SO2可以用“亚硫酸铵吸收法”处理,发生的反应为(NH4)2SO3+SO2+H2O=2NH4HSO3,测得25℃时溶液pH与各组分物质的量分数的变化关系如图,b点时溶液pH=7,n( ):n(
):n( )=
)=_______ 。

(2)一种基于吸收剂区分的同时脱硫脱硝反应的装置如图所示。反应器I吸收SO2,反应器II吸收NO,隔绝空气反应一段时间。
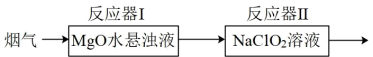
①当观察到反应器I中悬浊液变澄清时,反应的离子方程式_______ 。
②反应器II中所发生的反应为4NO+3 +2H2O=4
+2H2O=4 +3Cl-+4H+,盛有100mL0.15mol·L-1NaClO2溶液最多能吸收NO(标准状况下)的体积为
+3Cl-+4H+,盛有100mL0.15mol·L-1NaClO2溶液最多能吸收NO(标准状况下)的体积为_______ 。
③已知:NaClO2溶液中含氯组分的百分含量(δ)随pH变化如图甲所示,其他条件相同,NaClO2溶液中脱硝效率随溶液初始pH的变化如图乙所示。脱硝过程中,起脱硝作用的有效成分为_______ (填化学式)。将NaClO2溶液的pH从4调节至3的过程中,脱硝效率几乎不变的原因是_______ 。

(3)隔膜电解同时脱硫脱硝的装置如图所示,其中电极A、B均为惰性电极,电解液为稀硫酸。为了提高脱除效率,将阴极室的溶液pH调至4~7,则阴极上的电极反应为_______ 。

(1)烟气中的SO2可以用“亚硫酸铵吸收法”处理,发生的反应为(NH4)2SO3+SO2+H2O=2NH4HSO3,测得25℃时溶液pH与各组分物质的量分数的变化关系如图,b点时溶液pH=7,n(
 ):n(
):n( )=
)=
(2)一种基于吸收剂区分的同时脱硫脱硝反应的装置如图所示。反应器I吸收SO2,反应器II吸收NO,隔绝空气反应一段时间。

①当观察到反应器I中悬浊液变澄清时,反应的离子方程式
②反应器II中所发生的反应为4NO+3
 +2H2O=4
+2H2O=4 +3Cl-+4H+,盛有100mL0.15mol·L-1NaClO2溶液最多能吸收NO(标准状况下)的体积为
+3Cl-+4H+,盛有100mL0.15mol·L-1NaClO2溶液最多能吸收NO(标准状况下)的体积为③已知:NaClO2溶液中含氯组分的百分含量(δ)随pH变化如图甲所示,其他条件相同,NaClO2溶液中脱硝效率随溶液初始pH的变化如图乙所示。脱硝过程中,起脱硝作用的有效成分为

(3)隔膜电解同时脱硫脱硝的装置如图所示,其中电极A、B均为惰性电极,电解液为稀硫酸。为了提高脱除效率,将阴极室的溶液pH调至4~7,则阴极上的电极反应为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】亚硝酸是一种具有较强氧化性的弱酸, ,
, 可用于滴定分析。
可用于滴定分析。

完成下列填空:
(1)常温下, 的
的 溶液pH
溶液pH___________ 7(填“>”、“<”或“=”);原因是___________ (用离子方程式表示)。
(2) 溶液中部分微粒组分及浓度如图所示,X表示的是
溶液中部分微粒组分及浓度如图所示,X表示的是___________ (填写微粒化学式)。
___________  (填写具体数值)。
(填写具体数值)。
(3) 用于测药物中对氨基苯磺酸
用于测药物中对氨基苯磺酸 的含量。
的含量。
测定原理为:酸性环境中,先由 制备
制备 ,
, 再与
再与 以物质的量比1∶1发生反应。
以物质的量比1∶1发生反应。
①下列能用来制备 的是
的是___________ 。
A.亚硫酸( ) B.稀硫酸 C.次氯酸
) B.稀硫酸 C.次氯酸
②当 和少量KI共存时,
和少量KI共存时, 会先与
会先与 完全反应后,再氧化KI.滴定时用KI-淀粉糊剂作指示剂,滴定终点时淀粉糊剂显
完全反应后,再氧化KI.滴定时用KI-淀粉糊剂作指示剂,滴定终点时淀粉糊剂显___________ 色。
③用该法测定含 药物样品的纯度,每次取0.400g样品,用
药物样品的纯度,每次取0.400g样品,用 标准溶液进行滴定,实验结果如下。
标准溶液进行滴定,实验结果如下。
则该样品中对氨基苯磺酸的纯度是___________ 。
第一次实验数据异常的原因可能是___________ 。
a.锥形瓶洗净后未干燥
b.滴定时剧烈振荡锥形瓶,造成少量液体飞溅
c.装标准溶液的滴定管未用标准溶液润洗
(4)已知298K时, 的
的 。
。
向 的
的 溶液中逐滴滴加
溶液中逐滴滴加 溶液。
溶液。
当溶液中 时,溶液的pH=
时,溶液的pH=___________ (保留2位有效数字),此时溶液中
___________ 为(取整数)。
 ,
, 可用于滴定分析。
可用于滴定分析。
完成下列填空:
(1)常温下,
 的
的 溶液pH
溶液pH(2)
 溶液中部分微粒组分及浓度如图所示,X表示的是
溶液中部分微粒组分及浓度如图所示,X表示的是
 (填写具体数值)。
(填写具体数值)。(3)
 用于测药物中对氨基苯磺酸
用于测药物中对氨基苯磺酸 的含量。
的含量。测定原理为:酸性环境中,先由
 制备
制备 ,
, 再与
再与 以物质的量比1∶1发生反应。
以物质的量比1∶1发生反应。①下列能用来制备
 的是
的是A.亚硫酸(
 ) B.稀硫酸 C.次氯酸
) B.稀硫酸 C.次氯酸
②当
 和少量KI共存时,
和少量KI共存时, 会先与
会先与 完全反应后,再氧化KI.滴定时用KI-淀粉糊剂作指示剂,滴定终点时淀粉糊剂显
完全反应后,再氧化KI.滴定时用KI-淀粉糊剂作指示剂,滴定终点时淀粉糊剂显③用该法测定含
 药物样品的纯度,每次取0.400g样品,用
药物样品的纯度,每次取0.400g样品,用 标准溶液进行滴定,实验结果如下。
标准溶液进行滴定,实验结果如下。| 滴定次数 |  |
| 1 | 20.90 |
| 2 | 20.12 |
| 3 | 20.00 |
| 4 | 19.88 |
第一次实验数据异常的原因可能是
a.锥形瓶洗净后未干燥
b.滴定时剧烈振荡锥形瓶,造成少量液体飞溅
c.装标准溶液的滴定管未用标准溶液润洗
(4)已知298K时,
 的
的 。
。向
 的
的 溶液中逐滴滴加
溶液中逐滴滴加 溶液。
溶液。当溶液中
 时,溶液的pH=
时,溶液的pH=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)一定温度下,向1L0.1mol•L-1CH3COOH溶液中加入0.1molCH3COONa固体,则醋酸的电离平衡向_____ (填“正”或“逆”)反应方向移动;溶液中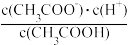 的值
的值_____ (填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3•H2O,已知:
a.常温下,CH3COOH和NH3•H2O的电离平衡常数均为1.74×10-5;b.CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈______ 性(填“酸”、“碱”或“中”),NH4HCO3溶液呈______ 性;NH4HCO3溶液中物质的量浓度最大的离子是_____ 。
(3)99℃时,Kw=1.0×10-12,该温度下测得0.1mol•L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为______ 。
②该温度下,将0.01mol•L-1H2A溶液稀释到20倍后,溶液的pH=______ 。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气______ 。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
④将0.1mol•L-1H2A溶液与0.2mol•L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为______ 。
(4)人们配制氯化铁溶液时,常将氯化铁晶体先溶于_____ ,然后再加水稀释,通过增加溶液中______ 离子的浓度,来抑制铁离子的水解,当实验室制备氢氧化铁胶体时,常采用的方法是向_______ 中滴加数滴氯化铁溶液,并持续加热至沸腾,以促进铁离子的水解。
(5)欲除去硫酸铜溶液中混有的少量铁离子和亚铁离子,可向溶液中加入少量稀硫酸和_____ ,再向溶液中加入_______ 和_____ ,调节溶液的pH至3~4,使含铁杂质离子转化为氢氧化铁沉淀而除去。
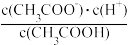 的值
的值(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3•H2O,已知:
a.常温下,CH3COOH和NH3•H2O的电离平衡常数均为1.74×10-5;b.CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈
(3)99℃时,Kw=1.0×10-12,该温度下测得0.1mol•L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为
②该温度下,将0.01mol•L-1H2A溶液稀释到20倍后,溶液的pH=
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气
A.盐酸多 B.H2A多 C.一样多 D.无法确定
④将0.1mol•L-1H2A溶液与0.2mol•L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为
(4)人们配制氯化铁溶液时,常将氯化铁晶体先溶于
(5)欲除去硫酸铜溶液中混有的少量铁离子和亚铁离子,可向溶液中加入少量稀硫酸和
您最近一年使用:0次
【推荐2】二氧化硫和氮氧化物都是常见的大气污染物,回答下列相关问题。
Ⅰ.某温度下氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
i. 2NO(g)+Cl2(g) 2ClNO(g) △H1<0 其平衡常数为K1
2ClNO(g) △H1<0 其平衡常数为K1
ii. 2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
(1)现有反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g), 则此反应的平衡常数K3=
2NaNO3(s)+2NO(g)+Cl2(g), 则此反应的平衡常数K3=_______ (用K1、K2表示),反应热△H3=_____ (用△H1、△H2表示)。
(2)为研究不同条件对反应ii的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO2和足够的NaCl(s),10min时反应ii达到平衡。测得平衡时NO2的转化率α1(NO2) =50%,则:10min内υ(ClNO) =___________________ ,平衡常数K2=_________________ ;
II.除氮氧化物外,SO2也是重要的大气污染物,需要对其进行吸收处理。
(3)若用一定量的NaOH溶液吸收SO2气体后所得吸收液恰好呈中性,下列有关吸收液中粒子关系正确的是______________ 。
A.c(Na+) = c(HSO3-)+ 2c(SO32-)
B.c(Na+) > c(HSO3-) =c(SO32-) > c(H+) = c(OH—)
C.2c(Na+) =3c(H2SO3)+3c(HSO3-)+3c(SO32-)
D.c(Na+) > c(HSO3—) + c(SO32—) +c(H2SO3)
(4)工业上也可以用Na2SO3溶液吸收SO2,并用电解法处理吸收后所得溶液以实现吸收液的回收再利用,装置如图所示,则
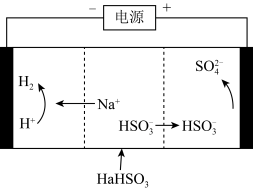
①工作一段时间后,阴极区溶液的pH______ (填“增大”“减小”或“不变”);
②写出阳极的电极反应式_______________________ 。
Ⅰ.某温度下氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
i. 2NO(g)+Cl2(g)
 2ClNO(g) △H1<0 其平衡常数为K1
2ClNO(g) △H1<0 其平衡常数为K1ii. 2NO2(g)+NaCl(s)
 NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2(1)现有反应4NO2(g)+2NaCl(s)
 2NaNO3(s)+2NO(g)+Cl2(g), 则此反应的平衡常数K3=
2NaNO3(s)+2NO(g)+Cl2(g), 则此反应的平衡常数K3=(2)为研究不同条件对反应ii的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO2和足够的NaCl(s),10min时反应ii达到平衡。测得平衡时NO2的转化率α1(NO2) =50%,则:10min内υ(ClNO) =
II.除氮氧化物外,SO2也是重要的大气污染物,需要对其进行吸收处理。
(3)若用一定量的NaOH溶液吸收SO2气体后所得吸收液恰好呈中性,下列有关吸收液中粒子关系正确的是
A.c(Na+) = c(HSO3-)+ 2c(SO32-)
B.c(Na+) > c(HSO3-) =c(SO32-) > c(H+) = c(OH—)
C.2c(Na+) =3c(H2SO3)+3c(HSO3-)+3c(SO32-)
D.c(Na+) > c(HSO3—) + c(SO32—) +c(H2SO3)
(4)工业上也可以用Na2SO3溶液吸收SO2,并用电解法处理吸收后所得溶液以实现吸收液的回收再利用,装置如图所示,则

①工作一段时间后,阴极区溶液的pH
②写出阳极的电极反应式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】请根据所学知识回答下列问题:
(1)“84”消毒液是一种以 为主要成分的高效消毒剂,
为主要成分的高效消毒剂, 溶液呈
溶液呈_____________ 性(填“酸”“碱”或“中”),原因可用离子方程式表示为_________________________ .
(2) 时,
时, 为3的硫酸铝溶液中,由水电离出的
为3的硫酸铝溶液中,由水电离出的 为
为_____________ .该温度下,若 的100体积某强酸溶液与
的100体积某强酸溶液与 的1体积某强碱溶液混合后溶液呈中性,则
的1体积某强碱溶液混合后溶液呈中性,则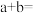
_____________ .
(3)向浓度均为 的
的 和
和 混合液中滴加碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滴加碳酸铵溶液至生成两种沉淀,则溶液中
_____________ .[已知: 、
、 ]
]
(4)相同条件下, 下列溶液中,
下列溶液中, 由小到大的排列顺序是
由小到大的排列顺序是_____________ (填序号).
A. B.
B. C.
C. D.
D.
(5)现用 溶液组成的燃料电池,采用电解法制备
溶液组成的燃料电池,采用电解法制备 ,装置如图所示.石墨Ⅱ电极为
,装置如图所示.石墨Ⅱ电极为_____________ (填“正极”或“负极”),写出石墨Ⅰ电极上发生反应的电极反应式:______________________ .在电解池中生成 的电极反应式为
的电极反应式为________________ .

(1)“84”消毒液是一种以
 为主要成分的高效消毒剂,
为主要成分的高效消毒剂, 溶液呈
溶液呈(2)
 时,
时, 为3的硫酸铝溶液中,由水电离出的
为3的硫酸铝溶液中,由水电离出的 为
为 的100体积某强酸溶液与
的100体积某强酸溶液与 的1体积某强碱溶液混合后溶液呈中性,则
的1体积某强碱溶液混合后溶液呈中性,则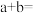
(3)向浓度均为
 的
的 和
和 混合液中滴加碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滴加碳酸铵溶液至生成两种沉淀,则溶液中
 、
、 ]
](4)相同条件下,
 下列溶液中,
下列溶液中, 由小到大的排列顺序是
由小到大的排列顺序是A.
 B.
B. C.
C. D.
D.
(5)现用
 溶液组成的燃料电池,采用电解法制备
溶液组成的燃料电池,采用电解法制备 ,装置如图所示.石墨Ⅱ电极为
,装置如图所示.石墨Ⅱ电极为 的电极反应式为
的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程
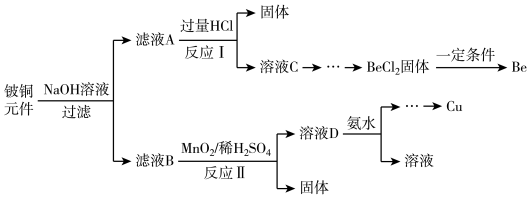
已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
(1)滤液A的主要成分除NaOH外,还有______________ (填化学式)
写出反应I中含铍化合物与过量盐酸反应的离子方程式____________________________
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序______________ 。
a加入过量的 NaOH b.通入过量的CO2 c加入过量的氨水
d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是____________________________
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式________________________________________________________ 。
②若用浓HNO3溶解金属硫化物,缺点是______________
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是______________ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于______________
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是_______________

已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
(1)滤液A的主要成分除NaOH外,还有
写出反应I中含铍化合物与过量盐酸反应的离子方程式
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序
a加入过量的 NaOH b.通入过量的CO2 c加入过量的氨水
d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式
②若用浓HNO3溶解金属硫化物,缺点是
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
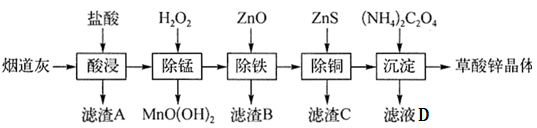
【推荐2】以炼锌厂的烟道灰(主要成分为ZnO,还含有少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O4·2H2O),其工艺流程如图所示:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
(1)酸浸后产生的金属阳离子主要有Zn2+,还有少量______ ;滤渣A的主要成分为______ (填化学式)。
(2)盐酸酸浸过程中,为了提高浸取效率,可采取的措施有______ (写出两条即可)。
(3)“除锰”过程中加入H2O2的作用为______ (用离子方程式表示)。
(4)“调pH”控制溶液的pH范围为3.3≤pH<5.4,滤渣B的成分有______ (填化学式)。
(5)生成滤渣C的离子方程式为______ 。
(6)滤液D和草酸锌晶体分离的操作为______ (写操作名称)。

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 1.9 | 4.2 | 5.4 |
| 完全沉淀时的pH | 3.3 | 6.7 | 8.2 |
(2)盐酸酸浸过程中,为了提高浸取效率,可采取的措施有
(3)“除锰”过程中加入H2O2的作用为
(4)“调pH”控制溶液的pH范围为3.3≤pH<5.4,滤渣B的成分有
(5)生成滤渣C的离子方程式为
(6)滤液D和草酸锌晶体分离的操作为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】海水是一个巨大的化学资源宝库.利用海水可以获得许许多多化工产品。
(1)由海水晒盐制得的氯化钠可用于氯碱工业的原料,以生产烧碱及氢气、氯气,该电解反应的离子方程式为__________________ 。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
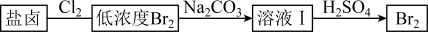
①溶液I →Br2的离子方程式为: Br-+BrO3-+H+——Br2+H2O(未配平),反应中氧化产物和还原产物的质量之比为___________ 。
②上图中低浓度Br2加Na2CO3、H2SO4处理的目的是___________________ 。
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子,以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
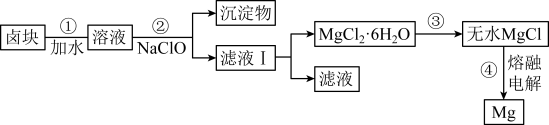
已知生成氢氧化物沉淀的pH如下:
①步骤②中需控制pH=9.8,其目的是____________________ 。
②步骤③操作时的注意事项:__________________ 。
③NaClO还能除去盐卤中的尿素[CO (NH2)2],生成盐类物质和能参与大气循环的物质,其反应原理为_____________ (用化学方程式表示),请你计算,若除去盐卤中含有的0.1molCO (NH2)2时需消耗NaCl)______ g。
(1)由海水晒盐制得的氯化钠可用于氯碱工业的原料,以生产烧碱及氢气、氯气,该电解反应的离子方程式为
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
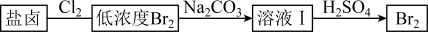
①溶液I →Br2的离子方程式为: Br-+BrO3-+H+——Br2+H2O(未配平),反应中氧化产物和还原产物的质量之比为
②上图中低浓度Br2加Na2CO3、H2SO4处理的目的是
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子,以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):

已知生成氢氧化物沉淀的pH如下:
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Mg(OH)2 |
| 开始沉淀 | 7.6 | 2.7 | 8.3 | 9.6 |
| 沉淀完全 | 9.6 | 3.7 | 9.8 | 11.1 |
②步骤③操作时的注意事项:
③NaClO还能除去盐卤中的尿素[CO (NH2)2],生成盐类物质和能参与大气循环的物质,其反应原理为
您最近一年使用:0次



