醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐,已知:25℃,醋酸与氨水的电离平衡常数数值均为1×10-5。请回答:
(1)0.1 mol/L的醋酸溶液的pH等于___________ (由于醋酸电离常数很小,平衡时c(CH3COOH)可近似视为0.1mol/L);
(2)用实验确定醋酸是弱电解质。两同学的方案是:
甲:①取一定量的醋酸配制0.1 mol·L-1的溶液100 mL;
②用pH试纸测出该溶液的PH,即可证明醋酸是弱电解质
乙:①用已知物质的量浓度的醋酸溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察,即可证明醋酸是弱电解质。
甲方案中,说明醋酸是弱电解质的理由是测得溶液的pH___________ 1(填“>”、“<”或“=”)。乙方案中,说明醋酸是弱电解质的现象是___________ 。
A.装HCl溶液的试管中放出H2的速率快;
B.装醋酸溶液的试管中放出H2的速率快;
C.两个试管中产生气体速率一样快。
乙方案存在不妥之处:锌粒的表面积可能不同,影响实验结果。方案中还有难以实现之处:___________ 。
(3)根据题干数据分析,0.1 mol/L 的醋酸铵溶液中,醋酸根离子浓度___________ 铵根离子浓度(填“大于”、“小于”或“等于”)。
(4)25 ℃时,向0.1 mol/L醋酸溶液中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。
对上述现象有两种不同的解释:
甲同学认为醋酸钠水解呈碱性,增大了[OH-],因而使溶液的pH增大;
乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使[H+]减小,因此溶液的pH值增大。为证实乙同学分析的合理性,设计如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中的___________ (填写编号),然后测定溶液的pH,其溶液的pH应___________ (填“增大”、“减小”或“不变”)。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
E.固体NaOH F.气体HCl
(5)25 ℃时,在醋酸钠溶液中离子浓度由大到小的顺序为___________ ;
(6)醋酸钠水解平衡常数表达式为:Kh=___________ ,25 ℃时,0.1 mol/L 的醋酸钠溶液的pH等于___________ (此空计算时可合理近似 );
(7)物质的量浓度均为0.1 mol/L的CH3COONa和CH3COOH溶液等体积混合后溶液的pH<7(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是___________ 。
A.[Na+]=2 [CH3COO-]+2[CH3COOH]
B.[Na+]+[H+]=[CH3COO-]+[OH-]
C.[CH3COO-]+[CH3COOH]=0.1mol/L
D.[Na+]> [CH3COO-]> [H+]> [OH-]
E.[Na+]+[OH-] =[CH3COOH]+[H+]
F.[CH3COOH]+[H+]=[CH3COO-]+[OH-]
(1)0.1 mol/L的醋酸溶液的pH等于
(2)用实验确定醋酸是弱电解质。两同学的方案是:
甲:①取一定量的醋酸配制0.1 mol·L-1的溶液100 mL;
②用pH试纸测出该溶液的PH,即可证明醋酸是弱电解质
乙:①用已知物质的量浓度的醋酸溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察,即可证明醋酸是弱电解质。
甲方案中,说明醋酸是弱电解质的理由是测得溶液的pH
A.装HCl溶液的试管中放出H2的速率快;
B.装醋酸溶液的试管中放出H2的速率快;
C.两个试管中产生气体速率一样快。
乙方案存在不妥之处:锌粒的表面积可能不同,影响实验结果。方案中还有难以实现之处:
(3)根据题干数据分析,0.1 mol/L 的醋酸铵溶液中,醋酸根离子浓度
(4)25 ℃时,向0.1 mol/L醋酸溶液中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。
对上述现象有两种不同的解释:
甲同学认为醋酸钠水解呈碱性,增大了[OH-],因而使溶液的pH增大;
乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使[H+]减小,因此溶液的pH值增大。为证实乙同学分析的合理性,设计如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中的
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
E.固体NaOH F.气体HCl
(5)25 ℃时,在醋酸钠溶液中离子浓度由大到小的顺序为
(6)醋酸钠水解平衡常数表达式为:Kh=
(7)物质的量浓度均为0.1 mol/L的CH3COONa和CH3COOH溶液等体积混合后溶液的pH<7(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是
A.[Na+]=2 [CH3COO-]+2[CH3COOH]
B.[Na+]+[H+]=[CH3COO-]+[OH-]
C.[CH3COO-]+[CH3COOH]=0.1mol/L
D.[Na+]> [CH3COO-]> [H+]> [OH-]
E.[Na+]+[OH-] =[CH3COOH]+[H+]
F.[CH3COOH]+[H+]=[CH3COO-]+[OH-]
更新时间:2022-06-29 09:26:14
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】已知K2Cr2O7溶液中存在平衡: +H2O
+H2O 2
2 +2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
Ⅰ.方案讨论
(1)ⅰ~ⅴ中依据减少生成物浓度可导致平衡移动的原理设计的是_____ (填序号)。
(2)已知BaCrO4为黄色沉淀。某同学认为试剂X还可设计为Ba(NO3)2溶液,加入该试剂后,溶液颜色将_____ 。(填“变深”、“变浅”或“不变”)。
Ⅱ.实验分析
(1)实验ⅰ没有观察到预期现象的原因是_____ ,实验ⅱ的原因与其相似。
(2)通过实验ⅲ和ⅴ得出的结论为_____ 。
(3)实验ⅳ无明显现象,可能的原因是____________ 。
(4)某同学查阅资料发现:K2Cr2O7溶液与浓盐酸可发生氧化还原反应。但实验ⅳ中没有观察到明显现象,小组同学设计了下实验,验证了该反应的发生。
方案:取5 mL浓盐酸,向其中加入15滴0.1mol·L-1 K2Cr2O7溶液,一段时间后,溶液变为绿色(CrCl3水溶液呈绿色),有黄绿色气体生成。写出该变化的化学方程式______ 。
 +H2O
+H2O 2
2 +2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。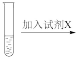 5mL0.1mol/LK2Cr2O7溶液 | 序号 | 试剂X |
| ⅰ | 1mL1mol·L-1 K2Cr2O7溶液 | |
| ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | |
| ⅲ | 5~15滴浓硫酸 | |
| ⅳ | 5~15滴浓盐酸 | |
| ⅴ | 5~15滴6 mol·L-1 NaOH溶液 |
(1)ⅰ~ⅴ中依据减少生成物浓度可导致平衡移动的原理设计的是
(2)已知BaCrO4为黄色沉淀。某同学认为试剂X还可设计为Ba(NO3)2溶液,加入该试剂后,溶液颜色将
Ⅱ.实验分析
| 序号 | 试剂X | 预期现象 | 实际现象 |
| ⅰ | 1 mL1 mol·L-1 K2Cr2O7溶液 | 溶液变黄 | 溶液橙色加深 |
| ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | 溶液橙色加深 | 溶液颜色变浅 |
| ⅲ | 5~15滴浓硫酸 | 溶液橙色加深 | 溶液橙色加深 |
| ⅳ | 5~15滴浓盐酸 | 溶液橙色加深 | 无明显现象 |
| ⅴ | 5~15滴6mol·L-1NaOH溶液 | 溶液变黄 | 溶液变黄 |
(2)通过实验ⅲ和ⅴ得出的结论为
(3)实验ⅳ无明显现象,可能的原因是
(4)某同学查阅资料发现:K2Cr2O7溶液与浓盐酸可发生氧化还原反应。但实验ⅳ中没有观察到明显现象,小组同学设计了下实验,验证了该反应的发生。
方案:取5 mL浓盐酸,向其中加入15滴0.1mol·L-1 K2Cr2O7溶液,一段时间后,溶液变为绿色(CrCl3水溶液呈绿色),有黄绿色气体生成。写出该变化的化学方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】图像分析是研究化学问题的重要手段。请分析以下图像,回答有关问题。
(1)理论分析在密闭容器中发生的反应: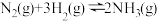
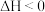 。不同时刻,保持其它条件不变,只改变某一个条件,正、逆反应速率随时间变化示意图如图所示。
。不同时刻,保持其它条件不变,只改变某一个条件,正、逆反应速率随时间变化示意图如图所示。

请在以下表格中填入各时刻改变的条件。
(2)密闭容器中,发生反应: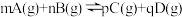
 。图为C的体积分数
。图为C的体积分数 在不同压强P下随时间t变化的曲线和A的转化率a(A)在不同压强下随温度T变化的曲线。
在不同压强P下随时间t变化的曲线和A的转化率a(A)在不同压强下随温度T变化的曲线。
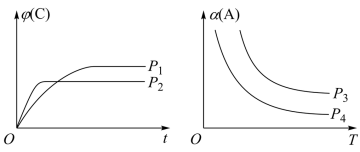
请回答下列问题(填“>”、“=”或“<”):
①m+n______ p+q。 ②
______ 0。 ③
______  。
。
(3)常温下,相同pH的盐酸和醋酸分别加水稀释,溶液中氢离子浓度随溶液体积变化曲线如图所示。
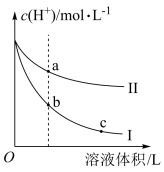
①曲线Ⅱ表示的是______ 稀释的变化曲线。
②将a点溶液与b点溶液混合,醋酸的电离平衡
 将向
将向______ 移动。
③a、b、c三点的导电能力大小顺序为______ 。
(1)理论分析在密闭容器中发生的反应:
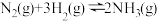
 。不同时刻,保持其它条件不变,只改变某一个条件,正、逆反应速率随时间变化示意图如图所示。
。不同时刻,保持其它条件不变,只改变某一个条件,正、逆反应速率随时间变化示意图如图所示。
请在以下表格中填入各时刻改变的条件。
| 时刻 |  |  |  |  |  | 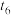 |
| 条件变化 | 使用 催化剂 | 增加 反应物 |
(2)密闭容器中,发生反应:
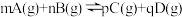
 。图为C的体积分数
。图为C的体积分数 在不同压强P下随时间t变化的曲线和A的转化率a(A)在不同压强下随温度T变化的曲线。
在不同压强P下随时间t变化的曲线和A的转化率a(A)在不同压强下随温度T变化的曲线。
请回答下列问题(填“>”、“=”或“<”):
①m+n


 。
。(3)常温下,相同pH的盐酸和醋酸分别加水稀释,溶液中氢离子浓度随溶液体积变化曲线如图所示。

①曲线Ⅱ表示的是
②将a点溶液与b点溶液混合,醋酸的电离平衡
 将向
将向③a、b、c三点的导电能力大小顺序为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】化学平衡移动原理同样也适用于其它平衡,已知在氨水中存在下列平衡:NH3·H2O NH
NH +OH-
+OH-
(1)向氨水中加入NH4Cl固体时,平衡___________ 移动,(填“向右”或“向左”),c(OH-)___________ (填“增大”或“减小”或“不变”)。
(2)向氨水中加入MgCl2固体时,平衡___________ 移动,(填“向右”或“向左”), c(NH )
)___________ (填“增大”或“减小”或“不变”)
(3)常温下,将pH=8的氨水和pH=6的盐酸等体积混合,混合后c(H+)___________ c(OH-)(填“大于”、“小于”或“等于”)
(4)用物质的量分别为0.1mol的HCN和NaCN配成1L混合溶液,已知其中c(CN-)小于c(Na+),则溶液中c(H+)___________ c(OH-)(填“大于”。“小于”或“等于”),c(HCN)+c(CN-)=___________ mol/L
(5)室温下将amol/L的HCN与0.1mol/L的NaOH溶液等体积混合,反应后溶液中c(Na+)=c(CN-),则溶液显___________ 性(填“酸”“碱”“中”),用a 的代数式表示HCN的电离平衡常数Ka= ___________
 NH
NH +OH-
+OH-(1)向氨水中加入NH4Cl固体时,平衡
(2)向氨水中加入MgCl2固体时,平衡
 )
)(3)常温下,将pH=8的氨水和pH=6的盐酸等体积混合,混合后c(H+)
(4)用物质的量分别为0.1mol的HCN和NaCN配成1L混合溶液,已知其中c(CN-)小于c(Na+),则溶液中c(H+)
(5)室温下将amol/L的HCN与0.1mol/L的NaOH溶液等体积混合,反应后溶液中c(Na+)=c(CN-),则溶液显
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】常温下,有 的四种溶液:①
的四种溶液:① ②
② ③
③ ④
④
(1)用化学用语解释溶液①呈酸性的原因:_______ 。
(2)溶液①、②分别与等量的溶液③恰好完全反应,消耗的体积:①_______ ②(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(3)溶液④加热后碱性增强,结合化学用语解释原因:_______ 。
(4)常温下,下列关于溶液②的判断正确的是_______ 。
a.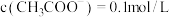
b.溶液中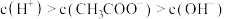
c.加入 不变
不变
d.滴入 浓溶液,溶液导电性增强
浓溶液,溶液导电性增强
 的四种溶液:①
的四种溶液:① ②
② ③
③ ④
④
(1)用化学用语解释溶液①呈酸性的原因:
(2)溶液①、②分别与等量的溶液③恰好完全反应,消耗的体积:①
 ”、“
”、“ ”或“
”或“ ”)。
”)。(3)溶液④加热后碱性增强,结合化学用语解释原因:
(4)常温下,下列关于溶液②的判断正确的是
a.
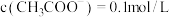
b.溶液中
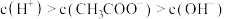
c.加入
 不变
不变d.滴入
 浓溶液,溶液导电性增强
浓溶液,溶液导电性增强
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】I.磷能形成多种含氧酸。
(1)次磷酸(H3PO2)是一种精细化工产品,向10mLH3PO2溶液中加入 等物质的量浓度的NaOH溶液后,所得的溶液中只有
等物质的量浓度的NaOH溶液后,所得的溶液中只有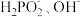 两种阴离子。
两种阴离子。
①写出H3PO2溶液与足量NaOH溶液反应后形成的正盐的化学式:_______ 。
②常温下,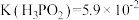 ,0.1mol/L的H3PO2溶液在加水稀释过程中,下列表达式的数据一定变小的是
,0.1mol/L的H3PO2溶液在加水稀释过程中,下列表达式的数据一定变小的是_______ (填标号)。
A.c(H+) B. C.
C.
(2)亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数为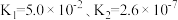 。试从电离平衡移动的角度解释
。试从电离平衡移动的角度解释 数据的差异:
数据的差异:_______ 。
(3)25℃时,HF的电离常数为 ;H3PO4的电离常数为
;H3PO4的电离常数为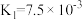 ,
,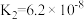 ,
,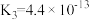 。足量
。足量 溶液和H3PO4溶液反应的离子方程式为
溶液和H3PO4溶液反应的离子方程式为_______ 。
(4)①相同温度下,等物质的量浓度的上述三种磷的含氧酸中,c(H+)由大到小的顺序为_______ (用酸的分子式表示)。
②已知: ,则
,则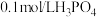 溶液与足量0.1mol/LNaOH溶液反应生成1molH2O(l)放出的热量为
溶液与足量0.1mol/LNaOH溶液反应生成1molH2O(l)放出的热量为_______ (填标号)。
A.=57.3kJ B.<57.3kJ C.>57.3kJ D.无法确定
II.已知25℃时水溶液呈弱碱性: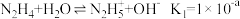 ;
; 。
。
(5)25℃时,向N2H4水溶液中加入H2SO4,欲使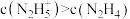 ,同时
,同时 ,应控制溶液中c(OH-)的范围为
,应控制溶液中c(OH-)的范围为_______ (用含a、b式子表示)。
(1)次磷酸(H3PO2)是一种精细化工产品,向10mLH3PO2溶液中加入
 等物质的量浓度的NaOH溶液后,所得的溶液中只有
等物质的量浓度的NaOH溶液后,所得的溶液中只有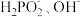 两种阴离子。
两种阴离子。①写出H3PO2溶液与足量NaOH溶液反应后形成的正盐的化学式:
②常温下,
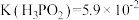 ,0.1mol/L的H3PO2溶液在加水稀释过程中,下列表达式的数据一定变小的是
,0.1mol/L的H3PO2溶液在加水稀释过程中,下列表达式的数据一定变小的是A.c(H+) B.
 C.
C.
(2)亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数为
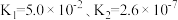 。试从电离平衡移动的角度解释
。试从电离平衡移动的角度解释 数据的差异:
数据的差异:(3)25℃时,HF的电离常数为
 ;H3PO4的电离常数为
;H3PO4的电离常数为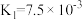 ,
,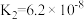 ,
,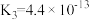 。足量
。足量 溶液和H3PO4溶液反应的离子方程式为
溶液和H3PO4溶液反应的离子方程式为(4)①相同温度下,等物质的量浓度的上述三种磷的含氧酸中,c(H+)由大到小的顺序为
②已知:
 ,则
,则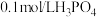 溶液与足量0.1mol/LNaOH溶液反应生成1molH2O(l)放出的热量为
溶液与足量0.1mol/LNaOH溶液反应生成1molH2O(l)放出的热量为A.=57.3kJ B.<57.3kJ C.>57.3kJ D.无法确定
II.已知25℃时水溶液呈弱碱性:
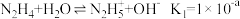 ;
; 。
。(5)25℃时,向N2H4水溶液中加入H2SO4,欲使
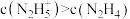 ,同时
,同时 ,应控制溶液中c(OH-)的范围为
,应控制溶液中c(OH-)的范围为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)①常温下,pH=3的盐酸和pH=11的氢氧化钡等体积混合,溶液的pH=____ 。
②常温下pH=3的盐酸和pH=6的盐酸等体积混合(不考虑混合时溶液的体积变化),溶液的pH=____ 。(lg2=0.3)
(2)在某温度下,H2O的离子积常数为1×10-13,则该温度下:
①某溶液中的H+浓度为1×10-7mol/L,则该溶液呈___ 性。
②99mLpH=1的H2SO4溶液与101mLpH=12的KOH溶液混合后(不考虑混合时溶液的体积变化),溶液的pH=___ 。
(3)今有①CH3COOH、②HCl、③H2SO4三种溶液,用序号回答下列问题:
a.当它们pH相同时,其物质的量浓度由大到小排列是___ 。
b.当它们的物质的量浓度相同时,其pH由大到小排列是___ 。
c.中和同一烧碱溶液,需同浓度的三种酸溶液的体积关系为___ 。(用等式表示)
d.体积和浓度均相同的①、②、③三溶液,分别与同浓度的烧碱溶液恰好完全反应,反应需烧碱溶液的体积关系为___ 。(用等式表示)
②常温下pH=3的盐酸和pH=6的盐酸等体积混合(不考虑混合时溶液的体积变化),溶液的pH=
(2)在某温度下,H2O的离子积常数为1×10-13,则该温度下:
①某溶液中的H+浓度为1×10-7mol/L,则该溶液呈
②99mLpH=1的H2SO4溶液与101mLpH=12的KOH溶液混合后(不考虑混合时溶液的体积变化),溶液的pH=
(3)今有①CH3COOH、②HCl、③H2SO4三种溶液,用序号回答下列问题:
a.当它们pH相同时,其物质的量浓度由大到小排列是
b.当它们的物质的量浓度相同时,其pH由大到小排列是
c.中和同一烧碱溶液,需同浓度的三种酸溶液的体积关系为
d.体积和浓度均相同的①、②、③三溶液,分别与同浓度的烧碱溶液恰好完全反应,反应需烧碱溶液的体积关系为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】下表数据是高三拓展教材P43页对应物质的熔点:
请根据上表中的信息回答下列问题:
(1)上述涉及到的元素中最活泼非金属原子核外电子排布式是___________ ,其核外有___________ 种不同运动状态的电子,能量最高且相同的电子有___________ 个。能形成简单离子的半径由大到小(用离子符号表示)___________ 。
(2)物质①的电子式___________ ,⑤的分子空间构型___________ ,⑧的晶体类型___________ 。
(3)④溶于水溶液呈酸性,用离子方程式表示其原因___________ ,若把其溶于加热蒸干并灼烧,得到的固体是___________ 。
(4)不能用于比较Na与Al金属性相对强弱的事实是___________。
(5)③比④熔点高出很多,其原因是:___________ 。①和②都属于离子晶体,但①比②的熔点高,请解释原因___________ 。
| 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 物质 | Na2O | NaCl | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
| 熔点℃ | 920 | 801 | 1291 | 160 | -107 | 2072 | -57 | 1723 |
请根据上表中的信息回答下列问题:
(1)上述涉及到的元素中最活泼非金属原子核外电子排布式是
(2)物质①的电子式
(3)④溶于水溶液呈酸性,用离子方程式表示其原因
(4)不能用于比较Na与Al金属性相对强弱的事实是___________。
| A.最高价氧化物对应水化物的碱性 |
| B.Na最外层1个电子,Al最外层3个电子 |
| C.单质与H2O反应的难易程度 |
| D.比较同温浓度NaCl和AlCl3的pH值 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】NO、CO、 是大气污染物但又有着重要用途。
是大气污染物但又有着重要用途。
已知: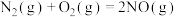
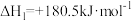
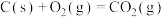
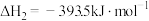
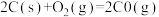
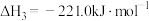
(1)某反应的平衡常数表达式为 ,此反应的热化学方程式为:
,此反应的热化学方程式为:______ 。
(2)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是______ (填序号)。
a.容器中的压强保持不变 b.
c.气体的平均相对分子质量保持34.2不变 d.该反应平衡常数保持不变
e.NO和CO的体积比保持不变
Ⅱ.(3)甲烷转化为 和CO的反应为:
和CO的反应为:

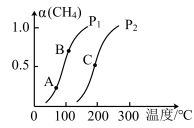
①一定条件下, 的平衡转化率与温度、压强的关系如图所示。则
的平衡转化率与温度、压强的关系如图所示。则
______  (填“<”“>”或“=”);
(填“<”“>”或“=”);
A、B、C三点处对应的平衡常数(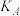 、
、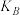 、
、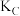 ),由大到小的顺序为
),由大到小的顺序为______ 。
②将 和
和 按等物质的量混合,一定条件下反应达到平衡,
按等物质的量混合,一定条件下反应达到平衡, 转化率为50%。则反应前与平衡后,混合气体的平均相对分子质量之比为
转化率为50%。则反应前与平衡后,混合气体的平均相对分子质量之比为______ 。
Ⅲ.含 的烟气可用
的烟气可用 溶液吸收。
溶液吸收。
(4)已知 时由
时由 ,和
,和 形成的混合溶液恰好呈中性,此时溶液中离子浓度大小顺序为
形成的混合溶液恰好呈中性,此时溶液中离子浓度大小顺序为______ 。(已知 时,
时, 的电离平衡常数
的电离平衡常数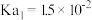 ,
,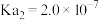 )
)
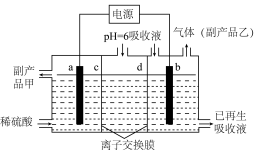
(5)可将吸收液送至电解槽再生后循环使用。再生电解槽如图所示。a电极上含硫微粒放电的反应式为______ (任写一个)。离子交换膜______ (填标号)为阴离子交换膜。
 是大气污染物但又有着重要用途。
是大气污染物但又有着重要用途。已知:
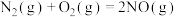
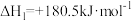
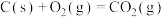
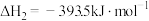
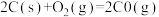
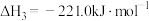
(1)某反应的平衡常数表达式为
 ,此反应的热化学方程式为:
,此反应的热化学方程式为:(2)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是
a.容器中的压强保持不变 b.

c.气体的平均相对分子质量保持34.2不变 d.该反应平衡常数保持不变
e.NO和CO的体积比保持不变
Ⅱ.(3)甲烷转化为
 和CO的反应为:
和CO的反应为:


①一定条件下,
 的平衡转化率与温度、压强的关系如图所示。则
的平衡转化率与温度、压强的关系如图所示。则
 (填“<”“>”或“=”);
(填“<”“>”或“=”);A、B、C三点处对应的平衡常数(
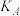 、
、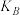 、
、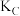 ),由大到小的顺序为
),由大到小的顺序为②将
 和
和 按等物质的量混合,一定条件下反应达到平衡,
按等物质的量混合,一定条件下反应达到平衡, 转化率为50%。则反应前与平衡后,混合气体的平均相对分子质量之比为
转化率为50%。则反应前与平衡后,混合气体的平均相对分子质量之比为Ⅲ.含
 的烟气可用
的烟气可用 溶液吸收。
溶液吸收。(4)已知
 时由
时由 ,和
,和 形成的混合溶液恰好呈中性,此时溶液中离子浓度大小顺序为
形成的混合溶液恰好呈中性,此时溶液中离子浓度大小顺序为 时,
时, 的电离平衡常数
的电离平衡常数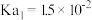 ,
,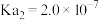 )
)(5)可将吸收液送至电解槽再生后循环使用。再生电解槽如图所示。a电极上含硫微粒放电的反应式为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】六水合硫酸镁铵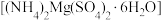 是一种常见复盐,白色晶体,微溶于冷水,难溶于乙醇。
是一种常见复盐,白色晶体,微溶于冷水,难溶于乙醇。
实验室制备步骤如下:
Ⅰ.称取 于100mL烧杯中,加入10mL蒸馏水,搅拌溶解。
于100mL烧杯中,加入10mL蒸馏水,搅拌溶解。
Ⅱ.称取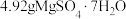 于100mL烧杯中,加入10mL蒸馏水,置于40℃水浴锅中。
于100mL烧杯中,加入10mL蒸馏水,置于40℃水浴锅中。
Ⅲ.将步骤Ⅰ所得的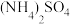 溶液倒入步骤Ⅱ的
溶液倒入步骤Ⅱ的 溶液中,搅拌混合充分,冰水浴20min,析出晶体。
溶液中,搅拌混合充分,冰水浴20min,析出晶体。
Ⅳ.减压过滤。用无水乙醇洗涤产品1~2次,抽干后,将晶体转移到蒸发皿里,置于40℃水浴锅中约30min,即可得 晶体。
晶体。
Ⅴ.所得晶体称重为mg。
回答下列问题:
(1)称取固体应采用___________ (填“托盘天平”或“电子天平”)。
(2)步骤Ⅰ所得溶液pH___________ 7(填“>”“<”或“=”),原因是___________ 。
(3)步骤Ⅲ的化学方程式是___________ ,下列关于该反应的说法正确的是___________ (填标号)。
A.发生氧化还原反应
B.物质之间溶解度差异导致反应发生
C.冰水浴有助于晶体充分析出
(4)步骤Ⅱ与步骤Ⅳ中都有“置于40℃水浴锅中”,其目的分别是___________ 。
(5)步骤Ⅳ中用无水乙醇洗涤产品的优点是___________ 。
(6)减压过滤也叫抽滤,可加快过滤速度。如图为减压过滤装置,实验过程中操作顺序是___________ ⑤⑥(填序号)。
①打开抽气泵开关,倒入固液混合物 ②修剪滤纸,使其略小于布氏漏斗,让滤纸与漏斗紧密贴合 ③安装仪器,检查是否漏气 ④开始抽滤 ⑤断开吸滤瓶接管 ⑥关抽气泵。___________ (用含m的代数式表示)。
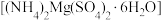 是一种常见复盐,白色晶体,微溶于冷水,难溶于乙醇。
是一种常见复盐,白色晶体,微溶于冷水,难溶于乙醇。实验室制备步骤如下:
Ⅰ.称取
 于100mL烧杯中,加入10mL蒸馏水,搅拌溶解。
于100mL烧杯中,加入10mL蒸馏水,搅拌溶解。Ⅱ.称取
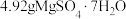 于100mL烧杯中,加入10mL蒸馏水,置于40℃水浴锅中。
于100mL烧杯中,加入10mL蒸馏水,置于40℃水浴锅中。Ⅲ.将步骤Ⅰ所得的
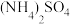 溶液倒入步骤Ⅱ的
溶液倒入步骤Ⅱ的 溶液中,搅拌混合充分,冰水浴20min,析出晶体。
溶液中,搅拌混合充分,冰水浴20min,析出晶体。Ⅳ.减压过滤。用无水乙醇洗涤产品1~2次,抽干后,将晶体转移到蒸发皿里,置于40℃水浴锅中约30min,即可得
 晶体。
晶体。Ⅴ.所得晶体称重为mg。
回答下列问题:
(1)称取固体应采用
(2)步骤Ⅰ所得溶液pH
(3)步骤Ⅲ的化学方程式是
A.发生氧化还原反应
B.物质之间溶解度差异导致反应发生
C.冰水浴有助于晶体充分析出
(4)步骤Ⅱ与步骤Ⅳ中都有“置于40℃水浴锅中”,其目的分别是
(5)步骤Ⅳ中用无水乙醇洗涤产品的优点是
(6)减压过滤也叫抽滤,可加快过滤速度。如图为减压过滤装置,实验过程中操作顺序是
①打开抽气泵开关,倒入固液混合物 ②修剪滤纸,使其略小于布氏漏斗,让滤纸与漏斗紧密贴合 ③安装仪器,检查是否漏气 ④开始抽滤 ⑤断开吸滤瓶接管 ⑥关抽气泵。

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】研究电解质在水溶液中的离子反应与平衡有重要的意义。
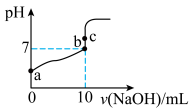
(1)常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/L 溶液的滴定曲线如图所示。
溶液的滴定曲线如图所示。
① 在水中的电离方程式为:
在水中的电离方程式为:___________ 。
②下列说法正确的是___________ 。
A.a点溶液的
B.b点溶液中: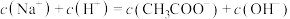
C.c点溶液中,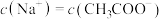
D.a、b、c三点中,c点时水的电离程度最大
(2)已知:25℃时CH3COOH、HClO、H2CO3和H3PO3的电离平衡常数:
①25℃时,浓度均为0.1mol/L的 溶液、NaClO溶液的碱性较大的是
溶液、NaClO溶液的碱性较大的是___________ 。
②25℃时,若初始时次氯酸溶液中HClO的物质的量浓度为0.1mol/L,达到电离平衡时溶液中
___________ mol/L。
③下列化学反应可能发生的是___________ 。
A.
B.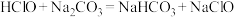
④亚磷酸( )为二元酸,具有较强的还原性
)为二元酸,具有较强的还原性 是
是_______ (填“酸式盐”、“碱式盐”或“正盐”)。
(1)常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/L
 溶液的滴定曲线如图所示。
溶液的滴定曲线如图所示。
①
 在水中的电离方程式为:
在水中的电离方程式为:②下列说法正确的是
A.a点溶液的

B.b点溶液中:
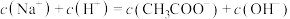
C.c点溶液中,
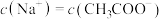
D.a、b、c三点中,c点时水的电离程度最大
(2)已知:25℃时CH3COOH、HClO、H2CO3和H3PO3的电离平衡常数:
| 化学式 |  | HClO |  |  |
| 名称 | 醋酸 | 次氯酸 | 碳酸 | 亚磷酸 |
| 电离平衡常数 |  |  | 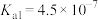  | 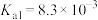 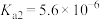 |
 溶液、NaClO溶液的碱性较大的是
溶液、NaClO溶液的碱性较大的是②25℃时,若初始时次氯酸溶液中HClO的物质的量浓度为0.1mol/L,达到电离平衡时溶液中

③下列化学反应可能发生的是
A.

B.
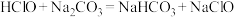
④亚磷酸(
 )为二元酸,具有较强的还原性
)为二元酸,具有较强的还原性 是
是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①0.1 mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______ c(HCO3 -)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液A.HCOONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________ (填编号)。
③已知25℃时,HCOOH( aq) +OH -( aq)=HCOO-(aq) +H2O(1) △H=-a kJ/mol
H+(aq) +OH-(aq) =H2O(1) △H=-b kJ/mol
甲酸电离的热化学方程式为______________ 。
④将少量CO2通入NaCN溶液,反应的离子方程式是____ 。
⑤室温下,—定浓度的HCOONa溶液pH =9,用离子方程式表示溶液呈碱性的原因是_____________ ,溶液中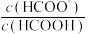 =
=___________ 。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。
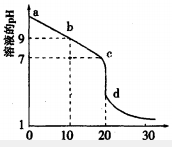
①d点所示的溶液中离子浓度由大到小的顺序依次为_______________ 。
②b点所示的溶液中c(NH3·H2O)-c(NH4+)=_____ (用溶液中的其它离子浓度表示)。
③pH =10的氨水与pH =4的NH4C1溶液中,由水电离出的c(H+)之比为____ 。
(3)已知Ksp(BaCO3) =2.6×l0-9,Ksp( BaSO4)=1.1×10-10.
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为____ mol/L。
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中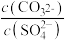 =
=___________ (保留三位有效数字)。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka = 1.77×10 -4 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①0.1 mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)
②常温下,pH相同的三种溶液A.HCOONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是
③已知25℃时,HCOOH( aq) +OH -( aq)=HCOO-(aq) +H2O(1) △H=-a kJ/mol
H+(aq) +OH-(aq) =H2O(1) △H=-b kJ/mol
甲酸电离的热化学方程式为
④将少量CO2通入NaCN溶液,反应的离子方程式是
⑤室温下,—定浓度的HCOONa溶液pH =9,用离子方程式表示溶液呈碱性的原因是
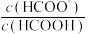 =
=(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。

①d点所示的溶液中离子浓度由大到小的顺序依次为
②b点所示的溶液中c(NH3·H2O)-c(NH4+)=
③pH =10的氨水与pH =4的NH4C1溶液中,由水电离出的c(H+)之比为
(3)已知Ksp(BaCO3) =2.6×l0-9,Ksp( BaSO4)=1.1×10-10.
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中
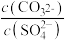 =
=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】平衡思想是化学研究的一个重要观念。电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①常温下,物质的量浓度相同的三种溶液:a. 、b.
、b. 、c.
、c. ,
, 由大到小的顺序是
由大到小的顺序是_______ (填序号)。
②室温下, 溶液
溶液 ,用离子方程式表示溶液呈碱性的原因是
,用离子方程式表示溶液呈碱性的原因是_______ ,溶液中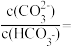
_______ 。
(2)室温下,用 盐酸滴定
盐酸滴定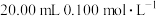 的氨水,滴定曲线如图所示。
的氨水,滴定曲线如图所示。
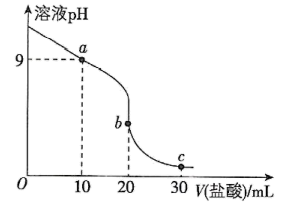
①a点所示的溶液中粒子浓度由大到小的顺序依次为_______ 
_______ 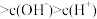 。
。
②c点所示的溶液中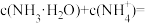
_______  (忽略溶液体积的变化)。
(忽略溶液体积的变化)。
(3)室温下, 、
、 的电离平衡常数分别为
的电离平衡常数分别为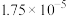 、
、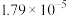 。下列溶液混合后,
。下列溶液混合后, 大于7的是
大于7的是_______ (填序号)。
① 的盐酸和
的盐酸和 的
的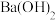 溶液等体积混合
溶液等体积混合
②等浓度、等体积 溶液、
溶液、 溶液混合
溶液混合
③ 的盐酸和
的盐酸和 的氨水等体积混合
的氨水等体积混合
④ 的醋酸溶液和
的醋酸溶液和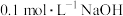 溶液等体积混合
溶液等体积混合
(1)已知部分弱酸的电离常数如下表:
| 弱酸 |  |  |  |
| 电离常数(25℃) |  | 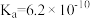 | 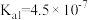 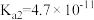 |
 、b.
、b. 、c.
、c. ,
, 由大到小的顺序是
由大到小的顺序是②室温下,
 溶液
溶液 ,用离子方程式表示溶液呈碱性的原因是
,用离子方程式表示溶液呈碱性的原因是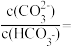
(2)室温下,用
 盐酸滴定
盐酸滴定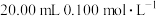 的氨水,滴定曲线如图所示。
的氨水,滴定曲线如图所示。
①a点所示的溶液中粒子浓度由大到小的顺序依次为

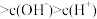 。
。②c点所示的溶液中
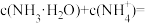
 (忽略溶液体积的变化)。
(忽略溶液体积的变化)。(3)室温下,
 、
、 的电离平衡常数分别为
的电离平衡常数分别为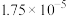 、
、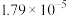 。下列溶液混合后,
。下列溶液混合后, 大于7的是
大于7的是①
 的盐酸和
的盐酸和 的
的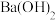 溶液等体积混合
溶液等体积混合②等浓度、等体积
 溶液、
溶液、 溶液混合
溶液混合③
 的盐酸和
的盐酸和 的氨水等体积混合
的氨水等体积混合④
 的醋酸溶液和
的醋酸溶液和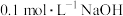 溶液等体积混合
溶液等体积混合
您最近一年使用:0次



