平衡思想是化学研究的一个重要观念。电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①常温下,物质的量浓度相同的三种溶液:a. 、b.
、b. 、c.
、c. ,
, 由大到小的顺序是
由大到小的顺序是_______ (填序号)。
②室温下, 溶液
溶液 ,用离子方程式表示溶液呈碱性的原因是
,用离子方程式表示溶液呈碱性的原因是_______ ,溶液中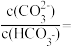
_______ 。
(2)室温下,用 盐酸滴定
盐酸滴定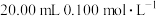 的氨水,滴定曲线如图所示。
的氨水,滴定曲线如图所示。
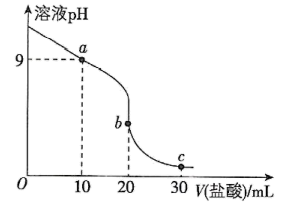
①a点所示的溶液中粒子浓度由大到小的顺序依次为_______ 
_______ 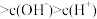 。
。
②c点所示的溶液中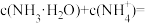
_______  (忽略溶液体积的变化)。
(忽略溶液体积的变化)。
(3)室温下, 、
、 的电离平衡常数分别为
的电离平衡常数分别为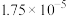 、
、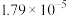 。下列溶液混合后,
。下列溶液混合后, 大于7的是
大于7的是_______ (填序号)。
① 的盐酸和
的盐酸和 的
的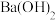 溶液等体积混合
溶液等体积混合
②等浓度、等体积 溶液、
溶液、 溶液混合
溶液混合
③ 的盐酸和
的盐酸和 的氨水等体积混合
的氨水等体积混合
④ 的醋酸溶液和
的醋酸溶液和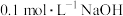 溶液等体积混合
溶液等体积混合
(1)已知部分弱酸的电离常数如下表:
| 弱酸 |  |  |  |
| 电离常数(25℃) |  | 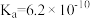 | 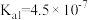 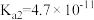 |
 、b.
、b. 、c.
、c. ,
, 由大到小的顺序是
由大到小的顺序是②室温下,
 溶液
溶液 ,用离子方程式表示溶液呈碱性的原因是
,用离子方程式表示溶液呈碱性的原因是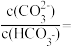
(2)室温下,用
 盐酸滴定
盐酸滴定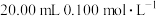 的氨水,滴定曲线如图所示。
的氨水,滴定曲线如图所示。
①a点所示的溶液中粒子浓度由大到小的顺序依次为

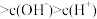 。
。②c点所示的溶液中
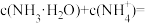
 (忽略溶液体积的变化)。
(忽略溶液体积的变化)。(3)室温下,
 、
、 的电离平衡常数分别为
的电离平衡常数分别为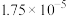 、
、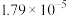 。下列溶液混合后,
。下列溶液混合后, 大于7的是
大于7的是①
 的盐酸和
的盐酸和 的
的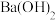 溶液等体积混合
溶液等体积混合②等浓度、等体积
 溶液、
溶液、 溶液混合
溶液混合③
 的盐酸和
的盐酸和 的氨水等体积混合
的氨水等体积混合④
 的醋酸溶液和
的醋酸溶液和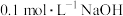 溶液等体积混合
溶液等体积混合
20-21高二·全国·单元测试 查看更多[2]
更新时间:2021/08/06 23:43:41
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】I.有下列物质:①石墨:②稀硫酸;③ ;④氨水;⑤
;④氨水;⑤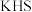 ;⑥
;⑥ ;⑦
;⑦ ;⑧
;⑧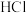 ;⑨
;⑨ 。
。
(1)属于非电解质的是___________ 。
(2)写出⑥在熔融状态下的电离方程式___________ 。
(3)向⑧溶液中加入醋酸钠晶体后,与足量的 粒反应,产生氢气的速率
粒反应,产生氢气的速率___________ (填“变快”、“变慢”、“不变”);产生氢气的总量___________ (填“增多”、“减少”、“不变”)。
II.在一容积为 的密闭容器中,加入
的密闭容器中,加入 的
的 和
和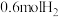 的,在一定条件下发生如下反应:
的,在一定条件下发生如下反应: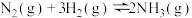
 。反应中
。反应中 的物质的量浓度的变化情况如图所示,请回答下列问题:
的物质的量浓度的变化情况如图所示,请回答下列问题:
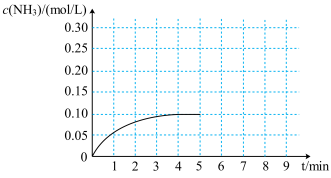
(4)该反应达到平衡时 的转化率为
的转化率为___________ 。
(5)反应达到平衡后,第 末,若保持其他条件不变,仅改变反应温度,则
末,若保持其他条件不变,仅改变反应温度,则 的物质的量浓度不可能为
的物质的量浓度不可能为___________ 。(填序号)。
a. b.
b.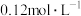 c.
c. d.
d.
(6)反应达到平衡后,第 末,若保持其他条件不变,只把容器的体积缩小一半,平衡
末,若保持其他条件不变,只把容器的体积缩小一半,平衡___________ 移动(填“向逆反应方向”、“向正反应方向”或“不”)。
(7)在第 末将容器的体积缩小一半后,若在第
末将容器的体积缩小一半后,若在第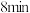 末达到新的平衡(此时
末达到新的平衡(此时 的浓度约为
的浓度约为 )。请在图中画出第
)。请在图中画出第 末到平衡时
末到平衡时 浓度的变化曲线
浓度的变化曲线___________ 。
 ;④氨水;⑤
;④氨水;⑤ ;⑥
;⑥ ;⑦
;⑦ ;⑧
;⑧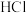 ;⑨
;⑨ 。
。(1)属于非电解质的是
(2)写出⑥在熔融状态下的电离方程式
(3)向⑧溶液中加入醋酸钠晶体后,与足量的
 粒反应,产生氢气的速率
粒反应,产生氢气的速率II.在一容积为
 的密闭容器中,加入
的密闭容器中,加入 的
的 和
和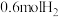 的,在一定条件下发生如下反应:
的,在一定条件下发生如下反应: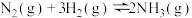
 。反应中
。反应中 的物质的量浓度的变化情况如图所示,请回答下列问题:
的物质的量浓度的变化情况如图所示,请回答下列问题:
(4)该反应达到平衡时
 的转化率为
的转化率为(5)反应达到平衡后,第
 末,若保持其他条件不变,仅改变反应温度,则
末,若保持其他条件不变,仅改变反应温度,则 的物质的量浓度不可能为
的物质的量浓度不可能为a.
 b.
b.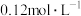 c.
c. d.
d.
(6)反应达到平衡后,第
 末,若保持其他条件不变,只把容器的体积缩小一半,平衡
末,若保持其他条件不变,只把容器的体积缩小一半,平衡(7)在第
 末将容器的体积缩小一半后,若在第
末将容器的体积缩小一半后,若在第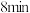 末达到新的平衡(此时
末达到新的平衡(此时 的浓度约为
的浓度约为 )。请在图中画出第
)。请在图中画出第 末到平衡时
末到平衡时 浓度的变化曲线
浓度的变化曲线
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】I.某温度下的水溶液中, ,
,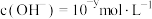 。x与y的关系如图所示:
。x与y的关系如图所示:
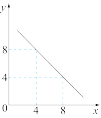
(1)该温度下水的离子积为_______ (填具体数值)。
(2)温度下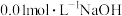 溶液的
溶液的 为
为_______ 。
(3)除了用 外,科学家还建议用酸度(
外,科学家还建议用酸度( )来表示溶液的酸碱性:
)来表示溶液的酸碱性: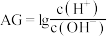 。则该温度下
。则该温度下 盐酸的酸度
盐酸的酸度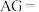
_______ 。
(4)该温度下, 的稀硫酸与
的稀硫酸与 的
的 溶液混合,溶液呈中性,则a、b的关系为
溶液混合,溶液呈中性,则a、b的关系为_______ 。
(5)该温度下,蒸馏水稀释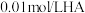 溶液时,下列呈减小趋势的是_______(填序号)。
溶液时,下列呈减小趋势的是_______(填序号)。
Ⅱ.室温下,取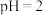 的盐酸和
的盐酸和 溶液各
溶液各 ,向其中分别加入适量的
,向其中分别加入适量的 粒,反应过程中两溶液的变化如图所示:
粒,反应过程中两溶液的变化如图所示:
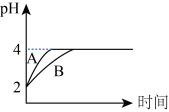
(6)图中表示 溶液
溶液 变化曲线的是
变化曲线的是_______ (填“A”或“B”)。
(7)设盐酸中加入 的质量为
的质量为 ,
, 溶液中加入
溶液中加入 的质量为
的质量为 ,则
,则
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
 ,
,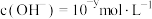 。x与y的关系如图所示:
。x与y的关系如图所示:
(1)该温度下水的离子积为
(2)温度下
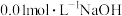 溶液的
溶液的 为
为(3)除了用
 外,科学家还建议用酸度(
外,科学家还建议用酸度( )来表示溶液的酸碱性:
)来表示溶液的酸碱性: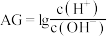 。则该温度下
。则该温度下 盐酸的酸度
盐酸的酸度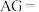
(4)该温度下,
 的稀硫酸与
的稀硫酸与 的
的 溶液混合,溶液呈中性,则a、b的关系为
溶液混合,溶液呈中性,则a、b的关系为(5)该温度下,蒸馏水稀释
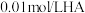 溶液时,下列呈减小趋势的是_______(填序号)。
溶液时,下列呈减小趋势的是_______(填序号)。| A.水的电离程度 | B. |
C.溶液中 和 和 的乘积 的乘积 | D.溶液中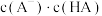 的值 的值 |
Ⅱ.室温下,取
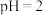 的盐酸和
的盐酸和 溶液各
溶液各 ,向其中分别加入适量的
,向其中分别加入适量的 粒,反应过程中两溶液的变化如图所示:
粒,反应过程中两溶液的变化如图所示:
(6)图中表示
 溶液
溶液 变化曲线的是
变化曲线的是(7)设盐酸中加入
 的质量为
的质量为 ,
, 溶液中加入
溶液中加入 的质量为
的质量为 ,则
,则
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】I.室温时,向100mL 0.1 HCl溶液中滴加0.1
HCl溶液中滴加0.1 氨水,得到溶液pH与氨水体积的关系曲线如图所示:
氨水,得到溶液pH与氨水体积的关系曲线如图所示:

(1)试分析图中a、b、c、d四个点,水的电离程度最大的是___________ ;
(2)在b点,溶液中各离子浓度由大到小的排列顺序是___________ ;
(3)写出a点混合溶液中下列算式的精确结果(不能近似计算):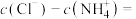
___________ ;
(4)25℃时,同浓度的下列溶液:①HCl;② ;③
;③ ;④
;④ ,其中pH由大到小的顺序是
,其中pH由大到小的顺序是___________ 。
Ⅱ.粗制MgCl2晶体中常含有杂质Fe2+。
(5)提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+转化为Fe3+,下列物质中最好采用___________ (填序号),写出对应的离子方程式___________
A.KMnO4 B.H2O2 C.HNO3 D.Na2O2
然后再加入适当物质调节溶液pH,可以达到除去Fe3+而不损失MgCl2的目的,调节溶液pH可选用的物质是___________ (填序号)。
A.Mg(OH)2 B.MgO C.NaOH D.Mg2(OH)2CO3
(6)常温下,Ksp[Fe(OH)3]=8.0×10-38,要使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10-5mol/L,此时溶液中c(H+)=___________ 。
 HCl溶液中滴加0.1
HCl溶液中滴加0.1 氨水,得到溶液pH与氨水体积的关系曲线如图所示:
氨水,得到溶液pH与氨水体积的关系曲线如图所示:
(1)试分析图中a、b、c、d四个点,水的电离程度最大的是
(2)在b点,溶液中各离子浓度由大到小的排列顺序是
(3)写出a点混合溶液中下列算式的精确结果(不能近似计算):
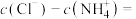
(4)25℃时,同浓度的下列溶液:①HCl;②
 ;③
;③ ;④
;④ ,其中pH由大到小的顺序是
,其中pH由大到小的顺序是Ⅱ.粗制MgCl2晶体中常含有杂质Fe2+。
(5)提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+转化为Fe3+,下列物质中最好采用
A.KMnO4 B.H2O2 C.HNO3 D.Na2O2
然后再加入适当物质调节溶液pH,可以达到除去Fe3+而不损失MgCl2的目的,调节溶液pH可选用的物质是
A.Mg(OH)2 B.MgO C.NaOH D.Mg2(OH)2CO3
(6)常温下,Ksp[Fe(OH)3]=8.0×10-38,要使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10-5mol/L,此时溶液中c(H+)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
① 醋酸在水溶液中的电离方程式为___________ 。
② 下列方法中,可以使醋酸稀溶液中 CH3COOH 电离程度增大的是___________ (填字母序号)。
a.滴加少量浓盐酸 b.微热溶液 c.加水稀释 d.加入少量醋酸钠晶体
(2)实验室现有醋酸钠固体,取少量溶于水,溶液呈___________ (选填“酸性”、“中性”或“碱性”),其原因是(用离子方程式表示)___________ 。
(3)常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL0.100 0 mol·L-1 CH3COOH溶液
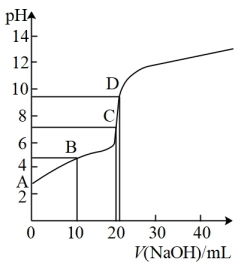
①B点和D点的溶质分别是___________ ,___________ 。
②图中A、B、C、D四点各点对应的溶液中水的电离程度大小顺序是______
(4)常温下,醋酸水溶液中含碳微粒的分布分数(平衡时某微粒的浓度占各含碳微粒总浓度的分数)与pH的关系如图。
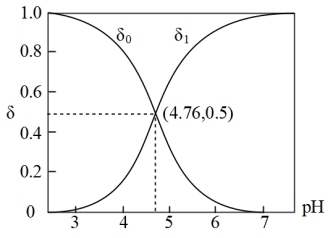
①常温下,CH3COOH的电离常数约为___________ 。
②当c(CH3COOH):C(CH3COO- )=4:1的混合溶液,pH≈______
(1)醋酸是常见的弱酸。
① 醋酸在水溶液中的电离方程式为
② 下列方法中,可以使醋酸稀溶液中 CH3COOH 电离程度增大的是
a.滴加少量浓盐酸 b.微热溶液 c.加水稀释 d.加入少量醋酸钠晶体
(2)实验室现有醋酸钠固体,取少量溶于水,溶液呈
(3)常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL0.100 0 mol·L-1 CH3COOH溶液

①B点和D点的溶质分别是
②图中A、B、C、D四点各点对应的溶液中水的电离程度大小顺序是
(4)常温下,醋酸水溶液中含碳微粒的分布分数(平衡时某微粒的浓度占各含碳微粒总浓度的分数)与pH的关系如图。

①常温下,CH3COOH的电离常数约为
②当c(CH3COOH):C(CH3COO- )=4:1的混合溶液,pH≈
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】Ⅰ.已知:2Na2S2O3+I2=Na2S4O6+2NaI。相关物质的溶度积常数见下表:
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入_______ ,(填化学式)调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=___________ 。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是_____________________ 。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,用淀粉溶液作指示剂,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①CuCl2溶液与KI反应的离子方程式为_________________ 。
②该试样中CuCl2·2H2O的质量百分数为________________ 。
Ⅱ.乙醇是重要的有机化工原料,可由乙烯直接水合法生产。
已知:乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g) △H=—45.5KJ·mol-1
下图为气相直接水合法乙烯的平衡转化率与温度、压强的关系(其中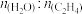 =1:1)
=1:1)
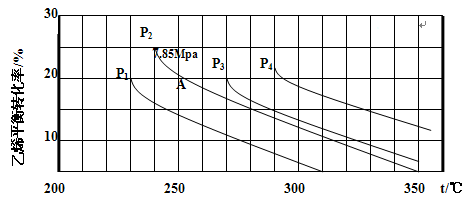
(4)图中压强( 、
、 、
、 、
、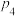 )由大到小顺序为
)由大到小顺序为________________ 。
(5)计算乙烯水合制乙醇反应在图中A点(P2=7.85Mpa,乙烯平衡转化率为20%)的平衡常数Kp=___________ (要求写出解题过程)。
本小题提示:用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,用淀粉溶液作指示剂,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①CuCl2溶液与KI反应的离子方程式为
②该试样中CuCl2·2H2O的质量百分数为
Ⅱ.乙醇是重要的有机化工原料,可由乙烯直接水合法生产。
已知:乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g) △H=—45.5KJ·mol-1
下图为气相直接水合法乙烯的平衡转化率与温度、压强的关系(其中
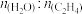 =1:1)
=1:1)
(4)图中压强(
 、
、 、
、 、
、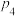 )由大到小顺序为
)由大到小顺序为(5)计算乙烯水合制乙醇反应在图中A点(P2=7.85Mpa,乙烯平衡转化率为20%)的平衡常数Kp=
本小题提示:用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】砷(As)是一种重要的非金属元素,广泛存在于自然界。含砷化合物常作为农药、除草剂和杀虫剂使用。
(1)向1L 0.2
 溶液中逐滴加入NaOH溶液,溶液中各种微粒的物质的量分数与溶液pH的关系如下图。
溶液中逐滴加入NaOH溶液,溶液中各种微粒的物质的量分数与溶液pH的关系如下图。___________ (填化学式)。
②当溶液pH由12调至13的过程中,主要发生反应的离子方程式为___________ 。
③下列说法中,正确的是___________ (填字母序号)。
A. 第一步电离的平衡常数
第一步电离的平衡常数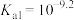
B.pH=12时,溶液中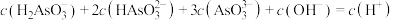
C. 溶液中,
溶液中,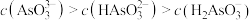
D.M点对应的溶液中:
(2)为减少工业废水中砷的排放,采用化学沉降法处理含砷废水:向废水中加入适量漂白粉、生石灰,将废水中的亚砷酸转化为 沉淀。
沉淀。
①请写出以上转化过程中的化学方程式___________ 。
②若要除去溶液中的 溶液中
溶液中 至少为
至少为___________  。
。
已知: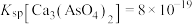 ,当残留在溶液中的离子浓度
,当残留在溶液中的离子浓度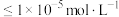 时,可认为沉淀完全。
时,可认为沉淀完全。
(1)向1L 0.2

 溶液中逐滴加入NaOH溶液,溶液中各种微粒的物质的量分数与溶液pH的关系如下图。
溶液中逐滴加入NaOH溶液,溶液中各种微粒的物质的量分数与溶液pH的关系如下图。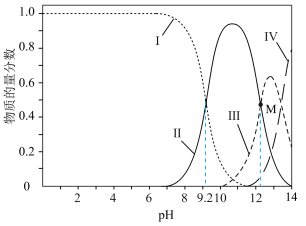
②当溶液pH由12调至13的过程中,主要发生反应的离子方程式为
③下列说法中,正确的是
A.
 第一步电离的平衡常数
第一步电离的平衡常数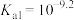
B.pH=12时,溶液中
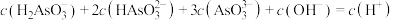
C.
 溶液中,
溶液中,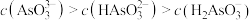
D.M点对应的溶液中:

(2)为减少工业废水中砷的排放,采用化学沉降法处理含砷废水:向废水中加入适量漂白粉、生石灰,将废水中的亚砷酸转化为
 沉淀。
沉淀。①请写出以上转化过程中的化学方程式
②若要除去溶液中的
 溶液中
溶液中 至少为
至少为 。
。已知:
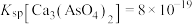 ,当残留在溶液中的离子浓度
,当残留在溶液中的离子浓度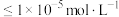 时,可认为沉淀完全。
时,可认为沉淀完全。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】(NH4)2SO4是一种优良的氮肥,能使枝叶生长旺盛,提高果实的品质和产量,(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气。
(1)请写出(NH4)2SO4溶液的水解方程式:___________ (用离子方程式表示);写出(NH4)2SO4溶液中的电荷守恒:___________ 。
(2)已知常温下(NH4)2SO3溶液呈弱碱性,请解释原因:___________ 。
(3)常温下,相同物质的量浓度的(NH4)2SO3溶液与(NH4)2SO4溶液中,c( )较大的是
)较大的是___________ 溶液。
(4)SO2用pH相同、体积相同的三种碱:①氨水;②NaOH;③Ba(OH)2来吸收,吸收SO2的量由大到小的顺序为___________ (用编号表示)。
(1)请写出(NH4)2SO4溶液的水解方程式:
(2)已知常温下(NH4)2SO3溶液呈弱碱性,请解释原因:
(3)常温下,相同物质的量浓度的(NH4)2SO3溶液与(NH4)2SO4溶液中,c(
 )较大的是
)较大的是(4)SO2用pH相同、体积相同的三种碱:①氨水;②NaOH;③Ba(OH)2来吸收,吸收SO2的量由大到小的顺序为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】化学上把外加少量酸、碱而 基本不变的溶液称为缓冲溶液。回答下列问题:
基本不变的溶液称为缓冲溶液。回答下列问题:
I.25℃时,浓度均为 的
的 和
和 的缓冲溶液的
的缓冲溶液的 。
。
(1)改变下列条件,能使 稀溶液中
稀溶液中 的值增大的是
的值增大的是___________ (填字母)。
a.加入 固体 b.升温 c.稀释 d.加入
固体 b.升温 c.稀释 d.加入 固体
固体
(2)该缓冲溶液中各离子浓度由大到小的顺序为___________ 。
Ⅱ.人体血液里主要通过碳酸氢盐缓冲体系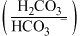 维持
维持 稳定。
稳定。
(3)已知正常人体血液在正常体温时, 的一级电离常数
的一级电离常数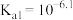 ,
, ,
, ,此时溶液的
,此时溶液的
___________ ,当过量的酸进入血液中时,血液缓冲体系中 的值将
的值将___________ (填“变大”、“变小”或“不变”)。
(4)某同学分别用 和
和 溶液进行如图所示的实验。充分反应后a试管中大量存在的离子是
溶液进行如图所示的实验。充分反应后a试管中大量存在的离子是___________ 。用离子方程式表示b试管中发生的反应:___________ 。
 基本不变的溶液称为缓冲溶液。回答下列问题:
基本不变的溶液称为缓冲溶液。回答下列问题:I.25℃时,浓度均为
 的
的 和
和 的缓冲溶液的
的缓冲溶液的 。
。(1)改变下列条件,能使
 稀溶液中
稀溶液中 的值增大的是
的值增大的是a.加入
 固体 b.升温 c.稀释 d.加入
固体 b.升温 c.稀释 d.加入 固体
固体(2)该缓冲溶液中各离子浓度由大到小的顺序为
Ⅱ.人体血液里主要通过碳酸氢盐缓冲体系
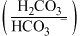 维持
维持 稳定。
稳定。(3)已知正常人体血液在正常体温时,
 的一级电离常数
的一级电离常数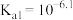 ,
, ,
, ,此时溶液的
,此时溶液的
 的值将
的值将(4)某同学分别用
 和
和 溶液进行如图所示的实验。充分反应后a试管中大量存在的离子是
溶液进行如图所示的实验。充分反应后a试管中大量存在的离子是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC—COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为____________________ 。
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现紫红色逐渐褪去,说明乙二酸具有_______ (填:“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:__ MnO +
+__ H2C2O4+__ H+=__ Mn2++__ CO2↑+__ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:上述装置中,D的作用是____________________ 。乙二酸分解的化学方程式为________________ 。
(4)该小组同学将2.52g草酸晶体(H2C2O4·2H2O)加入到100mL 0.2mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是___________________ 。
(5)Na2C2O4溶液中离子的浓度由大到小的顺序为:__________________ 。
(6)设计实验证明草酸的酸性比碳酸强:__________________ 。
乙二酸(HOOC—COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现紫红色逐渐褪去,说明乙二酸具有
 +
+(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:上述装置中,D的作用是
(4)该小组同学将2.52g草酸晶体(H2C2O4·2H2O)加入到100mL 0.2mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是
(5)Na2C2O4溶液中离子的浓度由大到小的顺序为:
(6)设计实验证明草酸的酸性比碳酸强:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.01mol·L-1的X、Y、Z、W溶液的pH。
(1)X、W的化学式分别为_______ 、_______ 。
(2)W在溶液中的电离方程式为_______ 。
(3)25℃时,Z溶液的pH>7的原因是_______ (用离子方程式表示)。
(4)将X、Y、Z各1mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为_______ 。
(5)Z溶液与W溶液混合加热,可产生一种无色无味的单质气体,该反应的化学方程式为____ 。
| 0.01mol·L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
(2)W在溶液中的电离方程式为
(3)25℃时,Z溶液的pH>7的原因是
(4)将X、Y、Z各1mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为
(5)Z溶液与W溶液混合加热,可产生一种无色无味的单质气体,该反应的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】自然界中化合态硫主要以FeS2(黄铁矿)、CuFeS2(黄铜矿)等矿物形式存在。用黄铜矿炼铜的总反应为: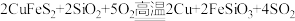 。
。
(1)该反应中_______ 元素被还原,如果在反应中生成1molCu,转移电子数为____ (用NA表示阿伏加德罗常数)。
(2)上述产生的SO2是一种大气污染物,不能直接排放到大气中,目前工业上常用的处理方法有多种。
I、用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4
①写出上述转化中生成NH4HSO3的化学方程式_______ (用一个方程式表示)若想提高该过程中SO2的除去速率,可采取的措施为_______ (填序号)
②25℃时0.lmol·L—1 (NH4)2SO4溶液的pH=5,其原因是_______ (用离子方程式表示),若水解常数用Kb表示,则该溶液中铵根离子的水解常数Kb约为______________ .
Ⅱ、“钠碱法”:用NaOH溶液作吸收剂吸收SO2
③当n(NaOH)∶n(SO2)=_______ 时,吸收SO2的成本最低,所得吸收液中各离子浓度大小关系是_______ ,向吸收液中加入NaOH可得到_______ 。
A. 增大氨水浓度
B. 升高反应温度
C. 使气体与氨水充分接触
D. 通入空气使HSO 转化为SO
转化为SO
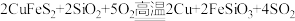 。
。(1)该反应中
(2)上述产生的SO2是一种大气污染物,不能直接排放到大气中,目前工业上常用的处理方法有多种。
I、用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4
①写出上述转化中生成NH4HSO3的化学方程式
②25℃时0.lmol·L—1 (NH4)2SO4溶液的pH=5,其原因是
Ⅱ、“钠碱法”:用NaOH溶液作吸收剂吸收SO2
③当n(NaOH)∶n(SO2)=
A. 增大氨水浓度
B. 升高反应温度
C. 使气体与氨水充分接触
D. 通入空气使HSO
 转化为SO
转化为SO
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】完成下列问题
(1)磷是重要的元素,能形成多种含氧酸和含氧酸盐。亚磷酸(H3PO3)的结构如图,亚磷酸可由PCl3水解而成,H3PO3溶液存在电离平衡:H3PO3 H++H2PO
H++H2PO ,H2PO
,H2PO
 H++HPO
H++HPO

回答下列问题:
①Na2HPO3属于___________ (填“正盐”或“酸式盐”)。
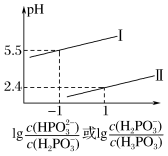
②常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示 的是曲线
的是曲线___________ (填“I”或“Ⅱ”),亚磷酸(H3PO3)的Ka2=___________ 。
(2)25℃时,部分弱碱、弱酸的电离平衡常数如下表:
①向Na2CO3溶液中加入少量的H3PO4溶液反应的离子方程式是___________ 。
②0.1mol/L的NH4NO2溶液中离子浓度大小关系是___________ 。
(3)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为___________ 。(100℃时:Kw=10-12)
(4)已知:Ksp(AgBr)=5.4×10−13,Ksp(AgCl)=1.8×10−10,向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =
=___________ 。
(5)已知在25℃时,Ksp[Mg(OH)2]=3.2×10−11.25℃时,向0.02 mol∙L−1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的pH最小是___________ (已知lg2=0.3)。
(1)磷是重要的元素,能形成多种含氧酸和含氧酸盐。亚磷酸(H3PO3)的结构如图,亚磷酸可由PCl3水解而成,H3PO3溶液存在电离平衡:H3PO3
 H++H2PO
H++H2PO ,H2PO
,H2PO
 H++HPO
H++HPO

回答下列问题:
①Na2HPO3属于
②常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示
 的是曲线
的是曲线
(2)25℃时,部分弱碱、弱酸的电离平衡常数如下表:
| 弱酸 | NH3·H2O | HNO2 | H2CO3 | H3PO4 |
| 电离平衡常数(25℃) | Kb=1.8×10-5 | Ka=5.0×10-4 | Ka1=4.0×10-7 Ka2=5.0×10-11 | Ka1=8.0×10-3 Ka2=6.0×10-8 Ka3=2.0×10-13 |
②0.1mol/L的NH4NO2溶液中离子浓度大小关系是
(3)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为
(4)已知:Ksp(AgBr)=5.4×10−13,Ksp(AgCl)=1.8×10−10,向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
 =
=(5)已知在25℃时,Ksp[Mg(OH)2]=3.2×10−11.25℃时,向0.02 mol∙L−1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的pH最小是
您最近一年使用:0次



