电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①0.1 mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______ c(HCO3 -)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液A.HCOONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________ (填编号)。
③已知25℃时,HCOOH( aq) +OH -( aq)=HCOO-(aq) +H2O(1) △H=-a kJ/mol
H+(aq) +OH-(aq) =H2O(1) △H=-b kJ/mol
甲酸电离的热化学方程式为______________ 。
④将少量CO2通入NaCN溶液,反应的离子方程式是____ 。
⑤室温下,—定浓度的HCOONa溶液pH =9,用离子方程式表示溶液呈碱性的原因是_____________ ,溶液中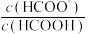 =
=___________ 。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。
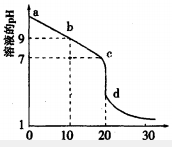
①d点所示的溶液中离子浓度由大到小的顺序依次为_______________ 。
②b点所示的溶液中c(NH3·H2O)-c(NH4+)=_____ (用溶液中的其它离子浓度表示)。
③pH =10的氨水与pH =4的NH4C1溶液中,由水电离出的c(H+)之比为____ 。
(3)已知Ksp(BaCO3) =2.6×l0-9,Ksp( BaSO4)=1.1×10-10.
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为____ mol/L。
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中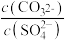 =
=___________ (保留三位有效数字)。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka = 1.77×10 -4 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①0.1 mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)
②常温下,pH相同的三种溶液A.HCOONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是
③已知25℃时,HCOOH( aq) +OH -( aq)=HCOO-(aq) +H2O(1) △H=-a kJ/mol
H+(aq) +OH-(aq) =H2O(1) △H=-b kJ/mol
甲酸电离的热化学方程式为
④将少量CO2通入NaCN溶液,反应的离子方程式是
⑤室温下,—定浓度的HCOONa溶液pH =9,用离子方程式表示溶液呈碱性的原因是
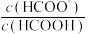 =
=(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。

①d点所示的溶液中离子浓度由大到小的顺序依次为
②b点所示的溶液中c(NH3·H2O)-c(NH4+)=
③pH =10的氨水与pH =4的NH4C1溶液中,由水电离出的c(H+)之比为
(3)已知Ksp(BaCO3) =2.6×l0-9,Ksp( BaSO4)=1.1×10-10.
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中
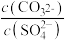 =
=
2019高二·全国·专题练习 查看更多[1]
(已下线)《2018-2019学年同步单元双基双测AB卷》第三单元 水溶液中的离子平衡单元测试B卷
更新时间:2018-10-21 01:34:47
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】完成下列填空
(1)通过甲烷制备 :
:
 。常温下,在2L的密闭容器中通入
。常温下,在2L的密闭容器中通入
 气体和
气体和
 气体发生反应,5min后达到平衡,测得
气体发生反应,5min后达到平衡,测得 气体的浓度为
气体的浓度为 。
。
①平衡时,该反应的平均反应速率
_______ 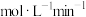 。
。
②在不改变反应混合物用量的前提下,为了提高 气体的转化率,可采取的措施是
气体的转化率,可采取的措施是_______ 。
(2)25℃时,将 的
的 溶液与
溶液与 的
的 溶液混合,若所得混合溶液
溶液混合,若所得混合溶液 ,则
,则 溶液与
溶液与 溶液的体积比为
溶液的体积比为_______ 。
(3)25℃时, 和
和 组成的混合溶液,若其
组成的混合溶液,若其 ,则该溶液中
,则该溶液中
_______  ;若
;若 ,则该溶液中
,则该溶液中
_______  。(填“>”、“<”、“=”)。
。(填“>”、“<”、“=”)。
(4)含有 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含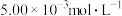 的
的 。为使废水能达标排放,做如下处理
。为使废水能达标排放,做如下处理 、
、 、
、 。若处理后的废水中残留的
。若处理后的废水中残留的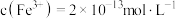 ,则残留的
,则残留的 的浓度为
的浓度为_______  (已知:
(已知: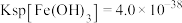 ,
,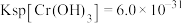 )。
)。
(1)通过甲烷制备
 :
:
 。常温下,在2L的密闭容器中通入
。常温下,在2L的密闭容器中通入
 气体和
气体和
 气体发生反应,5min后达到平衡,测得
气体发生反应,5min后达到平衡,测得 气体的浓度为
气体的浓度为 。
。①平衡时,该反应的平均反应速率

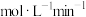 。
。②在不改变反应混合物用量的前提下,为了提高
 气体的转化率,可采取的措施是
气体的转化率,可采取的措施是(2)25℃时,将
 的
的 溶液与
溶液与 的
的 溶液混合,若所得混合溶液
溶液混合,若所得混合溶液 ,则
,则 溶液与
溶液与 溶液的体积比为
溶液的体积比为(3)25℃时,
 和
和 组成的混合溶液,若其
组成的混合溶液,若其 ,则该溶液中
,则该溶液中
 ;若
;若 ,则该溶液中
,则该溶液中
 。(填“>”、“<”、“=”)。
。(填“>”、“<”、“=”)。(4)含有
 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含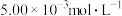 的
的 。为使废水能达标排放,做如下处理
。为使废水能达标排放,做如下处理 、
、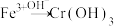 、
、 。若处理后的废水中残留的
。若处理后的废水中残留的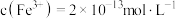 ,则残留的
,则残留的 的浓度为
的浓度为 (已知:
(已知: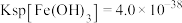 ,
,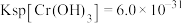 )。
)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】自然界是各类物质相互依存、各种变化相互制约的复杂平衡体系,水溶液中的离子平衡是其中一个重要方面。请根据所学知识,回答下列问题。
(1)某温度下, 的盐酸中水电离出的
的盐酸中水电离出的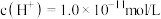 ,该温度下将
,该温度下将 的
的 溶液与
溶液与 的
的 溶液等体积混合,混合后溶液的
溶液等体积混合,混合后溶液的
_______ 。
(2)常温下将pH均为3,体积均为 的
的 和
和 溶液,分别加水稀释至体积V,pH随
溶液,分别加水稀释至体积V,pH随 的变化如图所示。
的变化如图所示。
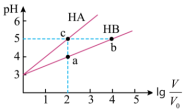
①a、b、c三点水的电离程度由大到小的顺序_______
②常温下,取上述pH均为3的 和
和 溶液各
溶液各 ,向其中分别加入足量的Zn粒,反应结束时
,向其中分别加入足量的Zn粒,反应结束时 中产生氢气的物质的量为
中产生氢气的物质的量为 ,HB溶液中产生氢气的物质的量为
,HB溶液中产生氢气的物质的量为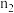 ,则
,则
_______ 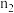 (用“>”、“=”、“<”填空)。
(用“>”、“=”、“<”填空)。
(3)以 溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_______ 。
a.利用阳极泥可回收Ag、Pt、Au等金属 b.粗铜接电源正极,发生氧化反应
c.溶液中 向阳极移动 d.电能全部转化为化学能
向阳极移动 d.电能全部转化为化学能
(4)人工肾脏可采用间接电化学方法除去代谢产物中的尿素 ,原理如图。
,原理如图。
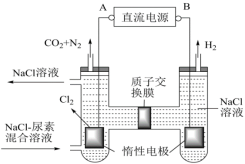
①电源的正极为_______ (填“A”或“B”)。
②电解结束后,阴极室溶液的pH与电解前相比将_______ (填“增大”、“减小”、“不变”);若两极共收集到气体 (标准状况),则除去的尿素为
(标准状况),则除去的尿素为_______ g(忽略气体的溶解)。
(1)某温度下,
 的盐酸中水电离出的
的盐酸中水电离出的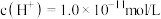 ,该温度下将
,该温度下将 的
的 溶液与
溶液与 的
的 溶液等体积混合,混合后溶液的
溶液等体积混合,混合后溶液的
(2)常温下将pH均为3,体积均为
 的
的 和
和 溶液,分别加水稀释至体积V,pH随
溶液,分别加水稀释至体积V,pH随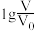 的变化如图所示。
的变化如图所示。
①a、b、c三点水的电离程度由大到小的顺序
②常温下,取上述pH均为3的
 和
和 溶液各
溶液各 ,向其中分别加入足量的Zn粒,反应结束时
,向其中分别加入足量的Zn粒,反应结束时 中产生氢气的物质的量为
中产生氢气的物质的量为 ,HB溶液中产生氢气的物质的量为
,HB溶液中产生氢气的物质的量为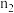 ,则
,则
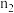 (用“>”、“=”、“<”填空)。
(用“>”、“=”、“<”填空)。(3)以
 溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是a.利用阳极泥可回收Ag、Pt、Au等金属 b.粗铜接电源正极,发生氧化反应
c.溶液中
 向阳极移动 d.电能全部转化为化学能
向阳极移动 d.电能全部转化为化学能(4)人工肾脏可采用间接电化学方法除去代谢产物中的尿素
 ,原理如图。
,原理如图。
①电源的正极为
②电解结束后,阴极室溶液的pH与电解前相比将
 (标准状况),则除去的尿素为
(标准状况),则除去的尿素为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
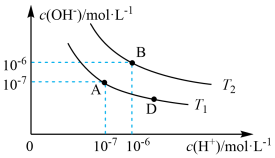
(1)A点水的离子积为1.0×10-14,B点水的离子积为_______ 。造成水的离子积变化的原因是_______ 。
(2)下列说法正确的是_______(填字母)。
(3)T1时,若向溶液中滴加NaOH,能否使体系处于A点位置?_______ 。

(1)A点水的离子积为1.0×10-14,B点水的离子积为
(2)下列说法正确的是_______(填字母)。
| A.图中A、B、D三点处Kw的大小关系:B>A>D |
| B.AB线上任意点的溶液均显中性,且Kw不变 |
| C.B点溶液的pH=6,显酸性 |
| D.图中温度T1>T2 |
您最近一年使用:0次
【推荐1】工业废气、汽车尾气中含有的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
(1)NO加速臭氧层被破坏,其反应过程如图所示:

已知:O3(g)+O(g)═2O2(g)△H=-143kJ/mol
反应1:O3(g)+NO(g)═NO2(g)+O2(g)△H1 =-200.2kJ/mol
反应2:热化学方程式为________
(2)用稀硝酸吸收NOx,得到HNO3和HNO2(弱酸)的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:_________ 。
(3)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度十倍),装置示意图如图所示,固体电解质可传导O2-。

①阴极的反应为________ ;
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)________ ;
(4)处理烟气中SO2也可采用碱液吸收法。已知25℃时,K(NH3•H2O)=1.8×10-5;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42-⇌CaSO4↓+2NH3•H2O K。
①写出用足量氨水吸收SO2的化学方程式______________ ;
②25℃时,2.0mol•L-1的氨水中,NH3•H2O的电离度
_______  ;
;
③计算第2步中反应的K=________ (列出计算式即可)。
(1)NO加速臭氧层被破坏,其反应过程如图所示:

已知:O3(g)+O(g)═2O2(g)△H=-143kJ/mol
反应1:O3(g)+NO(g)═NO2(g)+O2(g)△H1 =-200.2kJ/mol
反应2:热化学方程式为
(2)用稀硝酸吸收NOx,得到HNO3和HNO2(弱酸)的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:
(3)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度十倍),装置示意图如图所示,固体电解质可传导O2-。

①阴极的反应为
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)
(4)处理烟气中SO2也可采用碱液吸收法。已知25℃时,K(NH3•H2O)=1.8×10-5;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42-⇌CaSO4↓+2NH3•H2O K。
①写出用足量氨水吸收SO2的化学方程式
②25℃时,2.0mol•L-1的氨水中,NH3•H2O的电离度

 ;
;③计算第2步中反应的K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】回答下列问题:
(1)用H2还原CO2在一定条件下合成CH3OH(不考虑副反应)CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0。恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的平衡产率随温度的变化如图1所示,其中分子筛膜能选择性分离出H2O。
CH3OH(g)+H2O(g) △H<0。恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的平衡产率随温度的变化如图1所示,其中分子筛膜能选择性分离出H2O。
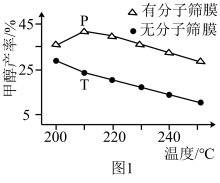
①甲醇平衡产率随温度升高而降低的原因为____ 。
②P点甲醇平衡产率高于T点的原因为____ 。
③根据如图,在此条件下采用该分子筛膜时的最佳反应温度为____ ℃。
(2)已知部分弱酸的电离平衡常数如表,根据表中数据回答下列问题。
①体积相同、pH相同的三种酸溶液a.HCOOHb.HCNc.HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的顺序是____ (用序号表示)。
②25℃知某浓度的HCOONa溶液pH=9,原因是____ (用离子方程式表示),该溶液中由水电离出OH-的浓度为____ 。
③浓度相同的四种溶液HCOONa、NaCN、NaHCO3、Na2CO3,其碱性由强到弱的顺序是____ 。
(1)用H2还原CO2在一定条件下合成CH3OH(不考虑副反应)CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H<0。恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的平衡产率随温度的变化如图1所示,其中分子筛膜能选择性分离出H2O。
CH3OH(g)+H2O(g) △H<0。恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的平衡产率随温度的变化如图1所示,其中分子筛膜能选择性分离出H2O。
①甲醇平衡产率随温度升高而降低的原因为
②P点甲醇平衡产率高于T点的原因为
③根据如图,在此条件下采用该分子筛膜时的最佳反应温度为
(2)已知部分弱酸的电离平衡常数如表,根据表中数据回答下列问题。
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
②25℃知某浓度的HCOONa溶液pH=9,原因是
③浓度相同的四种溶液HCOONa、NaCN、NaHCO3、Na2CO3,其碱性由强到弱的顺序是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】回答下列问题:
(1)已知:25℃时,CH3COOH和NH3·H2O的电离常数相等。该温度下0.1 mol/L醋酸溶液测得其pH=3。
①25℃时,0.1 mol/L氨水溶液的pH=_______ 。用pH试纸测定该氨水pH的操作方法为_______ 。
②氨水(NH3·H2O溶液 电离平衡常数表达式Kb
电离平衡常数表达式Kb_______ ,25℃时,氨水电离平衡常数约为_______ 。
(2)已知氢氟酸、醋酸、次氯酸(HClO)、碳酸在室温下的电离常数分别为:
根据上述数据,回答下列问题:
①以上酸中酸性最强的是_______ ,同浓度的CH3COO-、HCO 、CO
、CO 、ClO-结合H+的能力由强到弱的顺序为
、ClO-结合H+的能力由强到弱的顺序为_______ 。
②写出以下反应的离子方程式:足量的氢氟酸与碳酸钠溶液混合:_______ ;少量的CO2通入NaClO溶液中:_______ 。
(1)已知:25℃时,CH3COOH和NH3·H2O的电离常数相等。该温度下0.1 mol/L醋酸溶液测得其pH=3。
①25℃时,0.1 mol/L氨水溶液的pH=
②氨水(NH3·H2O溶液
 电离平衡常数表达式Kb
电离平衡常数表达式Kb(2)已知氢氟酸、醋酸、次氯酸(HClO)、碳酸在室温下的电离常数分别为:
| HF | Ka=6.8×10-4 mol•L-1 |
| CH3COOH | Ka=1.7×10-5 mol•L-1 |
| HClO | Ka=2.9×10-8 mol•L-1 |
| H2CO3 | Ka1=4.4×10-7 mol•L-1 Ka2=4.7×10-11 mol•L-1 |
根据上述数据,回答下列问题:
①以上酸中酸性最强的是
 、CO
、CO 、ClO-结合H+的能力由强到弱的顺序为
、ClO-结合H+的能力由强到弱的顺序为②写出以下反应的离子方程式:足量的氢氟酸与碳酸钠溶液混合:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】已知:常温下各物质的电离平衡常数见下表,按要求填空。
(1)常温下,实验测得醋酸铵溶液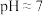 ,溶液呈中性,请用具体数据解释醋酸铵溶液显中性的原因
,溶液呈中性,请用具体数据解释醋酸铵溶液显中性的原因_______ 。此溶液中水电离的
_______ 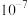 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(2)①25℃时,等浓度的a. 溶液b.
溶液b. 溶液c.
溶液c. 溶液,三种溶液的
溶液,三种溶液的 由大到小的顺序为
由大到小的顺序为_______ (填溶液前字母)
② 相同的
相同的 溶液与
溶液与 溶液相比,
溶液相比,
_______ 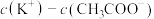 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
③写出将少量 通入
通入 溶液中的离子方程式
溶液中的离子方程式_______ 。
(3)室温下,若将 盐酸滴入
盐酸滴入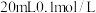 氨水中,溶液
氨水中,溶液 随加入盐酸体积的变化曲线如图所示。
随加入盐酸体积的变化曲线如图所示。
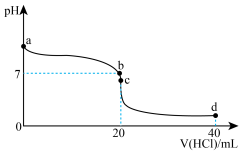
①b点所示溶液中的溶质是_______ 。
②若用 盐酸滴定未知浓度的氨水,混合溶液的
盐酸滴定未知浓度的氨水,混合溶液的 变化图。由此得出的结论错误的是
变化图。由此得出的结论错误的是_______
A.a点溶液的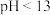
B.b点对应的溶液中:
C.d点对应的溶液中:
D.若用盐酸溶液滴定氨水溶液,可选用酚酞作指示剂
| 化学式 |  |  |  |  |
| 电离平衡常数 | 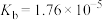 | 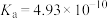 | 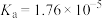 | 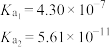 |
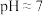 ,溶液呈中性,请用具体数据解释醋酸铵溶液显中性的原因
,溶液呈中性,请用具体数据解释醋酸铵溶液显中性的原因
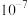 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(2)①25℃时,等浓度的a.
 溶液b.
溶液b. 溶液c.
溶液c. 溶液,三种溶液的
溶液,三种溶液的 由大到小的顺序为
由大到小的顺序为②
 相同的
相同的 溶液与
溶液与 溶液相比,
溶液相比,
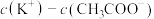 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)③写出将少量
 通入
通入 溶液中的离子方程式
溶液中的离子方程式(3)室温下,若将
 盐酸滴入
盐酸滴入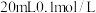 氨水中,溶液
氨水中,溶液 随加入盐酸体积的变化曲线如图所示。
随加入盐酸体积的变化曲线如图所示。
①b点所示溶液中的溶质是
②若用
 盐酸滴定未知浓度的氨水,混合溶液的
盐酸滴定未知浓度的氨水,混合溶液的 变化图。由此得出的结论错误的是
变化图。由此得出的结论错误的是A.a点溶液的
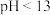
B.b点对应的溶液中:

C.d点对应的溶液中:

D.若用盐酸溶液滴定氨水溶液,可选用酚酞作指示剂
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】运用化学反应原理,研究元素化合物的反应具有重要意义。
(1)已知 (次磷酸)为一元弱酸,则
(次磷酸)为一元弱酸,则 与足量NaOH溶液充分反应的化学反应方程式为
与足量NaOH溶液充分反应的化学反应方程式为______ 。 易被氧化为
易被氧化为 ,
, , 溶液呈
, 溶液呈______ 性。(已知常温下 的电离常数为
的电离常数为 ,
,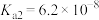 ,
,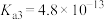 )
)
(2) 溶液呈碱性的原因是
溶液呈碱性的原因是______ (用离子方程式表示)。
(3)实验室在配制 溶液时,加蒸馏水前常将
溶液时,加蒸馏水前常将 固体先溶于适量盐酸中,其主要目的是
固体先溶于适量盐酸中,其主要目的是______
(4)请写出0.1 NaHS溶液中的电荷守恒关系式:
NaHS溶液中的电荷守恒关系式:______
(5)已知几种离子开始沉淀时溶液的pH如下表所示:
当向含有相同浓度的 、
、 、
、 的溶液中滴加氢氧化钠溶液时,
的溶液中滴加氢氧化钠溶液时,______ (填离子符号)先沉淀;
______ (填“>”“=”或“<”)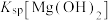 。
。
(1)已知
 (次磷酸)为一元弱酸,则
(次磷酸)为一元弱酸,则 与足量NaOH溶液充分反应的化学反应方程式为
与足量NaOH溶液充分反应的化学反应方程式为 易被氧化为
易被氧化为 ,
, , 溶液呈
, 溶液呈 的电离常数为
的电离常数为 ,
,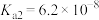 ,
,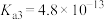 )
)(2)
 溶液呈碱性的原因是
溶液呈碱性的原因是(3)实验室在配制
 溶液时,加蒸馏水前常将
溶液时,加蒸馏水前常将 固体先溶于适量盐酸中,其主要目的是
固体先溶于适量盐酸中,其主要目的是(4)请写出0.1
 NaHS溶液中的电荷守恒关系式:
NaHS溶液中的电荷守恒关系式:(5)已知几种离子开始沉淀时溶液的pH如下表所示:
| 离子 |  |  |  |
| pH | 7.6 | 5.2 | 10.4 |
 、
、 、
、 的溶液中滴加氢氧化钠溶液时,
的溶液中滴加氢氧化钠溶液时,
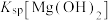 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
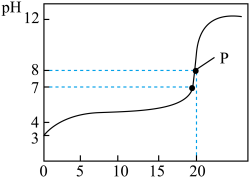
【推荐3】常温下,用0.100 0 mol·L−1的 NaOH溶液滴定20.00 mL 0.1000 mol·L−1的某酸HA溶液所得滴定曲线如图所示。
回答下列问题:
(1)该酸为_______ 酸(填“强”或者“弱”),你的判断理由是_________________ 。
(2)点P时溶液中的 c(HA)=________ mol·L−1。
(3)①该中和滴定应选择________ 做指示剂,滴定终点时的现象是________________________ 。
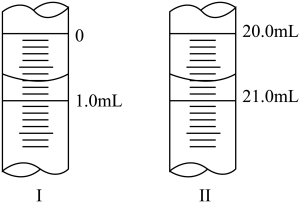
②滴定起始和终点的液面位置如图2所示,则消耗NaOH溶液的体积为_____ mL。
③下列操作使滴定结果偏高的是________ 。
a.滴定前,碱式滴定管未用NaOH溶液润洗
b.锥形瓶的待测液中加少量水稀释
c.碱式滴定管滴定前有气泡,滴定后无气泡
d.读数时,滴定前仰视,滴定后俯视


回答下列问题:
(1)该酸为
(2)点P时溶液中的 c(HA)=
(3)①该中和滴定应选择
| 指示剂变色范围(pH) | 甲基橙(3.1~4.4) | 石蕊(5~8) | 酚酞(8.2~10.0) | ||||||
| 颜色 | <3.1 | 3.1~4.4 | >4.4 | <5 | 5~8 | >8 | <8.2 | 8.2~10.0 | >10.0 |
| 红 | 橙 | 黄 | 红 | 紫 | 蓝 | 无色 | 粉红 | 红 | |
③下列操作使滴定结果偏高的是
a.滴定前,碱式滴定管未用NaOH溶液润洗
b.锥形瓶的待测液中加少量水稀释
c.碱式滴定管滴定前有气泡,滴定后无气泡
d.读数时,滴定前仰视,滴定后俯视
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】以含锌废渣(主要成分为 ,另含少量
,另含少量 、
、 、
、 等)为原料可生产草酸锌晶体(
等)为原料可生产草酸锌晶体(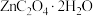 ,微溶于水),其工艺流程为:
,微溶于水),其工艺流程为:

常温时,部分金属离子开始沉淀及沉淀完全的 如下表所示(浓度
如下表所示(浓度 时可认为金属离子沉淀完全):
时可认为金属离子沉淀完全):
(1)酸浸时应适当增大盐酸的浓度,原因是_______ 和_______ 。
(2)氧化时反应的离子方程式为_______ 。
(3)为不引入杂质,物质X可以是_______ (填化学式)。
(4)“调 ”时应控制溶液的
”时应控制溶液的 范围是
范围是_______ 。
(5)将过滤II所得滤液与草酸钠 溶液按一定方式混合,可析出草酸锌晶体。
溶液按一定方式混合,可析出草酸锌晶体。
①滤液与草酸钠溶液混合方式不正确,会生成杂质沉淀。则滤液与草酸钠溶液的正确混合方式为_______ 。
②若将草酸钠换成草酸铵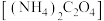 溶液,则不同的混合方式均不会生成杂质沉淀,原因是
溶液,则不同的混合方式均不会生成杂质沉淀,原因是_______ 。
(6)根据表格数据可知常温下,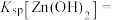
_______ 。
 ,另含少量
,另含少量 、
、 、
、 等)为原料可生产草酸锌晶体(
等)为原料可生产草酸锌晶体(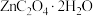 ,微溶于水),其工艺流程为:
,微溶于水),其工艺流程为:
常温时,部分金属离子开始沉淀及沉淀完全的
 如下表所示(浓度
如下表所示(浓度 时可认为金属离子沉淀完全):
时可认为金属离子沉淀完全):| 沉淀 | 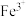 |  |  |  |
开始沉淀时的 |  | 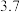 | 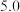 | 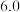 |
恰好完全沉淀时的 |  |  | 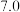 |  |
(1)酸浸时应适当增大盐酸的浓度,原因是
(2)氧化时反应的离子方程式为
(3)为不引入杂质,物质X可以是
(4)“调
 ”时应控制溶液的
”时应控制溶液的 范围是
范围是(5)将过滤II所得滤液与草酸钠
 溶液按一定方式混合,可析出草酸锌晶体。
溶液按一定方式混合,可析出草酸锌晶体。①滤液与草酸钠溶液混合方式不正确,会生成杂质沉淀。则滤液与草酸钠溶液的正确混合方式为
②若将草酸钠换成草酸铵
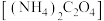 溶液,则不同的混合方式均不会生成杂质沉淀,原因是
溶液,则不同的混合方式均不会生成杂质沉淀,原因是(6)根据表格数据可知常温下,
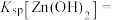
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
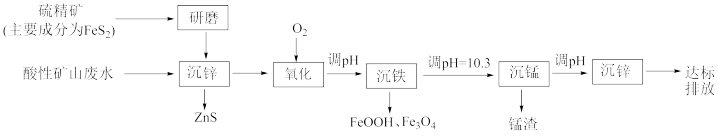
【推荐2】酸性矿山废水中锌、铁、锰元素的分离及回收流程如图:
已知:①酸性矿山废水成分如表:
② ;
;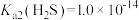
③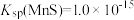 ;
;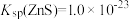
(1)“研磨”的目的是_______ 。
(2)“沉锌”过程中, 转化为
转化为 和
和 ,所得
,所得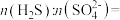
_______ 。
(3)“沉锌”过程中, 完全沉淀时,测得溶液
完全沉淀时,测得溶液 为4,则
为4,则
_______  ;计算判断此时是否生成
;计算判断此时是否生成 沉淀
沉淀_______ (忽略体积变化)。
(4)“氧化”过程发生反应的离子方程式为_______ 。
(5)“沉铁”过程中,加入 调节
调节 ,废水
,废水 对铁、锰元素去除率的影响如图所示,为提高铁、锰元素的分离效果,废水
对铁、锰元素去除率的影响如图所示,为提高铁、锰元素的分离效果,废水 控制
控制_______ 。
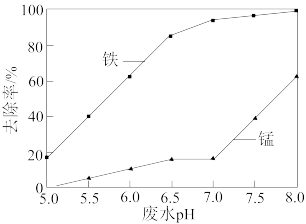
(6)“沉锰”后,溶液中c(Mn2+)=2.0×10-5mol L-1,锰元素去除率为
L-1,锰元素去除率为_______ %(保留1位小数,忽略体积变化)。

已知:①酸性矿山废水成分如表:
 |  | ||
 |  |  | |
| 1.0 |  |  | 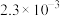 |
 ;
;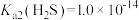
③
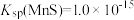 ;
;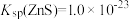
(1)“研磨”的目的是
(2)“沉锌”过程中,
 转化为
转化为 和
和 ,所得
,所得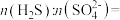
(3)“沉锌”过程中,
 完全沉淀时,测得溶液
完全沉淀时,测得溶液 为4,则
为4,则
 ;计算判断此时是否生成
;计算判断此时是否生成 沉淀
沉淀(4)“氧化”过程发生反应的离子方程式为
(5)“沉铁”过程中,加入
 调节
调节 ,废水
,废水 对铁、锰元素去除率的影响如图所示,为提高铁、锰元素的分离效果,废水
对铁、锰元素去除率的影响如图所示,为提高铁、锰元素的分离效果,废水 控制
控制
(6)“沉锰”后,溶液中c(Mn2+)=2.0×10-5mol
 L-1,锰元素去除率为
L-1,锰元素去除率为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
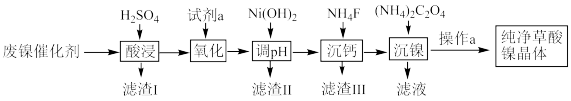
【推荐3】已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:_______________________________ 。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:_____________ 。
(3)“调pH”时pH的调控范围为__________________ 。
(4)写出“沉镍”时发生反应的离子方程式:________________________________ ,证明Ni2+已经沉淀完全的实验步骤及现象是______________________________ ,当Ca2+沉淀完全时,溶液中c(F-)>____________ mol·L-1(写出计算式即可)。

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:
(3)“调pH”时pH的调控范围为
(4)写出“沉镍”时发生反应的离子方程式:
您最近一年使用:0次



