1 . 用下列装置(夹持装置略)进行实验,能达到实验目的的是
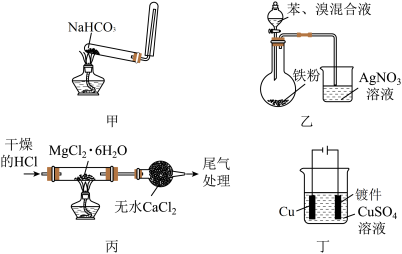
A.用甲装置制备并收集 |
B.用乙装置制备溴苯并验证有 产生 产生 |
C.用丙装置制备无水 |
| D.用丁装置为镀件镀铜 |
您最近一年使用:0次
2 . 根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计或结论正确的是
| 实验目的 | 方案设计 | 现象 | 结论 | |
| A | 检验是否含碳碳双键 | 向装有溴水的试管中加入样品,振荡 | 溴水褪色 | 含有碳碳双键 |
| B | 探究温度对水解程度的影响 | 检测等体积、等物质的量浓度的 溶液在不同温度下的pH 溶液在不同温度下的pH | 温度高的溶液pH值更小 | 温度升高促进水解平衡正移 |
| C | 检验某固体试样中是否含有 | 取固体试样加水溶解,向其中滴加少量 溶液,加热 溶液,加热 | 没有产生使湿润红色石蕊试纸变蓝的气体 | 不存在 |
| D | 比较 | 相同条件下,分别测定两种有机物与氢气发生加成反应生成 环己烷时的温度变化。 环己烷时的温度变化。 |
|
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
3 . 根据实验目的,下列实验设计、现象及结论都正确的是
| 选项 | 实验目的 | 实验设计及现象 | 结论 |
| A | 证明Na2CO3溶液中存在水解平衡 | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | Na2CO3溶液中存在水解平衡 |
| B | 判断淀粉是否水解 | 向淀粉溶液中加入少量稀硫酸,加热,再加入银氨溶液,加热后未出现银镜 | 淀粉未水解 |
| C | 比较B和C的非金属性强弱 | 用pH计测定 溶液的pH,H2CO3溶液的pH更小 溶液的pH,H2CO3溶液的pH更小 | 非金属性: |
| D | 判断Fe3+与 的反应是否可逆 的反应是否可逆 | 向 溶液中滴加KSCN溶液,再加入少量 溶液中滴加KSCN溶液,再加入少量 固体,溶液先变成血红色后无明显变化 固体,溶液先变成血红色后无明显变化 | Fe3+与 的反应不可逆 的反应不可逆 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 下列实验方案设计、现象和结论都正确的是
| 实验目的 | 方案设计 | 现象和结论 | |
| A | 探究浓度对平衡的影响 | 向平衡体系FeCl3+ 3KSCN Fe (SCN)3+ 3KCl中加入适量KC1固体 Fe (SCN)3+ 3KCl中加入适量KC1固体 | 若溶液的颜色变浅,说明:生成物浓度增加,平衡逆向移动 |
| B | 探究盐类水解程度 | 常温下, 用pH计测得0. lmol/L 弱酸盐:Na2A、Na2B溶液pH值为a、b | 若a>b,则水解程度A2-<B2- |
| C | 比较Ksp(AgCl)和Ksp(AgI)的大小 | 取2mL 0.1mol·L-1AgNO3溶液于试管中,加lmL 0.1 mol·L-1NaCl溶液,待不再有白色沉淀产生后加入1mL 0.1 mol·L-1KI 溶液 | 若产生黄色沉淀,说明:K sp(AgCl)> Ksp(AgI) |
| D | 比较CH3COOH的Ka 和H2CO3的Ka1 | 向盛有2mL1mol/L醋酸的试管中滴加1mol/L的Na2CO3溶液 | 若有气泡产生,则CH3COOH的Ka大于H2CO3的Ka1 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-25更新
|
587次组卷
|
3卷引用:浙江省杭州市长河高级中学2022-2023学年高二上学期期中考试化学试题
23-24高二上·浙江·期末
5 . 工业上主要以确镁矿为原料制备础砂,其废渣硼镁泥的主要成分为MgCO3,还含有少量CaCO3、FeO、Fe2O3、 MnO、SiO2等杂质,经以下流程可制取水合硫酸镁和水合硫酸钙晶体,请回答:
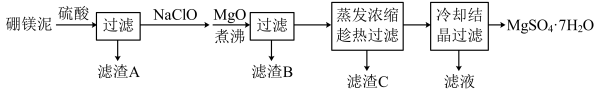
(1)滤渣B中的一种成分为MnO2,则生成MnO2的离子方程式为____________ 。
(2)流程中加入MgO并加热的目的分别是___________ 。
(3)向滤渣C(CaSO4·H2O)加入纯碱溶液,可使其转化为易溶于酸的CaCO3,则在反应后的上层清液中,c( ):c(
):c( )的值为
)的值为_________ [已知:Ksp(CaCO3)=4×10-9,Ksp(CaSO4)=5×10-5]
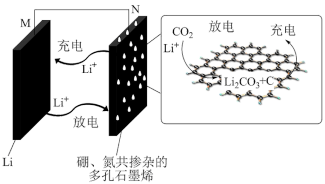
(4)研究人员开发了一种新型的硼、氮共掺杂的多孔石墨烯材料作为正极催化剂的锂-二氧化碳二次电池,实现子碳酸锂在电池中的高度可逆分解,其装置示意图如图所示。根据图示,写出放电时正极的电极反应式为______________ 。

(1)滤渣B中的一种成分为MnO2,则生成MnO2的离子方程式为
(2)流程中加入MgO并加热的目的分别是
(3)向滤渣C(CaSO4·H2O)加入纯碱溶液,可使其转化为易溶于酸的CaCO3,则在反应后的上层清液中,c(
 ):c(
):c( )的值为
)的值为(4)研究人员开发了一种新型的硼、氮共掺杂的多孔石墨烯材料作为正极催化剂的锂-二氧化碳二次电池,实现子碳酸锂在电池中的高度可逆分解,其装置示意图如图所示。根据图示,写出放电时正极的电极反应式为

您最近一年使用:0次
解题方法
6 . 目前生产 常用方法是将金属
常用方法是将金属 与干燥的氯气在300℃下反应:
与干燥的氯气在300℃下反应: 。已知
。已知 为无色液体,因溶有
为无色液体,因溶有 而略显黄色,熔点
而略显黄色,熔点 ℃,沸点为114℃,遇水极易水解而发烟。用如图装置进行制备。请回答:
℃,沸点为114℃,遇水极易水解而发烟。用如图装置进行制备。请回答:
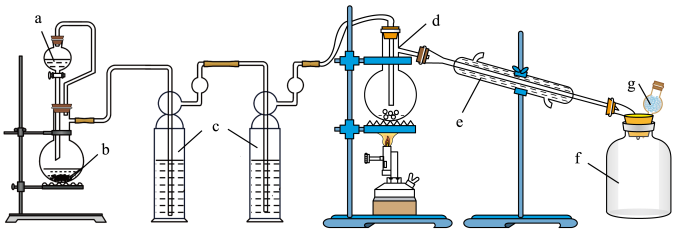
(1)连接装置 与装置
与装置 的导管作用是
的导管作用是_______ ,装置 加热的目的是
加热的目的是_______ 。
(2)设计检查该装置气密性的方法_______ (可适当增加装置)。
(3)下列有关实验的说法不正确的是_______(选填序号)。
(4)请根据题目要求,给下列实验操作排序:连接装置→_______ →将产品转至干燥器中保存。
①在装置 、装置
、装置 中加入足量制备
中加入足量制备 的反应物,装置
的反应物,装置 中放入
中放入 丝;
丝;
②检查装置气密性;
③打开分液漏斗活塞;
④点燃酒精喷灯;
⑤打开冷凝管的冷却水。
(5)利用 的水解制备
的水解制备 ,为促进
,为促进 完全水解,可采取的措施有
完全水解,可采取的措施有_______ 、加少量氨水。
 常用方法是将金属
常用方法是将金属 与干燥的氯气在300℃下反应:
与干燥的氯气在300℃下反应: 。已知
。已知 为无色液体,因溶有
为无色液体,因溶有 而略显黄色,熔点
而略显黄色,熔点 ℃,沸点为114℃,遇水极易水解而发烟。用如图装置进行制备。请回答:
℃,沸点为114℃,遇水极易水解而发烟。用如图装置进行制备。请回答:
(1)连接装置
 与装置
与装置 的导管作用是
的导管作用是 加热的目的是
加热的目的是(2)设计检查该装置气密性的方法
(3)下列有关实验的说法不正确的是_______(选填序号)。
A.装置 中的固体可以是 中的固体可以是 |
B.冷凝管的水流方向是下进上出,充分冷凝,以防 逸出 逸出 |
C.干燥管 的作用是吸收尾气,可改用盛有氢氧化钠溶液的洗气瓶 的作用是吸收尾气,可改用盛有氢氧化钠溶液的洗气瓶 |
D.通过减压蒸馏可除去 中溶有的 中溶有的 |
①在装置
 、装置
、装置 中加入足量制备
中加入足量制备 的反应物,装置
的反应物,装置 中放入
中放入 丝;
丝;②检查装置气密性;
③打开分液漏斗活塞;
④点燃酒精喷灯;
⑤打开冷凝管的冷却水。
(5)利用
 的水解制备
的水解制备 ,为促进
,为促进 完全水解,可采取的措施有
完全水解,可采取的措施有
您最近一年使用:0次
19-20高二·浙江·期中
7 . I.请回答下列问题:
(1)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图。1 mol 硼酸(H3BO3)晶体中含有___ mol 氢键。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:__________________ 。

(2)比较酸性的相对强弱:H2SO4__ HClO4 (填“>”“=”或“<”),已知能发生反应:H2SO4(浓)+NaClO4 HClO4+NaHSO4,说明该反应能发生的理由
HClO4+NaHSO4,说明该反应能发生的理由_______________ 。
Ⅱ.氮化铝(AlN)是一种性能优异的新型材料,在许多领域有广泛应用,前景广阔。某化学小组模拟工业制氮化铝原理欲在实验室制备氮化铝。查阅资料:①实验室用饱和NaNO2溶液与NH4Cl溶液共热制N2:NaNO2+NH4Cl NaCl+N2↑+2H2O;②工业制氮化铝:Al2O3+3C+N2
NaCl+N2↑+2H2O;②工业制氮化铝:Al2O3+3C+N2 2AlN+3CO,氮化铝在高温下能水解。
2AlN+3CO,氮化铝在高温下能水解。
(1)氮化铝的制备

①实验中使用的装置如上图所示,请按照氮气流方向将各仪器接口连接:c→_____________ 。 (根据实验需要,上述装置可使用多次)
②D装置内氯化钯溶液的作用可能是_________________ 。
(2) AlN粉末会缓慢发生水解反应,粒径为100 nm的AlN粉末水解时溶液pH的变化如下图所示。

①AlN粉末水解的化学方程式是________________________ 。
②相同条件下,请在图中画出粒径为40 nm的AlN粉末水解的变化曲线__________ 。
(1)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图。1 mol 硼酸(H3BO3)晶体中含有

(2)比较酸性的相对强弱:H2SO4
 HClO4+NaHSO4,说明该反应能发生的理由
HClO4+NaHSO4,说明该反应能发生的理由Ⅱ.氮化铝(AlN)是一种性能优异的新型材料,在许多领域有广泛应用,前景广阔。某化学小组模拟工业制氮化铝原理欲在实验室制备氮化铝。查阅资料:①实验室用饱和NaNO2溶液与NH4Cl溶液共热制N2:NaNO2+NH4Cl
 NaCl+N2↑+2H2O;②工业制氮化铝:Al2O3+3C+N2
NaCl+N2↑+2H2O;②工业制氮化铝:Al2O3+3C+N2 2AlN+3CO,氮化铝在高温下能水解。
2AlN+3CO,氮化铝在高温下能水解。(1)氮化铝的制备

①实验中使用的装置如上图所示,请按照氮气流方向将各仪器接口连接:c→
②D装置内氯化钯溶液的作用可能是
(2) AlN粉末会缓慢发生水解反应,粒径为100 nm的AlN粉末水解时溶液pH的变化如下图所示。

①AlN粉末水解的化学方程式是
②相同条件下,请在图中画出粒径为40 nm的AlN粉末水解的变化曲线
您最近一年使用:0次
2020-12-18更新
|
524次组卷
|
3卷引用:【浙江新东方】105
8 . 氯化亚铜(CuCl)是一种重要的化工产品。它难溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在水溶液中存在平衡:CuCl(白色)+2Cl﹣⇌[CuCl3]2﹣(无色溶液)。在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4﹣nCln],n随着环境酸度的改变而改变。某研究小组设计如下两种方案制备氯化亚铜。
方案一:铜粉还原CuSO4溶液
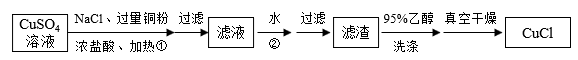
请回答:
(1)步骤①中发生反应的离子方程式为_______ 。
(2)步骤②中,加入大量水的作用是_______ 。
(3)如图流程中用95%乙醇洗涤和真空干燥是为了防止_______ 。
(4)随着pH减小,Cu2(OH)4﹣nCln中铜的质量分数_______ 。
A增大B不变C减小D不能确定
方案二:在氯化氢气流中加热CuCl2•2H2O晶体制备,其流程和实验装置(夹持仪器略)如图:
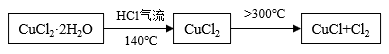
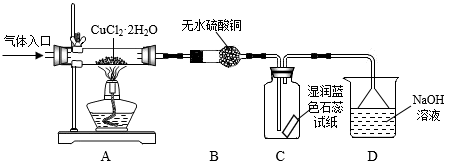
请回答:
(5)实验操作的先后顺序是a→_______ →_______ →_______ →e(填操作的编号)
a检查装置的气密性后加入药品b点燃酒精灯,加热
c在“气体入口”处通入干燥HCl d熄灭酒精灯,冷却
e停止通入HCl,然后通入N2
(6)在实验过程中,观察到B中无水硫酸铜由白色变为蓝色,C中试纸的颜色变化是_______ 。
(7)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2杂质,请分析产生CuCl2杂质的原因_______ 。
方案一:铜粉还原CuSO4溶液

请回答:
(1)步骤①中发生反应的离子方程式为
(2)步骤②中,加入大量水的作用是
(3)如图流程中用95%乙醇洗涤和真空干燥是为了防止
(4)随着pH减小,Cu2(OH)4﹣nCln中铜的质量分数
A增大B不变C减小D不能确定
方案二:在氯化氢气流中加热CuCl2•2H2O晶体制备,其流程和实验装置(夹持仪器略)如图:


请回答:
(5)实验操作的先后顺序是a→
a检查装置的气密性后加入药品b点燃酒精灯,加热
c在“气体入口”处通入干燥HCl d熄灭酒精灯,冷却
e停止通入HCl,然后通入N2
(6)在实验过程中,观察到B中无水硫酸铜由白色变为蓝色,C中试纸的颜色变化是
(7)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2杂质,请分析产生CuCl2杂质的原因
您最近一年使用:0次
9 . 某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。

已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。
请回答:
(1)下列操作或描述正确的是__________ 。
A.步骤②,H2C2O4稍过量主要是为了抑制Fe2+水解
B.步骤③,采用热水洗涤可提高除杂效果
C.步骤③,母液中的溶质主要是(NH4)2SO4 和H2C2O4
D.步骤③,如果在常压下快速干燥,温度可选择略高于100℃
(2)如图装置,经过一系列操作完成步骤③中的抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):

开抽气泵→a→b→d→_________ →c→关抽气泵
a.转移固液混合物; b.关活塞A; c.开活塞A; d.确认抽干; e.加洗涤剂洗涤。
(3)称取一定量的FeC2O4·2H2O试样,用硫酸溶解,采用KMnO4滴定法测定,折算结果如下:
由表中数据推测试样中最主要的杂质是___________
(4)实现步骤④必须用到的两种仪器是_________ (供选仪器:a.烧杯;b.坩埚;c.蒸馏烧瓶;d.高温炉;e.表面皿;f.锥形瓶);该步骤的化学方程式是______________________ 。
(5)为实现步骤⑤,不宜用碳粉还原Fe2O3,理由是________________ 。

已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。
请回答:
(1)下列操作或描述正确的是
A.步骤②,H2C2O4稍过量主要是为了抑制Fe2+水解
B.步骤③,采用热水洗涤可提高除杂效果
C.步骤③,母液中的溶质主要是(NH4)2SO4 和H2C2O4
D.步骤③,如果在常压下快速干燥,温度可选择略高于100℃
(2)如图装置,经过一系列操作完成步骤③中的抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):

开抽气泵→a→b→d→
a.转移固液混合物; b.关活塞A; c.开活塞A; d.确认抽干; e.加洗涤剂洗涤。
(3)称取一定量的FeC2O4·2H2O试样,用硫酸溶解,采用KMnO4滴定法测定,折算结果如下:
| n (Fe2+)/mol | n (C2O42-)/mol | 试样中FeC2O4·2H2O的质量分数 |
| 9.80×10-4 | 9.80×10-4 | 0.980 |
由表中数据推测试样中最主要的杂质是
(4)实现步骤④必须用到的两种仪器是
(5)为实现步骤⑤,不宜用碳粉还原Fe2O3,理由是
您最近一年使用:0次
2018-11-09更新
|
2087次组卷
|
3卷引用:浙江省普通高校招生选考科目2018年4月考试化学试题
浙江省普通高校招生选考科目2018年4月考试化学试题(已下线)专题21.化学工艺流程分析-十年(2012-2021)高考化学真题分项汇编(浙江专用)山西省实验中学2019届高三上学期第四次月考化学试题
解题方法
10 . 三草酸合铁(Ⅲ)酸钾晶体(K3[Fe(C2O4)3]•3H2O),常作为有机反应的催化剂,溶于水,难溶于乙醇。实验室可用摩尔盐等为原料制备,具体流程如图:

(1)《实验化学》中制备摩尔盐的化学方程式为______
(2)步骤1中少量稀硫酸的作用是______ ,步骤Ⅱ中过量饱和草酸的作用是______
(3)请设计实验方案证明FeC2O4•2H2O晶体已经洗涤干净:______
(4)步骤Ⅲ在40℃条件下进行的原因______
(5)步骤Ⅵ抽滤如图安装好装置,请按正确操作顺序补充完整:

在布氏漏斗中加入滤纸→______ →确认抽干
a、转移固液混合物;b、开大水龙头;c、关闭水龙头;d、微开水龙头;e、加入少量蒸馏水润湿滤纸

(1)《实验化学》中制备摩尔盐的化学方程式为
(2)步骤1中少量稀硫酸的作用是
(3)请设计实验方案证明FeC2O4•2H2O晶体已经洗涤干净:
(4)步骤Ⅲ在40℃条件下进行的原因
(5)步骤Ⅵ抽滤如图安装好装置,请按正确操作顺序补充完整:

在布氏漏斗中加入滤纸→
a、转移固液混合物;b、开大水龙头;c、关闭水龙头;d、微开水龙头;e、加入少量蒸馏水润湿滤纸
您最近一年使用:0次

 和
和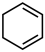 的稳定性
的稳定性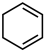 生成
生成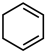 更稳定
更稳定

