1 . 常温下,下列有关电解质溶液的说法错误的是
A.相同浓度的 HCOONa和NaF两溶液,前者的pH较大,则  |
B.相同浓度的CH3COOH和CH3COONa两溶液等体积混合后pH约为4.7,则溶液中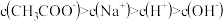 |
C.FeS溶于稀硫酸,而CuS不溶于稀硫酸,则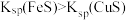 |
D.在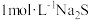 溶液中, 溶液中, |
您最近一年使用:0次
2020-07-11更新
|
7086次组卷
|
41卷引用:河南省濮阳市第一高级中学2021-2022学年高二上学期期中质量检测化学试题
河南省濮阳市第一高级中学2021-2022学年高二上学期期中质量检测化学试题2020年天津卷化学高考试题(已下线)专题10 水溶液中的离子平衡-2020年高考真题和模拟题化学分项汇编陕西省黄陵县中学2020-2021学年高二上学期期中考试化学试题(高新部)(已下线)易错18 电解质溶液图像-备战2021年高考化学一轮复习易错题(已下线)第27讲 盐类水解(精讲)——2021年高考化学一轮复习讲练测山东省济南市山东省实验中学西校2021届高三上学期10月份月考化学试题(已下线)小题必刷33 粒子浓度大小比较——2021年高考化学一轮复习小题必刷(通用版本)江西省抚州市金溪县第一中学2020-2021学年高二上学期第二次月考化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)专题07 电解质溶液——备战2021年高考化学纠错笔记(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)北京市昌平区新学道临川学校2021届高三上学期期末考试化学试题辽宁省大连市普兰店区第二中学2020-2021学年高二4月阶段性测试化学试题山东省济南大学城实验高级中学2021届高三4月阶段性测试化学试题(已下线)2021年高考化学押题预测卷(湖北卷)02(含考试版、答题卡、参考答案、全解全析)(已下线)难点6 水溶液中的四大平衡常数-2021年高考化学专练【热点·重点·难点】选择性必修1 专题3素养检测(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时39 弱电解质的电离平衡-2022年高考化学一轮复习小题多维练(全国通用)河北省张家口市第一中学2020-2021学年高二上学期10月月考(衔接班)化学 试题(已下线)第23讲 盐类水解(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向26 盐类的水解-备战2022年高考化学一轮复习考点微专题(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)2020年天津卷化学高考真题变式题1-12山东省济南外国语学校2021-2022学年高三上学期11月月考化学试题(已下线)专题07 电解质溶液—2022年高考化学二轮复习讲练测(全国版)-练习吉林省长春外国语学校2021-2022学年高二下学期期初考试化学试题湖南省长沙市南雅中学2021-2022学年高二下学期期中考试化学试题(已下线)考点28 盐类的水解-备战2023年高考化学一轮复习考点帮(全国通用)江西省抚州市金溪县第一中学2021-2022学年高二下学期第二次月考化学试题(已下线)第23讲 盐类水解 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)吉林省乾安县第七中学2021-2022学年高二上学期第三次质量检测化学试题(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)【2022】【高二上】【期中考】【高中化学】59北京市 首都师范大学附属中学2021-2022学年高二上学期期末考试化学试卷天津市第九十五中学益中学校2023-2024学年高二上学期12月月考化学试题天津市九十六中学2023-2024学年高三上学期12月月考化学试题安徽省淮北市树人高级中学2023-2024学年高二下学期开学考试化学试题
名校
解题方法
2 . 某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子(不考虑水电离出的H+和OH-),其物质的量浓度之比为c(Na+)∶c(Mg2+)∶c(Cl-)=5∶7∶7。若c(Na+)为5 mol/L,则c(SO42-)为( )。
| A.5 mol/L | B.6mol/L | C.7mol/L | D.8mol/L |
您最近一年使用:0次
2020-01-20更新
|
3050次组卷
|
15卷引用:河南省鹤壁市高中2023-2024学年高一上学期第三次段考化学试题
河南省鹤壁市高中2023-2024学年高一上学期第三次段考化学试题河南省顶级名校2023-2024学年高一上学期12月月考化学试题 辽宁省盘锦市辽河油田第二高级中学2019-2020学年高一上学期期末考试化学试题湖南省衡阳市衡阳县第四中学2022-2023学年高一上学期期中考试化学试题甘肃省白银市会宁县第一中学2022-2023学年高一上学期期中考试化学试题北京交通大学附属中学2022-2023学年高一上学期期中考试化学试题河北省石家庄外国语学校2022-2023学年高一上学期期中考试化学试题【2022】【高一上】【十四凤起+十四康桥】【期中考】【高中化学】【廖汨平收集】(已下线)【2022】【高一上】【期中考】【杭十一中】【高中化学】【李雪收集】北京市丰台区2022-2023学年高一上学期期中考试化学(A卷)试题内蒙古包钢第一中学2022-2023学年高一上学期期中考试化学试题山西大学附属中学校2023-2024学年高一上学期10月月考化学试题陕西省洛南中学2022-2023学年高二上学期11月期中考试化学试题河北省石家庄外国语学校(四十三中)2023-2024学年高一上学期期中考试化学试题湖南省永州市蓝山县第二中学2023-2024学年高一上学期第三次月考化学试卷
3 . CH3COOH溶液存在电离平衡,下列有关叙述不正确 的是
| A.向CH3COOH溶液中加水稀释,溶液中c(OH−)减小 |
| B.向CH3COOH溶液中加入少量的CH3COONa固体,电离平衡向左移动 |
| C.CH3COOH溶液中离子浓度的关系:c(H+)=c(OH−)+c(CH3COO−) |
| D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
您最近一年使用:0次
2022-03-05更新
|
508次组卷
|
5卷引用:河南省豫北名校2021-2022学年高二下学期4月份教学质量检测化学试题
河南省豫北名校2021-2022学年高二下学期4月份教学质量检测化学试题浙江省丽水市2021-2022学年高二上学期普通高中教学质量监控(期末)化学试题(已下线)2022年浙江省6月高考真题变式题11-20(已下线)第23讲 弱电解质的电离平衡(讲)-2023年高考化学一轮复习讲练测(全国通用)浙江省丽水市缙云县壶镇中学2021-2022学年高二上学期期末考试化学试题
4 . 已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(1)物质的量浓度均为 的下列四种溶液:
的下列四种溶液: 由小到大排列的顺序是
由小到大排列的顺序是_________________ 。
a. b.
b. c.
c. d.
d.
(2)常温下, 溶液加水稀释过程中,下列表达式的数据变大的是
溶液加水稀释过程中,下列表达式的数据变大的是________ (填序号)。
A B
B  C
C 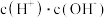 D
D  E
E 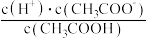
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:_______ 。
(4)25℃时,将 的醋酸溶液与
的醋酸溶液与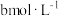 氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
_____________ (用含a、b的代数式表示)。
(5)标准状况下将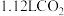 通入
通入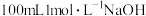 溶液中,用溶液中微粒的浓度符号完成下列等式:
溶液中,用溶液中微粒的浓度符号完成下列等式:
_________________ 。
| 化学式 |  |  |  |
| 电离平衡常数 |  |  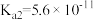 | 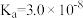 |
 的下列四种溶液:
的下列四种溶液: 由小到大排列的顺序是
由小到大排列的顺序是a.
 b.
b. c.
c. d.
d.
(2)常温下,
 溶液加水稀释过程中,下列表达式的数据变大的是
溶液加水稀释过程中,下列表达式的数据变大的是A
 B
B  C
C 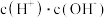 D
D  E
E 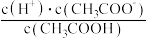
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(4)25℃时,将
 的醋酸溶液与
的醋酸溶液与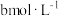 氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
(5)标准状况下将
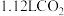 通入
通入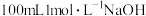 溶液中,用溶液中微粒的浓度符号完成下列等式:
溶液中,用溶液中微粒的浓度符号完成下列等式:
您最近一年使用:0次
2020-09-20更新
|
2061次组卷
|
5卷引用:河南省濮阳市元龙高级中学2021-2022学年高二下学期5月月考化学试题
2023·河北·模拟预测
名校
5 . 25℃时,用 盐酸滴定100mL等浓度的MOH溶液,混合溶液的pH及
盐酸滴定100mL等浓度的MOH溶液,混合溶液的pH及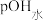 [
[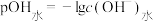 ,
, 为水电离出的
为水电离出的 的浓度]与滴入盐酸体积的关系如图所示。下列说法正确的是
的浓度]与滴入盐酸体积的关系如图所示。下列说法正确的是
 盐酸滴定100mL等浓度的MOH溶液,混合溶液的pH及
盐酸滴定100mL等浓度的MOH溶液,混合溶液的pH及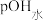 [
[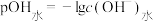 ,
, 为水电离出的
为水电离出的 的浓度]与滴入盐酸体积的关系如图所示。下列说法正确的是
的浓度]与滴入盐酸体积的关系如图所示。下列说法正确的是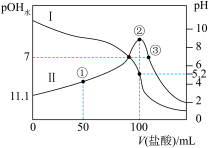
A.25℃时,MOH的电离常数数量级为 |
B.点①溶液中: |
C.点②溶液呈酸性,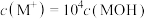 |
D.点③溶液呈中性, |
您最近一年使用:0次
2023-04-21更新
|
339次组卷
|
6卷引用:河南省驻马店高级中学2023-2024学年高三上学期12月阶段检测化学试题
河南省驻马店高级中学2023-2024学年高三上学期12月阶段检测化学试题 (已下线)2023年普通高中学业水平选择性考试化学押题卷(五)湖南省长沙市麓山国际实验学校2023-2024学年高三上学期第一次月考化学试题(已下线)选择题21-23湖南省衡阳市衡阳县第二中学2023-2024学年高三下学期开学摸底考试化学试卷重庆市名校联盟2023-2024学年高三下学期全真模拟考试化学试题
6 . 缓冲溶液是指加少量水稀释或外加少量酸、碱,自身pH不发生显著变化的溶液。1L含1mol乳酸(HLac)和1mol乳酸钠(NaLac)的溶液就是一种缓冲溶液,该溶液的pH为3.85。下图是此缓冲溶液的pH随通入HCl(g)或加入NaOH(s)的物质的量变化的示意图(溶液体积保持1L),已知lg3=0.48。下列说法错误的是
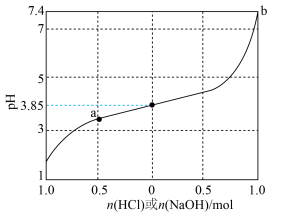
A.此缓冲溶液中(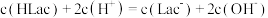 |
| B.通过计算可得出,a点溶液的pH约为3.37 |
| C.根据图像可以判断,b点溶液已失去缓冲能力 |
D.当加入NaOH,且横坐标为0.5时,对应溶液中(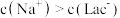 |
您最近一年使用:0次
2024-04-16更新
|
267次组卷
|
4卷引用:2024届河南省济洛平许四市高三下学期第三次质量检测(三模)理综试题-高中化学
名校
解题方法
7 . 电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。用0.100 mol∙L−1的KOH溶液分别滴定体积均为20.00mL、浓度均为0.100 mol∙L−1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是


| A.A点溶液中:c(CH3COO-)+c(OH-) −c(H+)=0.1 mol∙L−1 |
| B.B点溶液中:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
| C.相同温度下,C点水的电离程度大于A点 |
| D.由PA段电导率变化趋势可知,K+的导电能力强于H+ |
您最近一年使用:0次
2022-05-31更新
|
333次组卷
|
3卷引用:河南省信阳高级中学2021-2022学年高一下学期期末考试化学试题
名校
解题方法
8 . 如果Fe3+、 、Al3+和M四种离子以物质的量之比为2∶4∶1∶1共同存在于同一种溶液中,那么M可能是
、Al3+和M四种离子以物质的量之比为2∶4∶1∶1共同存在于同一种溶液中,那么M可能是
 、Al3+和M四种离子以物质的量之比为2∶4∶1∶1共同存在于同一种溶液中,那么M可能是
、Al3+和M四种离子以物质的量之比为2∶4∶1∶1共同存在于同一种溶液中,那么M可能是| A.Na+ | B. | C. | D.Cl- |
您最近一年使用:0次
名校
解题方法
9 . 已知H2A为二元弱酸。常温下,往0.01mol/L的NaHA溶液中通入HCl或加入KOH固体调节溶液的pH(忽略体积变化),溶液中c(HA-)随pH变化的曲线如图。下列说法正确的是


| A.水的电离程度: d>c>b>a |
| B.c→b之间离子方程式:A2−+H+=HA- |
| C.c点溶液中存在:c(HA-)> c(H2A)> c(A2−) |
| D.d点溶液中存在:c(HA-)+2 c(A2−)= c(Na+) |
您最近一年使用:0次
2021-12-19更新
|
523次组卷
|
6卷引用:河南省商城县观庙高级中学2021-2022学年高二上学期12月月考化学试题
河南省商城县观庙高级中学2021-2022学年高二上学期12月月考化学试题上海市闵行区2022届高三一模化学试题(已下线)上海市闵行区2022届高三一模化学试题江西省丰城市第九中学2022-2023学年高三上学期摸底考(日新班)化学试题(已下线)微专题 水溶液中函数图像的分析黑龙江省大庆市让胡路区大庆中学2022-2023学年高三上学期11月期中化学试题
10 . 常温下,用0.100mol/L的HCl分别滴定20.00mL浓度均为0.100mol/L的NaOH和氨水溶液(已知:常温下,水合氨 ),测得滴定过程中溶液的电导率变化曲线如图所示。下列说法正确的是
),测得滴定过程中溶液的电导率变化曲线如图所示。下列说法正确的是

 ),测得滴定过程中溶液的电导率变化曲线如图所示。下列说法正确的是
),测得滴定过程中溶液的电导率变化曲线如图所示。下列说法正确的是
A.b点溶液: |
B.d点溶液: |
C.e点溶液中: |
D.a、b、c、d点对应的溶液中,水的电离程度: |
您最近一年使用:0次
2021-12-24更新
|
490次组卷
|
2卷引用:河南省驻马店市2021-2022学年高二上学期期末考试化学试题



