2022高三·全国·专题练习
真题
名校
1 . 某小组模拟成垢-除垢过程如图。
100mL0.1mol•L-1CaCl2水溶液 ……
……
忽略体积变化,且步骤②中反应完全。下列说法正确的是
100mL0.1mol•L-1CaCl2水溶液
 ……
……忽略体积变化,且步骤②中反应完全。下列说法正确的是
| A.经过步骤①,溶液中c(Ca2+)+c(Na+)=c(Cl-) |
B.经过步骤②,溶液中c(Na+)=4c(SO ) ) |
C.经过步骤②,溶液中c(Cl-)=c(CO )+c(HCO )+c(HCO )+c(H2CO3) )+c(H2CO3) |
| D.经过步骤③,溶液中c(CH3COOH)+c(CH3COO-)=c(Cl-) |
您最近一年使用:0次
2023-02-22更新
|
4720次组卷
|
9卷引用:2022年重庆高考真题化学试题
2022年重庆高考真题化学试题(已下线)2022年重庆高考真题化学试题变式题(选择题11-14)(已下线)专题10 水溶液中的离子平衡-2022年高考真题模拟题分项汇编(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)第14练 水溶液中粒子浓度的关系判断 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点28 盐类的水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)题型15 沉淀溶解平衡及图像分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)广西壮族自治区南宁市第二中学2022-2023学年高二下学期期末化学考试试卷
2 . 鸟嘌呤( )是一种有机弱碱,可与盐酸反应生成盐酸盐(用
)是一种有机弱碱,可与盐酸反应生成盐酸盐(用 表示)。已知
表示)。已知 水溶液呈酸性,下列叙述正确的是
水溶液呈酸性,下列叙述正确的是
 )是一种有机弱碱,可与盐酸反应生成盐酸盐(用
)是一种有机弱碱,可与盐酸反应生成盐酸盐(用 表示)。已知
表示)。已知 水溶液呈酸性,下列叙述正确的是
水溶液呈酸性,下列叙述正确的是A.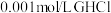 水溶液的 水溶液的 |
B.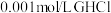 水溶液加水稀释, 水溶液加水稀释, 升高 升高 |
C. 在水中的电离方程式为: 在水中的电离方程式为: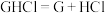 |
D. 水溶液中: 水溶液中: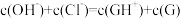 |
您最近一年使用:0次
2021-06-11更新
|
10373次组卷
|
44卷引用:重庆市长寿区2022-2023学年高二上学期期末质量检测化学试题
重庆市长寿区2022-2023学年高二上学期期末质量检测化学试题2021年新高考广东化学高考真题山东省淄博市2020-2021学年高二下学期期末考试化学试题(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时39 弱电解质的电离平衡-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第23讲 盐类水解(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向26 盐类的水解-备战2022年高考化学一轮复习考点微专题天津市耀华中学2021-2022学年高三上学期第一次月考化学试题(已下线)专题12 水溶液中的离子平衡-备战2022年高考化学学霸纠错(全国通用)2021年广东省高考化学试卷变式题1-10题(已下线)第八单元 水溶液中的离子平衡(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题13 水溶液中的离子平衡-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题07 电解质溶液—2022年高考化学二轮复习讲练测(全国版)-练习浙江省吴兴高级中学2021-2022学年高二上学期12月月考化学试题(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点04 水溶液中的离子平衡-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)天津市南开区2022届高三一模化学试题上海市曹杨中学2021-2022 学年高三下学期期中考试化学试题福建省泉州市泉港一中、厦门外国语石狮分校2021-2022学年高二下学期期中联考化学试题(已下线)专题10 水溶液中的离子平衡-三年(2020-2022)高考真题分项汇编(已下线)第13练 以pH的计算突破弱电解质的电离、溶液酸碱性-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)考点28 盐类的水解-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第32练 盐类的水解-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第23讲 盐类水解 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)云南省玉溪市通海县第三中学2021-2022学年高二上学期期末考试化学试题(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)浙江省杭州高级中学2022-2023学年高三上学期模拟考试化学试题广东省深圳市龙华区2021-2022学年高二上学期期末学业质量监测化学试题(已下线)专题20 溶液中粒子浓度大小的比较-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第八章 水溶液中的离子反应与平衡 第49讲 盐类的水解甘肃省张掖市高台县第一中学2022-2023学年高二下学期2月月考化学试题(已下线)题型26 电离平衡常数、水解平衡常数及其应用图像(已下线)第14练 水溶液中粒子浓度的关系判断 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点28 盐类的水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点2 水的电离与溶液的pH (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第4讲 盐类的水解广东省深圳市盐田高级中学2023-2024高二上学期期中考试化学试题天津市耀华中学2023-2024学年高二上学期11月期中化学试题陕西省咸阳市实验中学2023-2024学年高二上学期段性检测(三)化学试题湖北省武汉市育才高级中学等2校2023-2024学年高二上学期化学模拟试卷2024届广东省高州市第一中学高三下学期5月考前热身训练化学试题
名校
3 .  相同的以下溶液:①
相同的以下溶液:① ,②
,② ,③
,③ ,④
,④ ,⑤
,⑤ 溶液中,溶质物质的量浓度大小比较,正确的顺序是
溶液中,溶质物质的量浓度大小比较,正确的顺序是
 相同的以下溶液:①
相同的以下溶液:① ,②
,② ,③
,③ ,④
,④ ,⑤
,⑤ 溶液中,溶质物质的量浓度大小比较,正确的顺序是
溶液中,溶质物质的量浓度大小比较,正确的顺序是| A.⑤>④>①>②>③ | B.②>③>①>④>⑤ |
| C.④>⑤>②>③>① | D.③>②>①>④>⑤ |
您最近一年使用:0次
名校
4 . 已知 时,向
时,向 溶液中逐滴加入
溶液中逐滴加入 的盐酸,滴入过程中,溶液中
的盐酸,滴入过程中,溶液中 、
、 分布系数
分布系数 【如
【如 的分布系数:
的分布系数: 】与
】与 的变化关系如图所示。
的变化关系如图所示。
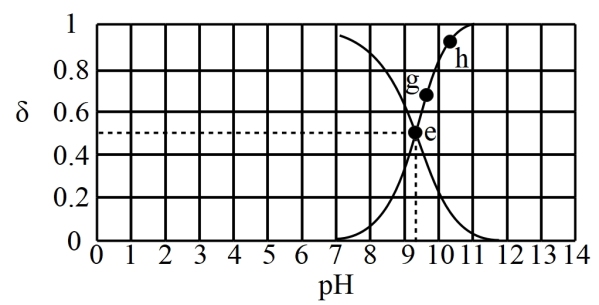
下列叙述错误的是
 时,向
时,向 溶液中逐滴加入
溶液中逐滴加入 的盐酸,滴入过程中,溶液中
的盐酸,滴入过程中,溶液中 、
、 分布系数
分布系数 【如
【如 的分布系数:
的分布系数: 】与
】与 的变化关系如图所示。
的变化关系如图所示。
下列叙述错误的是
A.水的电离程度: |
B. 的数量级是 的数量级是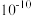 |
C. 时, 时, |
D. 时, 时, |
您最近一年使用:0次
2022-01-14更新
|
722次组卷
|
6卷引用:重庆市杨家坪中学2022-2023学年高二上学期1月期末考试化学试题
2023·河北·模拟预测
名校
5 . 25℃时,用 盐酸滴定100mL等浓度的MOH溶液,混合溶液的pH及
盐酸滴定100mL等浓度的MOH溶液,混合溶液的pH及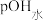 [
[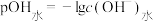 ,
, 为水电离出的
为水电离出的 的浓度]与滴入盐酸体积的关系如图所示。下列说法正确的是
的浓度]与滴入盐酸体积的关系如图所示。下列说法正确的是
 盐酸滴定100mL等浓度的MOH溶液,混合溶液的pH及
盐酸滴定100mL等浓度的MOH溶液,混合溶液的pH及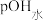 [
[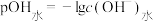 ,
, 为水电离出的
为水电离出的 的浓度]与滴入盐酸体积的关系如图所示。下列说法正确的是
的浓度]与滴入盐酸体积的关系如图所示。下列说法正确的是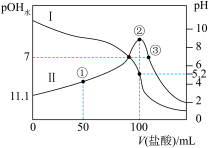
A.25℃时,MOH的电离常数数量级为 |
B.点①溶液中: |
C.点②溶液呈酸性,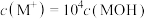 |
D.点③溶液呈中性, |
您最近一年使用:0次
2023-04-21更新
|
339次组卷
|
6卷引用:重庆市名校联盟2023-2024学年高三下学期全真模拟考试化学试题
重庆市名校联盟2023-2024学年高三下学期全真模拟考试化学试题(已下线)2023年普通高中学业水平选择性考试化学押题卷(五)湖南省长沙市麓山国际实验学校2023-2024学年高三上学期第一次月考化学试题(已下线)选择题21-23河南省驻马店高级中学2023-2024学年高三上学期12月阶段检测化学试题 湖南省衡阳市衡阳县第二中学2023-2024学年高三下学期开学摸底考试化学试卷
名校
解题方法
6 . I.请按要求完成下列问题:
(1)某温度时,测得0.01mol/LNaOH溶液的pH=11,该温度下水的离子积Kw=_____ 。该温度下,将pH=12的NaOH溶液Va mL与pH=2的H2SO4溶液Vb mL混合,混合后溶液的pH=11,则Va:Vb=_____
Ⅱ. 已知H2A在水中存在以下平衡:H2A=H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(2)NaHA溶液显___________ (填“酸性”、“碱性”、“中性”), NaHA溶液中的离子浓度由大到小的顺序为_____ .
(3)某温度下,向0.1 mol/L的NaHA溶液中滴入0.1 mol/LKOH溶液至中性,此时溶液中以下关系一定正确的是___________(填字母)。
III. 完成下列问题:
(4)用物质的量分别为 的HCN和NaCN配成1L混合溶液,已知其中
的HCN和NaCN配成1L混合溶液,已知其中 小于
小于 ,则溶液中c(H+)
,则溶液中c(H+) _____ . c(OH-),
_____ .
(5)室温下将amol/L的HCN与0.1mol/L的NaOH溶液等体积混合,反应后溶液中c(Na+)=c(CN-),则溶液显___________ 性(填“酸”“碱”“中”);用含a的代数式表示HCN的电离常数Ka= ___________ 。
(1)某温度时,测得0.01mol/LNaOH溶液的pH=11,该温度下水的离子积Kw=
Ⅱ. 已知H2A在水中存在以下平衡:H2A=H++HA-,HA-
 H++A2-。回答以下问题:
H++A2-。回答以下问题:(2)NaHA溶液显
(3)某温度下,向0.1 mol/L的NaHA溶液中滴入0.1 mol/LKOH溶液至中性,此时溶液中以下关系一定正确的是___________(填字母)。
| A.c(H+)·c(OH-)=1×10-14 mol2/L2 | B.c(Na+)+c(K+)=c(HA-)+2c(A2-) |
| C.c(Na+)>c(K+) | D.c(Na+)+c(K+)=0.05 mol/L |
III. 完成下列问题:
(4)用物质的量分别为
 的HCN和NaCN配成1L混合溶液,已知其中
的HCN和NaCN配成1L混合溶液,已知其中 小于
小于 ,则溶液中c(H+)
,则溶液中c(H+) 
(5)室温下将amol/L的HCN与0.1mol/L的NaOH溶液等体积混合,反应后溶液中c(Na+)=c(CN-),则溶液显
您最近一年使用:0次
名校
解题方法
7 . 常温下,将一定浓度的HA和HB两种酸溶液分别与0.1mol•L﹣1NaOH溶液等体积混合,实验记录如表:
下列说法正确的是
| 混合液 | pH | 加入的酸 | 酸的浓度/(mol•L﹣1) |
| ① | 8.6 | HA | 0.10 |
| ② | 2.0 | HB | 0.12 |
| A.HA为强酸,HB为弱酸 |
| B.溶液①中存在:c(A﹣)>c(Na+)>c(OH﹣)>c(H+) |
| C.升高温度,溶液①中c(A﹣)﹣c(HA)的值会增大 |
| D.溶液②中存在:c(Na+)+c(H+)=c(OH﹣)+(B﹣) |
您最近一年使用:0次
2023-03-22更新
|
274次组卷
|
2卷引用:重庆市第一中学校2020-2021学年高二下学期期末考试化学试题
名校
8 . 在25mL0.1mol·L-1某一元碱中,逐滴加入0.1mol·L-1醋酸,滴定曲线如图所示。则下列说法不正确的是


| A.该碱溶液可以溶解Al(OH)3 |
| B.a点对应的体积值大于25mL |
| C.C点时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.D点时,c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) |
您最近一年使用:0次
2019-04-04更新
|
1295次组卷
|
6卷引用:重庆市朝阳中学2020-2021学年高二上学期12 月考化学试题
名校
9 . Ⅰ. 在染料、造纸、制革、化学合成等工业中作为还原剂,在酿造、饮料行业中用作杀菌剂,还可用于生产糖精、香料等。其水溶液中含硫微粒随pH的分布曲线如图所示。
在染料、造纸、制革、化学合成等工业中作为还原剂,在酿造、饮料行业中用作杀菌剂,还可用于生产糖精、香料等。其水溶液中含硫微粒随pH的分布曲线如图所示。
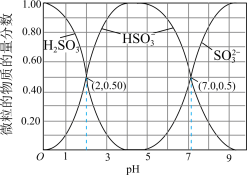
请回答以下问题:
(1)下列说法正确的是_______。
(2)若向 溶液中滴入NaOH溶液使pH恰好为7,此时测得
溶液中滴入NaOH溶液使pH恰好为7,此时测得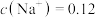 mol∙L−1,则溶液中
mol∙L−1,则溶液中
_______ mol∙L−1;
(3)已知几种酸的Ka如下表所示,下列化学方程式正确的是_______。
Ⅱ.工业上可用纯碱吸收二氧化硫法制备 ,流程如下图所示。
,流程如下图所示。
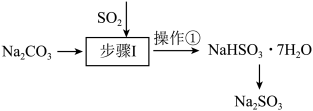
(4)步骤I中边搅拌边向 溶液中通入
溶液中通入 制备
制备 溶液,结合
溶液,结合 的分布系数图,确定停止通入
的分布系数图,确定停止通入 的最佳pH范围是
的最佳pH范围是_______ ,操作①的名称为_______ ;
(5)某小组同学用0.1000 mol∙L−1的酸性 溶液测定产品中
溶液测定产品中 的含量,具体流程:
的含量,具体流程:
①称量1 g样品,溶解,配置成250 mL的溶液;
②用滴定管量取25.00 mL样品溶液于锥形瓶中,用酸性 溶液滴定;
溶液滴定;
③消耗 溶液体积为20.00 mL;
溶液体积为20.00 mL;
试计算样品中 的纯度
的纯度_______ 。
(6)连二亚硫酸钠( )俗称保险粉,是一种强还原剂。工业常用惰性电极电解酸性亚硫酸氢钠溶液制备连二亚硫酸钠,原理及装置如图所示,a电极反应为
)俗称保险粉,是一种强还原剂。工业常用惰性电极电解酸性亚硫酸氢钠溶液制备连二亚硫酸钠,原理及装置如图所示,a电极反应为_______ 。

 在染料、造纸、制革、化学合成等工业中作为还原剂,在酿造、饮料行业中用作杀菌剂,还可用于生产糖精、香料等。其水溶液中含硫微粒随pH的分布曲线如图所示。
在染料、造纸、制革、化学合成等工业中作为还原剂,在酿造、饮料行业中用作杀菌剂,还可用于生产糖精、香料等。其水溶液中含硫微粒随pH的分布曲线如图所示。
请回答以下问题:
(1)下列说法正确的是_______。
A. 溶液显碱性 溶液显碱性 |
B. 时,溶液中 时,溶液中 |
C. 溶液中 溶液中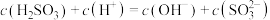 |
D. 溶液中 溶液中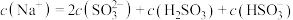 |
 溶液中滴入NaOH溶液使pH恰好为7,此时测得
溶液中滴入NaOH溶液使pH恰好为7,此时测得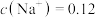 mol∙L−1,则溶液中
mol∙L−1,则溶液中
(3)已知几种酸的Ka如下表所示,下列化学方程式正确的是_______。
| 碳酸 | 次氯酸 | 醋酸 |
 |  | 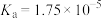 |
 |
A.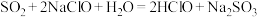 |
B.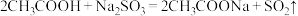 |
C. |
D. |
Ⅱ.工业上可用纯碱吸收二氧化硫法制备
 ,流程如下图所示。
,流程如下图所示。
(4)步骤I中边搅拌边向
 溶液中通入
溶液中通入 制备
制备 溶液,结合
溶液,结合 的分布系数图,确定停止通入
的分布系数图,确定停止通入 的最佳pH范围是
的最佳pH范围是(5)某小组同学用0.1000 mol∙L−1的酸性
 溶液测定产品中
溶液测定产品中 的含量,具体流程:
的含量,具体流程:①称量1 g样品,溶解,配置成250 mL的溶液;
②用滴定管量取25.00 mL样品溶液于锥形瓶中,用酸性
 溶液滴定;
溶液滴定;③消耗
 溶液体积为20.00 mL;
溶液体积为20.00 mL;试计算样品中
 的纯度
的纯度(6)连二亚硫酸钠(
 )俗称保险粉,是一种强还原剂。工业常用惰性电极电解酸性亚硫酸氢钠溶液制备连二亚硫酸钠,原理及装置如图所示,a电极反应为
)俗称保险粉,是一种强还原剂。工业常用惰性电极电解酸性亚硫酸氢钠溶液制备连二亚硫酸钠,原理及装置如图所示,a电极反应为
您最近一年使用:0次
名校
解题方法
10 . 25℃时,向20mL0.1mol/LH2R(二元弱酸)溶液中滴加0.1mol/LNaOH溶液,溶液pH与加入NaOH溶液体积的关系如图所示。下列说法正确的是


A.a点对应的溶液中: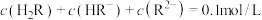 |
B.b点对应的溶液中: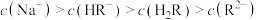 |
| C.a、b、c、d四点中,d点对应的溶液中水的电离程度最大 |
D.a、b、c、d各点溶液中均有: |
您最近一年使用:0次
2022-08-24更新
|
388次组卷
|
5卷引用:重庆市铜梁一中等三校2022-2023学年高二上学期期末考试化学试题
重庆市铜梁一中等三校2022-2023学年高二上学期期末考试化学试题黑龙江省哈尔滨市2022-2023学年高三上学期学业质量监测化学试题四川省泸县第四中学2022-2023学年高二上学期期末考试化学试题(已下线)河南省湘豫名校2023届高三下学期第一次模拟化学试题变式题(选择题11-13)湖南省 邵阳市第二中学2023-2024学年高二上学期1月期末化学试题



