解题方法
1 . 常温下,某二元弱酸 的
的 ,
,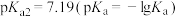 。用
。用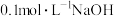 溶液滴定
溶液滴定 溶液,溶液的
溶液,溶液的 随
随 溶液体积的变化如图所示。下列说法正确的是
溶液体积的变化如图所示。下列说法正确的是
 的
的 ,
,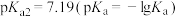 。用
。用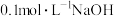 溶液滴定
溶液滴定 溶液,溶液的
溶液,溶液的 随
随 溶液体积的变化如图所示。下列说法正确的是
溶液体积的变化如图所示。下列说法正确的是
A.水的电离程度: |
B. |
C. 点溶液中: 点溶液中: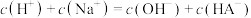  |
D. 溶液呈碱性 溶液呈碱性 |
您最近一年使用:0次
2 . H₂S是生命体系信号分子,它参与调节神经信号传递,具有舒张血管的功能。已知H₂S的沸点是-60.4℃。
(1)某兴趣小组用CaS与MgCl₂反应制备高纯H₂S,实验装置如图所示(装置A内产生的H₂S气体中含有酸性气体杂质)。_______ 。
②装置B的作用是_______ 。装置C中的Ba(OH)₂可不可以换成NaHS? _______ (填“可以”或“不可以”),若填“可以”,则发生反应的离子方程式是_______ (若填不可以,则忽略此空)。
③玻璃装置骤冷骤热的温差不可超过40℃,否则容易破裂。此实验为防止玻璃装置炸裂而采取的设计是_______ 。
④装置G的作用是_______ 。
(2)NO与H₂S之间的反应及产物非常复杂,研究发现,HNO、HSNO、HSSNO、HS 等均是生理过程的关键物种。已知SSNO⁻参与多个生理过程。其中涉及SSNO⁻形成及变化的可能反应如下:
等均是生理过程的关键物种。已知SSNO⁻参与多个生理过程。其中涉及SSNO⁻形成及变化的可能反应如下:
HSNO+HS →SSNO⁻+HS⁻+H⁺ K1=5.0×10²
→SSNO⁻+HS⁻+H⁺ K1=5.0×10²
HSNO+HS →HSSNO+HS⁻ K2=25.2
→HSSNO+HS⁻ K2=25.2
计算此温度下HSSNO的电离常数Ka=_______ (保留小数点后1位数字)。
(3)H₂S的水溶液是一种重要氮量分析试剂,已知25 ℃时,在0.10 mol⋅L⁻¹ H₂S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S²⁻)关系如图所示(忽略溶液体稠的变化、H₂S的挥发)。pH=13时,溶液中的c(H₂S)+c(HS⁻)=_______ mol⋅L⁻¹。
(1)某兴趣小组用CaS与MgCl₂反应制备高纯H₂S,实验装置如图所示(装置A内产生的H₂S气体中含有酸性气体杂质)。

②装置B的作用是
③玻璃装置骤冷骤热的温差不可超过40℃,否则容易破裂。此实验为防止玻璃装置炸裂而采取的设计是
④装置G的作用是
(2)NO与H₂S之间的反应及产物非常复杂,研究发现,HNO、HSNO、HSSNO、HS
 等均是生理过程的关键物种。已知SSNO⁻参与多个生理过程。其中涉及SSNO⁻形成及变化的可能反应如下:
等均是生理过程的关键物种。已知SSNO⁻参与多个生理过程。其中涉及SSNO⁻形成及变化的可能反应如下:HSNO+HS
 →SSNO⁻+HS⁻+H⁺ K1=5.0×10²
→SSNO⁻+HS⁻+H⁺ K1=5.0×10²HSNO+HS
 →HSSNO+HS⁻ K2=25.2
→HSSNO+HS⁻ K2=25.2计算此温度下HSSNO的电离常数Ka=
(3)H₂S的水溶液是一种重要氮量分析试剂,已知25 ℃时,在0.10 mol⋅L⁻¹ H₂S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S²⁻)关系如图所示(忽略溶液体稠的变化、H₂S的挥发)。pH=13时,溶液中的c(H₂S)+c(HS⁻)=

您最近一年使用:0次
3 . 25℃时,某二元酸( )的
)的 、
、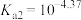 。1.0
。1.0 NaHA溶液稀释过程中
NaHA溶液稀释过程中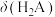 、
、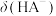 、
、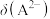 与
与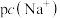 的关系如图所示。已知
的关系如图所示。已知 ,
, 的分布系数
的分布系数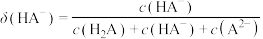 。下列说法错误的是
。下列说法错误的是
 )的
)的 、
、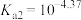 。1.0
。1.0 NaHA溶液稀释过程中
NaHA溶液稀释过程中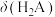 、
、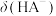 、
、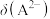 与
与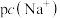 的关系如图所示。已知
的关系如图所示。已知 ,
, 的分布系数
的分布系数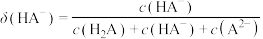 。下列说法错误的是
。下列说法错误的是
A.曲线n为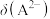 的变化曲线 的变化曲线 |
| B.a点:pH=4.37 |
C.b点: |
D.c点: |
您最近一年使用:0次
名校
4 . 硼酸 在水溶液中存在电离平衡:
在水溶液中存在电离平衡: 。用
。用 溶液分别滴定体积均为
溶液分别滴定体积均为 的
的 硼酸溶液、
硼酸溶液、 硼酸和甘露醇混合溶液,滴定过程中硼酸溶液
硼酸和甘露醇混合溶液,滴定过程中硼酸溶液 ,混合溶液的
,混合溶液的 随加入的
随加入的 溶液体积的变化如图。
溶液体积的变化如图。
 在水溶液中存在电离平衡:
在水溶液中存在电离平衡: 。用
。用 溶液分别滴定体积均为
溶液分别滴定体积均为 的
的 硼酸溶液、
硼酸溶液、 硼酸和甘露醇混合溶液,滴定过程中硼酸溶液
硼酸和甘露醇混合溶液,滴定过程中硼酸溶液 ,混合溶液的
,混合溶液的 随加入的
随加入的 溶液体积的变化如图。
溶液体积的变化如图。
已知:
| A.加入甘露醇不利于硼酸的准确滴定 |
B.从 滴定到 滴定到 ,混合溶液的 ,混合溶液的 比硼酸溶液的 比硼酸溶液的 大 大 |
C.P点: |
D.W点: |
您最近一年使用:0次
名校
5 . 向AgBr饱和溶液(有足量AgBr固体)中滴加 溶液,发生反应
溶液,发生反应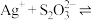
 和
和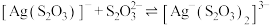 ,pM、pN与
,pM、pN与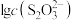 的关系如图所示。其中M代表
的关系如图所示。其中M代表 或
或 ,N代表
,N代表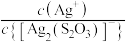 或
或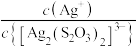 ,
,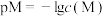 。下列说法错误的是
。下列说法错误的是
 溶液,发生反应
溶液,发生反应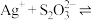
 和
和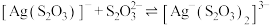 ,pM、pN与
,pM、pN与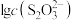 的关系如图所示。其中M代表
的关系如图所示。其中M代表 或
或 ,N代表
,N代表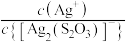 或
或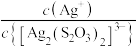 ,
,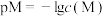 。下列说法错误的是
。下列说法错误的是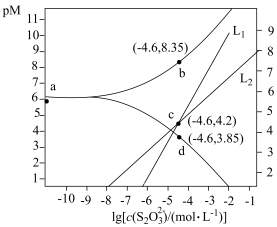
A. 表示 表示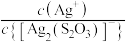 随 随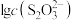 的变化关系 的变化关系 |
B.AgBr的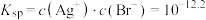 |
C.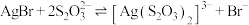 的平衡常数为 的平衡常数为 |
D.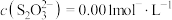 时,溶液中 时,溶液中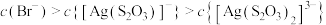 |
您最近一年使用:0次
2024-05-16更新
|
152次组卷
|
2卷引用:山东省淄博市部分学校2024届高三下学期阶段性测试(二模)化学试题
解题方法
6 . 工业上用电镀污泥[含Cr(OH)3,少量Cu(OH)2,FeO和Fe(OH)3等]和废铅膏(含PbSO4,少量PbO2,PbO)为原料制备铬酸铅的工艺流程如下: 存在,pH>7时Cr(Ⅵ)主要以
存在,pH>7时Cr(Ⅵ)主要以 存在。Fe(OH)3和Cr(OH)3易形成共沉淀。
存在。Fe(OH)3和Cr(OH)3易形成共沉淀。
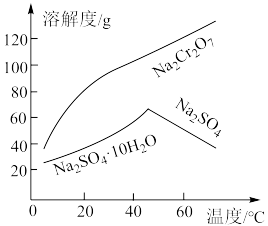
②相关化合物的溶解度与温度的关系如图所示:
(1)滤液1中主要的阳离子有 和
和_______ 。“沉铁”加入Na2CO3溶液调节溶液的pH=2,生成黄钠铁钒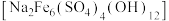 沉淀,pH不宜过大的原因是
沉淀,pH不宜过大的原因是_______ 。
(2)“转化”中Cr3+反应的离子方程式为_______ 。一系列操作的顺序为_______ (填标号)。
可供选择的操作有:①加热浓缩、趁热过滤 ②冷却结晶、过滤洗涤 ③加H2SO4溶液调pH ④加NaOH溶液调pH ⑤加热煮沸
(3)25℃时Na2Cr2O7溶液中存在多个平衡,本题条件下仅需考虑如下平衡:
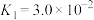 ;
;
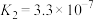 。pH=9,0.1 mol∙L-1Na2Cr2O7溶液中
。pH=9,0.1 mol∙L-1Na2Cr2O7溶液中 ,则溶液中
,则溶液中 的平衡浓度为
的平衡浓度为_______ (保留两位有效数字)。
(4)“盐浸”目的是加入Na2CO3溶液将PbSO4转化为PbCO3,Na2CO3溶液的最小浓度为_______ mol∙L-1 (保留两位有效数字)。[已知:25℃时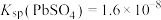 ,
,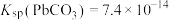 ,
, ]
]
(5)“焙烧”时H2C2O4与PbO2反应生成PbO、CO2和O2,测得CO2与O2分压比为2∶1,则反应的化学方程式为_______ 。

 存在,pH>7时Cr(Ⅵ)主要以
存在,pH>7时Cr(Ⅵ)主要以 存在。Fe(OH)3和Cr(OH)3易形成共沉淀。
存在。Fe(OH)3和Cr(OH)3易形成共沉淀。②相关化合物的溶解度与温度的关系如图所示:
(1)滤液1中主要的阳离子有
 和
和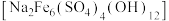 沉淀,pH不宜过大的原因是
沉淀,pH不宜过大的原因是(2)“转化”中Cr3+反应的离子方程式为
可供选择的操作有:①加热浓缩、趁热过滤 ②冷却结晶、过滤洗涤 ③加H2SO4溶液调pH ④加NaOH溶液调pH ⑤加热煮沸
(3)25℃时Na2Cr2O7溶液中存在多个平衡,本题条件下仅需考虑如下平衡:

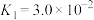 ;
;
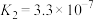 。pH=9,0.1 mol∙L-1Na2Cr2O7溶液中
。pH=9,0.1 mol∙L-1Na2Cr2O7溶液中 ,则溶液中
,则溶液中 的平衡浓度为
的平衡浓度为(4)“盐浸”目的是加入Na2CO3溶液将PbSO4转化为PbCO3,Na2CO3溶液的最小浓度为
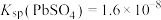 ,
,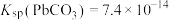 ,
, ]
](5)“焙烧”时H2C2O4与PbO2反应生成PbO、CO2和O2,测得CO2与O2分压比为2∶1,则反应的化学方程式为
您最近一年使用:0次
名校
7 . 某研究小组为研究水溶液中粒子浓度随pH的变化关系,25℃时,用NaOH调节 溶液的pH,且保持体系中
溶液的pH,且保持体系中 ,完成了一系列实验。粒子浓度的对数值(
,完成了一系列实验。粒子浓度的对数值(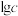 )、反应物初始物质的量之比
)、反应物初始物质的量之比 与pH的关系如图所示。下列说法错误的是
与pH的关系如图所示。下列说法错误的是
 溶液的pH,且保持体系中
溶液的pH,且保持体系中 ,完成了一系列实验。粒子浓度的对数值(
,完成了一系列实验。粒子浓度的对数值(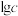 )、反应物初始物质的量之比
)、反应物初始物质的量之比 与pH的关系如图所示。下列说法错误的是
与pH的关系如图所示。下列说法错误的是
A. 对应的溶液中: 对应的溶液中: |
B. 对应的溶液中: 对应的溶液中: |
C. 对应的溶液中: 对应的溶液中: |
D.水的电离程度: |
您最近一年使用:0次
8 . 自然界中含 、
、 较多的水称为硬水,容易形成水垢。柠檬酸(用
较多的水称为硬水,容易形成水垢。柠檬酸(用 表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中
表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中 、
、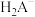 、
、 、
、 的百分含量随pH的变化曲线如图所示。回答下列问题:
的百分含量随pH的变化曲线如图所示。回答下列问题:__________ (写出其中一个离子方程式即可);加热能降低这种硬水中的 、
、 含量,其中
含量,其中 发生反应的化学方程式为
发生反应的化学方程式为_________ 。
(2)表示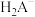 变化曲线的是
变化曲线的是_______ (填字母标号); 为
为_______ 。
(3)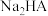 溶液显
溶液显____ (填“酸性”、“中性”或“碱性”),溶液中的电荷守恒关系式为________ 。
(4)向硬水中加入NaF固体可除去溶液中的 、
、 。若
。若 ,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为
,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为________  。[已知
。[已知 ,
,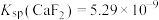 ]
]
 、
、 较多的水称为硬水,容易形成水垢。柠檬酸(用
较多的水称为硬水,容易形成水垢。柠檬酸(用 表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中
表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中 、
、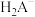 、
、 、
、 的百分含量随pH的变化曲线如图所示。回答下列问题:
的百分含量随pH的变化曲线如图所示。回答下列问题:
 、
、 含量,其中
含量,其中 发生反应的化学方程式为
发生反应的化学方程式为(2)表示
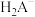 变化曲线的是
变化曲线的是 为
为(3)
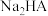 溶液显
溶液显(4)向硬水中加入NaF固体可除去溶液中的
 、
、 。若
。若 ,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为
,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为 。[已知
。[已知 ,
,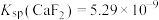 ]
]
您最近一年使用:0次
解题方法
9 . 25℃时,向 溶液中逐滴加入稀盐酸,溶液中含碳微粒(
溶液中逐滴加入稀盐酸,溶液中含碳微粒( 、
、 、
、 )的物质的量分数(
)的物质的量分数( )随溶液pOH[
)随溶液pOH[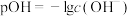 ]变化的部分情况如图所示。下列说法中正确的是
]变化的部分情况如图所示。下列说法中正确的是
 溶液中逐滴加入稀盐酸,溶液中含碳微粒(
溶液中逐滴加入稀盐酸,溶液中含碳微粒( 、
、 、
、 )的物质的量分数(
)的物质的量分数( )随溶液pOH[
)随溶液pOH[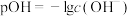 ]变化的部分情况如图所示。下列说法中正确的是
]变化的部分情况如图所示。下列说法中正确的是
A.曲线b代表 , , |
B.pOH=4时,溶液中 |
C.pOH=7时,溶液中 |
D.该温度下, 的水解平衡常数 的水解平衡常数 |
您最近一年使用:0次
解题方法
10 . 室温下, 、
、 、
、 。对于以下3种溶液:①0.10
。对于以下3种溶液:①0.10
 溶液;②向0.10
溶液;②向0.10
 溶液中通入少量
溶液中通入少量 所得的溶液;③向20mL 0.10
所得的溶液;③向20mL 0.10
 溶液中逐滴加入10mL等浓度NaOH溶液所得的溶液。下列说法正确的是
溶液中逐滴加入10mL等浓度NaOH溶液所得的溶液。下列说法正确的是
 、
、 、
、 。对于以下3种溶液:①0.10
。对于以下3种溶液:①0.10
 溶液;②向0.10
溶液;②向0.10
 溶液中通入少量
溶液中通入少量 所得的溶液;③向20mL 0.10
所得的溶液;③向20mL 0.10
 溶液中逐滴加入10mL等浓度NaOH溶液所得的溶液。下列说法正确的是
溶液中逐滴加入10mL等浓度NaOH溶液所得的溶液。下列说法正确的是| A.溶液①、③均显酸性 |
B.溶液①中存在: |
C.得到溶液②发生反应的离子方程式: |
D.溶液③中存在: |
您最近一年使用:0次



