1 . 盐与碱的反应是水溶液中常见的反应,某学习小组展开相关探究。
Ⅰ.NH4Cl抗碱容量(σ)的测定
(1)某小组同学测定NH4Cl固体抗碱容量的实验步骤如下:
a.配置100mL0.2mol·L-1NaOH溶液;
b.称取xgNH4Cl固体,溶于20mL水中,用上述NaOH溶液滴定至pH=11.
已知:氯化铵的抗碱容量是指用NaOH溶液滴定NH4Cl溶液至pH=11时,单位质量的NH4Cl所消耗NaOH的物质的量,即σ=
①步骤a需要称量NaOH固体为______ g(保留一位小数)
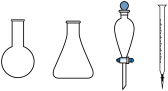
②步骤b需要用到下图所示仪器中的______ (填名称)。______ mol·g-1
Ⅱ.NH4Cl-NH3混合溶液抗碱能力的探究
NH4Cl-NH3混合溶液具有抗碱能力。向该溶液中加入少量NaOH,溶液的pH变化不大。
已知:i.25℃时,NH3·H2O的Kb=1.75×10-5=10-4.8
ii.NH4Cl-NH3混合溶液的抗碱能力与 、[c(
、[c( )+c(NH3)]有关
)+c(NH3)]有关
(2)NH4Cl溶液显酸性,用离子方程式解释原因:______ 。
(3)小组同学设计实验探究[c )+c(NH3)]一定时,
)+c(NH3)]一定时, 对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
①实验结果显示,NaCl溶液不具备抗碱能力,即曲线______ (填曲线标号)表示溶液1.
②实验结果显示,当[c( )+c(NH3)]相同时,
)+c(NH3)]相同时, 越大,混合溶液的抗碱能力越强,则曲线b表示溶液
越大,混合溶液的抗碱能力越强,则曲线b表示溶液______ (填溶液组号)
③已知A点时,c(NH4+)=c(NH3·H2O),则此时溶液的pH=______ (精确至小数点后1位)。
Ⅰ.NH4Cl抗碱容量(σ)的测定
(1)某小组同学测定NH4Cl固体抗碱容量的实验步骤如下:
a.配置100mL0.2mol·L-1NaOH溶液;
b.称取xgNH4Cl固体,溶于20mL水中,用上述NaOH溶液滴定至pH=11.
已知:氯化铵的抗碱容量是指用NaOH溶液滴定NH4Cl溶液至pH=11时,单位质量的NH4Cl所消耗NaOH的物质的量,即σ=

①步骤a需要称量NaOH固体为
②步骤b需要用到下图所示仪器中的
Ⅱ.NH4Cl-NH3混合溶液抗碱能力的探究
NH4Cl-NH3混合溶液具有抗碱能力。向该溶液中加入少量NaOH,溶液的pH变化不大。
已知:i.25℃时,NH3·H2O的Kb=1.75×10-5=10-4.8
ii.NH4Cl-NH3混合溶液的抗碱能力与
 、[c(
、[c( )+c(NH3)]有关
)+c(NH3)]有关(2)NH4Cl溶液显酸性,用离子方程式解释原因:
(3)小组同学设计实验探究[c
 )+c(NH3)]一定时,
)+c(NH3)]一定时, 对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示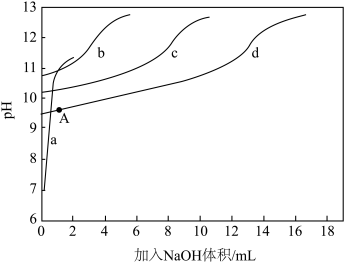
| 溶液组号 | 组成 | 体积/mL |
| 1 | 0.2mol·L-1NaCl溶液 | 15 |
| 2 | 0.1mol·L-1NH4Cl | 3 |
| 0.1mol·L-1氨水 | 12 | |
| 3 | 0.1mol·L-1NH4Cl | 7.5 |
| 0.1mol·L-1氨水 | 7.5 | |
| 4 | 0.1mol·L-1NH4Cl | 12 |
| 0.1mol·L-1氨水 | 3 |
②实验结果显示,当[c(
 )+c(NH3)]相同时,
)+c(NH3)]相同时, 越大,混合溶液的抗碱能力越强,则曲线b表示溶液
越大,混合溶液的抗碱能力越强,则曲线b表示溶液③已知A点时,c(NH4+)=c(NH3·H2O),则此时溶液的pH=
您最近一年使用:0次
名校
2 .  时,用
时,用 溶液调节醋酸溶液的
溶液调节醋酸溶液的 ,实验测得溶液中
,实验测得溶液中 、
、 的分布系数
的分布系数 与
与 的关系如图所示。其中
的关系如图所示。其中 。下列说法正确的是
。下列说法正确的是

 时,用
时,用 溶液调节醋酸溶液的
溶液调节醋酸溶液的 ,实验测得溶液中
,实验测得溶液中 、
、 的分布系数
的分布系数 与
与 的关系如图所示。其中
的关系如图所示。其中 。下列说法正确的是
。下列说法正确的是
A.曲线1代表 | B. , , 的电离常数 的电离常数 |
C. | D.溶液中始终存在 |
您最近一年使用:0次
2023-02-09更新
|
1152次组卷
|
4卷引用:广东省广州市天河区2023届高三二模化学试题
广东省广州市天河区2023届高三二模化学试题广东省广州市天河区2022-2023学年高二上学期期末考试化学试题(已下线)广东省广州市天河区2023届高三二模化学试题变式题(选择题11-16)福建省三明第一中学2023-2024学年高三上学期10月月考化学试题
名校
解题方法
3 . 氨氮废水会造成水体富营养化。可用沉淀法处理氨氮废水并获利缓释肥料磷酸镁铵( ),过程如下。
),过程如下。
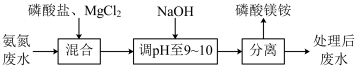
资料:
i.氧氮废水中氮元素主要以 形式存在;
形式存在;
ii. 、
、 ,难溶于水;
,难溶于水;
iii.当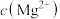 和
和 为1
为1 时,生成
时,生成 沉淀所需的
沉淀所需的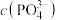 约为
约为 ,生成
,生成 沉淀所需的
沉淀所需的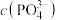 约为
约为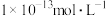 。
。
(1)检验溶液中 的操作是
的操作是_______ 。
(2)经处理后,分离磷酸镁铵所用的方法是_______ 。
(3)磷酸盐若选择 混合后会产生大量
混合后会产生大量 沉淀,反应的离子方程式为,氨氮去除率将
沉淀,反应的离子方程式为,氨氮去除率将_______ (填“提高”“降低”或“不变”)。
(4)含磷微粒的物质的量分数与pH的关系如下图所示。
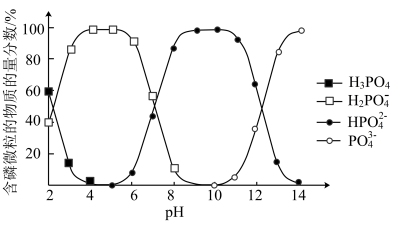
下列说法正确的是_______ (填序号)。
a. 溶液呈酸性
溶液呈酸性
b. 和
和 溶液中,微粒的种类相同
溶液中,微粒的种类相同
c.等浓度的 和
和 溶液中,
溶液中, 相等
相等
(5)处理氨氮废水时,磷酸盐可选用 。
。
①pH在9~10之间,主要生成 沉淀,反应的离子方程式为
沉淀,反应的离子方程式为_______ 。
②pH过大会降低废水中氨氮的去除率,可能的原因是_______ 。
③对于 较低的氨氮废水,上述磷酸铵镁沉淀法的处理效果不佳,且无法通过地加
较低的氨氮废水,上述磷酸铵镁沉淀法的处理效果不佳,且无法通过地加 和
和 的用量来改善,原因是
的用量来改善,原因是_______ 。
 ),过程如下。
),过程如下。
资料:
i.氧氮废水中氮元素主要以
 形式存在;
形式存在;ii.
 、
、 ,难溶于水;
,难溶于水;iii.当
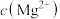 和
和 为1
为1 时,生成
时,生成 沉淀所需的
沉淀所需的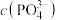 约为
约为 ,生成
,生成 沉淀所需的
沉淀所需的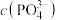 约为
约为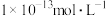 。
。(1)检验溶液中
 的操作是
的操作是(2)经处理后,分离磷酸镁铵所用的方法是
(3)磷酸盐若选择
 混合后会产生大量
混合后会产生大量 沉淀,反应的离子方程式为,氨氮去除率将
沉淀,反应的离子方程式为,氨氮去除率将(4)含磷微粒的物质的量分数与pH的关系如下图所示。

下列说法正确的是
a.
 溶液呈酸性
溶液呈酸性b.
 和
和 溶液中,微粒的种类相同
溶液中,微粒的种类相同c.等浓度的
 和
和 溶液中,
溶液中, 相等
相等(5)处理氨氮废水时,磷酸盐可选用
 。
。①pH在9~10之间,主要生成
 沉淀,反应的离子方程式为
沉淀,反应的离子方程式为②pH过大会降低废水中氨氮的去除率,可能的原因是
③对于
 较低的氨氮废水,上述磷酸铵镁沉淀法的处理效果不佳,且无法通过地加
较低的氨氮废水,上述磷酸铵镁沉淀法的处理效果不佳,且无法通过地加 和
和 的用量来改善,原因是
的用量来改善,原因是
您最近一年使用:0次
2022-09-01更新
|
685次组卷
|
4卷引用:广东省华南师范大学附属中学2022届高三下学期押题预测(一)化学试题
名校
4 . 常温下,将 溶液滴加到20mL
溶液滴加到20mL 二元弱酸
二元弱酸 溶液中,混合溶液的pH随NaOH溶液滴入量的关系如图所示。下列叙述不正确的是
溶液中,混合溶液的pH随NaOH溶液滴入量的关系如图所示。下列叙述不正确的是
 溶液滴加到20mL
溶液滴加到20mL 二元弱酸
二元弱酸 溶液中,混合溶液的pH随NaOH溶液滴入量的关系如图所示。下列叙述不正确的是
溶液中,混合溶液的pH随NaOH溶液滴入量的关系如图所示。下列叙述不正确的是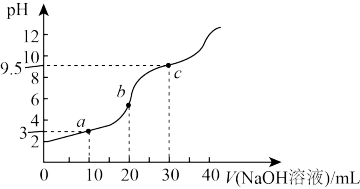
A.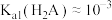 |
B.b点时溶液中存在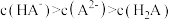 |
C.c点时溶液中存在 |
| D.溶液中水的电离程度:c>b>a |
您最近一年使用:0次
2022-08-28更新
|
2452次组卷
|
8卷引用:广东省深圳市光明区2023届高三上学期第一次模拟考试化学试题
广东省深圳市光明区2023届高三上学期第一次模拟考试化学试题(已下线)化学(广东B卷)-学易金卷:2023年高考第一次模拟考试卷广东省珠海市第一中学2022-2023学年高三上学期11月份阶段考试化学试题广东省深圳市福田区福田中学2023-2024学年高三上学期12月月考化学考试湖南省湘潭凤凰中学2022-2023学年高二上学期10月月考化学试题(已下线)易错点25 盐类水解-备战2023年高考化学考试易错题(已下线)2022年河北省高考真题变式题(1-9)江西省南昌市第十九中学2022-2023学年高三上学期(10月)第三次月考化学试卷
解题方法
5 . 甲酸铵常用于电解、电容器行业。25℃时,用HCl或NaOH固体改变0.1 mol/L的HCOONH4溶液的pH,1gc(HCOOH)、1gc(NH3·H2O)、1gc(H+)和1gc(OH-)随pH变化的关系如图所示。下列说法错误的是
[已知:Ka(HCOOH)=1.8×10-4,Kb(NH3·H2O)=1.8×10-5]

[已知:Ka(HCOOH)=1.8×10-4,Kb(NH3·H2O)=1.8×10-5]

| A.Q点对应溶液pH=7 |
| B.曲线①代表lgc(H+),曲线③代表1gc(NH3·H2O) |
| C.0.1 mol/LHCOONH4溶液中,c(H+)+c(HCOOH)=c(OH-)+c(NH3·H2O) |
| D.P点存在c(NH3·H2O)>c(OH-)=c(HCOOH)>c(H+) |
您最近一年使用:0次
名校
解题方法
6 . 甘氨酸盐酸盐(HOOCCH2NH3Cl)的水溶液呈酸性,溶液中存在以下平衡:
HOOCCH2NH
 -OOCCH2NH
-OOCCH2NH +H+ K1
+H+ K1
-OOCCH2NH
 -OOCCH2NH2+H+ K2
-OOCCH2NH2+H+ K2
常温时,向10mL一定浓度的HOOCCH2NH3Cl的水溶液中滴入同浓度的NaOH溶液。混合溶液pH随加入NaOH溶液体积的变化如图所示。下列说法不正确的是
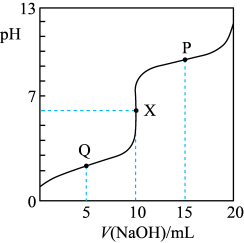
HOOCCH2NH

 -OOCCH2NH
-OOCCH2NH +H+ K1
+H+ K1-OOCCH2NH

 -OOCCH2NH2+H+ K2
-OOCCH2NH2+H+ K2常温时,向10mL一定浓度的HOOCCH2NH3Cl的水溶液中滴入同浓度的NaOH溶液。混合溶液pH随加入NaOH溶液体积的变化如图所示。下列说法不正确的是

A.Q→X过程中: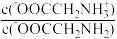 逐渐减小 逐渐减小 |
B.X点的溶液中:c(-OOCCH2NH2)>c(HOOCCH2NH ) ) |
C.P点的溶液中:c(HOOCCH2NH )+c(H+)=c(-OOCCH2NH2)+c(OH-) )+c(H+)=c(-OOCCH2NH2)+c(OH-) |
| D.当V(NaOH)=20mL时,混合溶液中的溶质主要为NaOOCCH2NH2和NaCl |
您最近一年使用:0次
2022-04-23更新
|
1434次组卷
|
6卷引用:广东省深圳市2022届高三下学期第二次调研考化学试题
广东省深圳市2022届高三下学期第二次调研考化学试题湖北省枣阳市第一中学2022届高三下学期5月第三次模拟考试化学试题(已下线)2022年辽宁省高考真题变式题(11-15)湖南省株洲市九方中学2022-2023学年高三上学期第五次月考化学试题(已下线)2022年辽宁高考真题化学试题变式题(选择题11-15)(已下线)微专题 水溶液中函数图像的分析
7 . 常温下,向一定浓度的NaA溶液中加适量强酸或强碱(忽略溶液体积变化),溶液中 、
、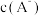 、
、 、
、 的负对数
的负对数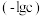 随溶液pH的变化关系如下图所示。下列叙述不正确的是
随溶液pH的变化关系如下图所示。下列叙述不正确的是

 、
、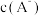 、
、 、
、 的负对数
的负对数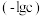 随溶液pH的变化关系如下图所示。下列叙述不正确的是
随溶液pH的变化关系如下图所示。下列叙述不正确的是
A.曲线①表示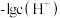 随溶液pH的变化情况 随溶液pH的变化情况 |
B.曲线①和曲线②的交点对应的溶液中存在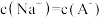 |
C.常温下,将A点对应溶液加水稀释,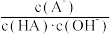 不变 不变 |
D.等物质的量浓度、等体积的NaA溶液与HA溶液混合后: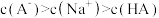 |
您最近一年使用:0次
2022-03-31更新
|
2750次组卷
|
6卷引用:广东省2021-2022学年高三下学期一模化学试题
广东省2021-2022学年高三下学期一模化学试题广东省普通高中2022届高三学业水平选择考化学模拟测试(一)(已下线)必刷卷02-2022年高考化学考前信息必刷卷(全国甲卷)(已下线)押广东卷化学第8题 电解质溶液-备战2022年高考化学临考题号押题(广东卷)湖北省2022届高三5月联考化学试题(已下线)微专题39 水溶液中平衡图像的拓展与探析-备战2023年高考化学一轮复习考点微专题
解题方法
8 . 25℃,0.200mol·L-1的HA溶液与0.200mol·L-1的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如下表,下列说法不正确的是
| 微粒 | X | Y | Na+ | A— |
| 浓度/(mol•L-1) | 5.00×10-4 | 2.50×10-10 | 0.100 | 9.95×10-2 |
| A.0.1mol·L-1HA溶液的pH=1 |
| B.溶液中c(OH-)=4.0×10-5 mol/L |
| C.微粒X表示HA |
| D.混合溶液中:c(Na+)+c(Y)=c(A-)+c(OH-) |
您最近一年使用:0次
9 . 室温下,用相同浓度的 溶液,分别滴定浓度均为
溶液,分别滴定浓度均为 的三种酸
的三种酸 、
、 和
和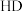 溶液,滴定曲线如图所示。下列判断不正确的是
溶液,滴定曲线如图所示。下列判断不正确的是
 溶液,分别滴定浓度均为
溶液,分别滴定浓度均为 的三种酸
的三种酸 、
、 和
和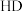 溶液,滴定曲线如图所示。下列判断不正确的是
溶液,滴定曲线如图所示。下列判断不正确的是 
A.三种酸的电离常数关系: |
B. 点时,溶液中: 点时,溶液中: |
C. 时,三种溶液中: 时,三种溶液中: |
D.当 中和达 中和达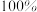 时,溶液中: 时,溶液中: |
您最近一年使用:0次
2021-10-23更新
|
720次组卷
|
3卷引用:广东省广州市天河区2022届高三一模化学试题
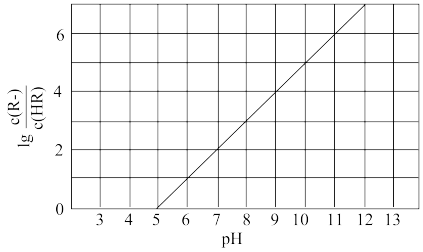
10 . 常温下,向1L0.1mol·L-1—酸HR溶液中缓慢通氨气[已知常温下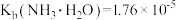 ],假设溶液温度和体积保持不变,混合溶液的pH与
],假设溶液温度和体积保持不变,混合溶液的pH与 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
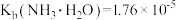 ],假设溶液温度和体积保持不变,混合溶液的pH与
],假设溶液温度和体积保持不变,混合溶液的pH与 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
A. 的HR溶液的pH约为3 的HR溶液的pH约为3 |
B.HR为弱酸,常温时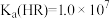 |
C.当通入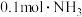 时,溶液中 时,溶液中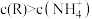 |
D.当溶液呈中性时,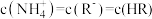 |
您最近一年使用:0次



