名校
解题方法
1 . 硫酸亚铁铵 的制备是化学、化工、材料专业需要完成的无机化学实验,步骤如下:
的制备是化学、化工、材料专业需要完成的无机化学实验,步骤如下:
Ⅰ.称取0.70 g铁屑放在烧杯中,加入足量3mol·L 的
的 溶液,再加入22mL蒸馏水,在70℃水浴锅中反应50~60 min;
溶液,再加入22mL蒸馏水,在70℃水浴锅中反应50~60 min;
Ⅱ.抽滤,在得到的滤液中添加足量 ,
, 溶解后,用3 mol⋅L
溶解后,用3 mol⋅L 的稀硫酸将溶液pH调至1~2;
的稀硫酸将溶液pH调至1~2;
Ⅲ.再将溶液转移至蒸发皿中,用酒精灯加热蒸发,冷却结晶,抽滤,用无水乙醇洗涤晶体1~2次,所得到的产物质量为3.92 g。
回答下列问题:
(1)“步骤Ⅰ”中铁屑发生反应的离子方程式为___________ ,该步骤要在通风橱中进行,其目的是___________ ;若铁屑中混有少量FeS,需将生成的气体通入 溶液,反应过程中该溶液的pH
溶液,反应过程中该溶液的pH___________ (填“升高”“降低”或“不变”)。
(2)“步骤Ⅱ”中用3 mol⋅L 的稀硫酸将溶液pH调至1~2,其目的是
的稀硫酸将溶液pH调至1~2,其目的是___________ , 时该溶液中
时该溶液中
___________ (实验条件下, 的电离常数
的电离常数 、
、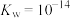 ,保留两位有效数字)。
,保留两位有效数字)。
(3)“步骤Ⅲ”中用酒精灯加热蒸发至___________ 时,停止加热;用无水乙醇洗涤晶体的目的是___________ 。
(4)该实验中硫酸亚铁铵的产率为___________ 。
 的制备是化学、化工、材料专业需要完成的无机化学实验,步骤如下:
的制备是化学、化工、材料专业需要完成的无机化学实验,步骤如下:Ⅰ.称取0.70 g铁屑放在烧杯中,加入足量3mol·L
 的
的 溶液,再加入22mL蒸馏水,在70℃水浴锅中反应50~60 min;
溶液,再加入22mL蒸馏水,在70℃水浴锅中反应50~60 min;Ⅱ.抽滤,在得到的滤液中添加足量
 ,
, 溶解后,用3 mol⋅L
溶解后,用3 mol⋅L 的稀硫酸将溶液pH调至1~2;
的稀硫酸将溶液pH调至1~2;Ⅲ.再将溶液转移至蒸发皿中,用酒精灯加热蒸发,冷却结晶,抽滤,用无水乙醇洗涤晶体1~2次,所得到的产物质量为3.92 g。
回答下列问题:
(1)“步骤Ⅰ”中铁屑发生反应的离子方程式为
 溶液,反应过程中该溶液的pH
溶液,反应过程中该溶液的pH(2)“步骤Ⅱ”中用3 mol⋅L
 的稀硫酸将溶液pH调至1~2,其目的是
的稀硫酸将溶液pH调至1~2,其目的是 时该溶液中
时该溶液中
 的电离常数
的电离常数 、
、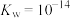 ,保留两位有效数字)。
,保留两位有效数字)。(3)“步骤Ⅲ”中用酒精灯加热蒸发至
(4)该实验中硫酸亚铁铵的产率为
您最近一年使用:0次
解题方法
2 . 研究化学平衡对学习化学具有重要意义。
Ⅰ.在恒容密闭容器中发生如下反应:2NO2(g) N2O4(g) ΔH<0
N2O4(g) ΔH<0
(1)升高温度,该反应的平衡常数_______ (填“增大”“减小”或“不变”)。
(2)判断该反应是否达到平衡,下列可以作为判断依据的是_______。
Ⅱ.一定温度下,向2L的恒容密闭容器中充入一定量的N2和CO2发生反应:N2(g)+CO2(g) C(s)+2NO(g)。其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g)。其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。

(3)0~10min内NO的反应速率为_______ 。
(4)图中A点υ(正)_______ υ(逆)(填“>”“<”或“=”)。
(5)第10min时,外界改变的条件可能是_______。
Ⅲ.含氯化合物广泛用于水处理剂及漂白剂。已知:工业上将Cl2通入7mol/L的NaOH溶液中制备NaClO;25℃时NaClO溶液中HClO、ClO-的物质的量分数随pH变化的分布如下图所示。

(6)写出上述制备NaClO的离子方程式_______ ;
(7)当NaClO溶液pH=9时,该溶液中主要存在的含氯阴离子有_______ (填离子符号);
(8)25℃时,反应ClO-+H2O HClO+OH-的平衡常数K=
HClO+OH-的平衡常数K=_______ (填数值)。
Ⅰ.在恒容密闭容器中发生如下反应:2NO2(g)
 N2O4(g) ΔH<0
N2O4(g) ΔH<0(1)升高温度,该反应的平衡常数
(2)判断该反应是否达到平衡,下列可以作为判断依据的是_______。
| A.容器内气体密度不再变化 | B.容器内各气体浓度不再变化 |
| C.体系中颜色不再变化 | D.υ正(NO2)=2υ正(N2O4) |
Ⅱ.一定温度下,向2L的恒容密闭容器中充入一定量的N2和CO2发生反应:N2(g)+CO2(g)
 C(s)+2NO(g)。其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g)。其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
(3)0~10min内NO的反应速率为
(4)图中A点υ(正)
(5)第10min时,外界改变的条件可能是_______。
| A.加催化剂 | B.增大C(s)的量 |
| C.升温 | D.减小CO2的量 |
Ⅲ.含氯化合物广泛用于水处理剂及漂白剂。已知:工业上将Cl2通入7mol/L的NaOH溶液中制备NaClO;25℃时NaClO溶液中HClO、ClO-的物质的量分数随pH变化的分布如下图所示。

(6)写出上述制备NaClO的离子方程式
(7)当NaClO溶液pH=9时,该溶液中主要存在的含氯阴离子有
(8)25℃时,反应ClO-+H2O
 HClO+OH-的平衡常数K=
HClO+OH-的平衡常数K=
您最近一年使用:0次
解题方法
3 . 200℃时,气态肼(N2H4)在Cu-Ni双金属表面分解的过程如下:
过程Ⅰ:3N2H4(g)=N2(g)+4NH3(g) △H1=akJ•mol-1
过程Ⅱ:2NH3(g)=N2(g)+3H2(g) △H2=+92kJ•mol-1
已知相关化学键的数据如表所示:
(1)过程Ⅰ中a=_____ ,写出气态肼(N2H4)在Cu-Ni双金属表面分解成氮气和氢气的热化学方程式_____ 。
(2)300℃时,向2L刚性容器中充入1molN2H4发生分解成N2和H2的反应,不同时刻测得容器内压强的变化如表所示:
反应前5小时内的平均反应速率v(N2)为_____ mol•L-1•h-1,平衡时H2的分压p(H2)=_____ MPa。
(3)在温度为573K、压强为100kPa的反应条件下,对于n(N2H4):n(Ne)分别为3:1、1:1、1:3、1:6的N2H4-Ne混合气在热分解反应过程中N2H4的转化率随时间的变化如图所示:

①n(N2H4):n(Ne)的比值越小,N2H4的平衡转化率越_____ (填“大”或“小”),理由是_____ 。
②n(N2H4):n(Ne)=1:3所对应的曲线是_____ (填字母代号)。
(4)肼(N2H4)又称联氨,溶于水可以发生与氨水类似的电离,是一种二元弱碱。肼溶于水的电离方程式为:
N2H4+H2O N2H
N2H +OH- Kb1=2×10-8
+OH- Kb1=2×10-8
N2H +H2O
+H2O N2H
N2H +OH- Kb2=6×10-10
+OH- Kb2=6×10-10
现将等浓度等体积的肼的水溶液与硫酸溶液混合,混合后生成的盐的化学式为_____ ,混合后溶液中 =
=_____ 。
过程Ⅰ:3N2H4(g)=N2(g)+4NH3(g) △H1=akJ•mol-1
过程Ⅱ:2NH3(g)=N2(g)+3H2(g) △H2=+92kJ•mol-1
已知相关化学键的数据如表所示:
| 化学键 | H-H | N-N | N≡N | H-N |
| E/(kJ•mol-1) | x | 265 | 946 | y |
(2)300℃时,向2L刚性容器中充入1molN2H4发生分解成N2和H2的反应,不同时刻测得容器内压强的变化如表所示:
| 时间/h | 0 | 1 | 2 | 3 | 5 | 6 | 7 |
| p/MPa | 50 | 60 | 80 | 120 | 140 | 140 | 140 |
(3)在温度为573K、压强为100kPa的反应条件下,对于n(N2H4):n(Ne)分别为3:1、1:1、1:3、1:6的N2H4-Ne混合气在热分解反应过程中N2H4的转化率随时间的变化如图所示:

①n(N2H4):n(Ne)的比值越小,N2H4的平衡转化率越
②n(N2H4):n(Ne)=1:3所对应的曲线是
(4)肼(N2H4)又称联氨,溶于水可以发生与氨水类似的电离,是一种二元弱碱。肼溶于水的电离方程式为:
N2H4+H2O
 N2H
N2H +OH- Kb1=2×10-8
+OH- Kb1=2×10-8N2H
 +H2O
+H2O N2H
N2H +OH- Kb2=6×10-10
+OH- Kb2=6×10-10现将等浓度等体积的肼的水溶液与硫酸溶液混合,混合后生成的盐的化学式为
 =
=
您最近一年使用:0次
解题方法
4 . 平衡常数是分析平衡问题的重要依据。回答下列问题:
(1)已知: 时,
时, 的
的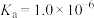 ,则
,则 时,
时, 的
的 溶液的
溶液的
_______ 。
(2)在温度为 时,某研究人员测定
时,某研究人员测定 的电离常数
的电离常数 为
为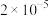 ,
, 的水解常数
的水解常数 为
为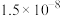 ,则该温度下水的离子积常数
,则该温度下水的离子积常数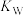 为
为_______ ,请判断
_______ (填“>”“<”或“=”) 。
。
(3)化工生产中常用 作沉淀剂除去工业废水中的
作沉淀剂除去工业废水中的 :
: 。该反应的平衡常数
。该反应的平衡常数 为
为_______ ( 和
和 的
的 分别为
分别为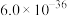 、
、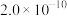 )。
)。
(4) 时,将
时,将 的氨水与
的氨水与 的盐酸等体积混合,所得溶液中
的盐酸等体积混合,所得溶液中 ,则溶液显
,则溶液显_______ (填“酸”“碱”或“中”)性;用含a的代数式表示 的电离常数
的电离常数
_______ 。
(1)已知:
 时,
时, 的
的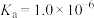 ,则
,则 时,
时, 的
的 溶液的
溶液的
(2)在温度为
 时,某研究人员测定
时,某研究人员测定 的电离常数
的电离常数 为
为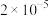 ,
, 的水解常数
的水解常数 为
为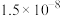 ,则该温度下水的离子积常数
,则该温度下水的离子积常数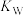 为
为
 。
。(3)化工生产中常用
 作沉淀剂除去工业废水中的
作沉淀剂除去工业废水中的 :
: 。该反应的平衡常数
。该反应的平衡常数 为
为 和
和 的
的 分别为
分别为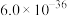 、
、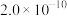 )。
)。(4)
 时,将
时,将 的氨水与
的氨水与 的盐酸等体积混合,所得溶液中
的盐酸等体积混合,所得溶液中 ,则溶液显
,则溶液显 的电离常数
的电离常数
您最近一年使用:0次
5 . 室温下, 与
与 溶液的滴定曲线如图。下列说法不正确的是
溶液的滴定曲线如图。下列说法不正确的是

 与
与 溶液的滴定曲线如图。下列说法不正确的是
溶液的滴定曲线如图。下列说法不正确的是
A. |
B.由b点可知 |
C.c点时,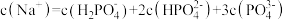 |
D. 溶液不能用 溶液不能用 溶液直接进行中和滴定,可先加入 溶液直接进行中和滴定,可先加入 溶液再进行滴定 溶液再进行滴定 |
您最近一年使用:0次
2022-01-21更新
|
421次组卷
|
2卷引用:福建省四地市2022届高三上学期第一次质量检测化学试题



