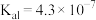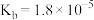平衡常数是分析平衡问题的重要依据。回答下列问题:
(1)已知: 时,
时, 的
的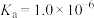 ,则
,则 时,
时, 的
的 溶液的
溶液的
_______ 。
(2)在温度为 时,某研究人员测定
时,某研究人员测定 的电离常数
的电离常数 为
为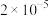 ,
, 的水解常数
的水解常数 为
为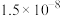 ,则该温度下水的离子积常数
,则该温度下水的离子积常数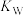 为
为_______ ,请判断
_______ (填“>”“<”或“=”) 。
。
(3)化工生产中常用 作沉淀剂除去工业废水中的
作沉淀剂除去工业废水中的 :
: 。该反应的平衡常数
。该反应的平衡常数 为
为_______ ( 和
和 的
的 分别为
分别为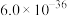 、
、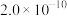 )。
)。
(4) 时,将
时,将 的氨水与
的氨水与 的盐酸等体积混合,所得溶液中
的盐酸等体积混合,所得溶液中 ,则溶液显
,则溶液显_______ (填“酸”“碱”或“中”)性;用含a的代数式表示 的电离常数
的电离常数
_______ 。
(1)已知:
 时,
时, 的
的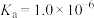 ,则
,则 时,
时, 的
的 溶液的
溶液的
(2)在温度为
 时,某研究人员测定
时,某研究人员测定 的电离常数
的电离常数 为
为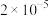 ,
, 的水解常数
的水解常数 为
为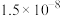 ,则该温度下水的离子积常数
,则该温度下水的离子积常数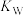 为
为
 。
。(3)化工生产中常用
 作沉淀剂除去工业废水中的
作沉淀剂除去工业废水中的 :
: 。该反应的平衡常数
。该反应的平衡常数 为
为 和
和 的
的 分别为
分别为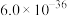 、
、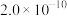 )。
)。(4)
 时,将
时,将 的氨水与
的氨水与 的盐酸等体积混合,所得溶液中
的盐酸等体积混合,所得溶液中 ,则溶液显
,则溶液显 的电离常数
的电离常数
更新时间:2022-09-04 19:54:42
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为__________ 。
(2)同浓度CH3COO-、HCO 、CO
、CO 、ClO-结合H+的能力由强到弱的顺序为
、ClO-结合H+的能力由强到弱的顺序为__________ 。
(3)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:_______ 。
(4)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,填写下列表达式中的数据变化情况(填“变大”、“变小”或“不变”)
①
______ ; ②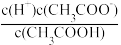
______ ;
③
_______ ; ④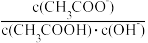
_______ 。
(5)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数______ (填“大于”、“等于”或“小于”)醋酸的电离平衡常数:理由是______ 。

| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为
(2)同浓度CH3COO-、HCO
 、CO
、CO 、ClO-结合H+的能力由强到弱的顺序为
、ClO-结合H+的能力由强到弱的顺序为(3)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:
(4)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,填写下列表达式中的数据变化情况(填“变大”、“变小”或“不变”)
①

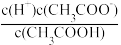
③

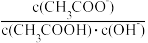
(5)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】25℃时,部分物质的电离平衡常数如下表所示:
(1)下列事实中能说明氢氰酸(HCN)是弱电解质的是___________(填字母)。
(2)在浓度均为0.1mol·L-1的H2C2O4和H2SO3混合溶液中,逐滴加入0.1mol·L-1的NaOH溶液,被先消耗的酸式酸根是___________ (填“HC2O ”或“
”或“ ”)。
”)。
(3)现有pH相同的盐酸、氢氰酸和次氯酸溶液,分别中和等物质的量的NaOH溶液时,需上述三种酸的体积依次是V1L、V2L、V3L、则V1、V2、V3,由大到小的顺序为___________ 。
(4)将少量SO2通入NaClO溶液中,发生反应的离子方程式为___________ 。
(5)常温下,向浓度为0.1mol·L-1、体积为VL的氨水中逐滴加入一定浓度的盐酸,测得溶液的pH随盐酸的加入量发生变化的曲线如图所示,d点时两种溶液恰好完全反应。

①该温度下,a、c、d三点对应溶液中,水的电离程度由大到小的顺序为___________ 。
②由b→c点过程中,下列各项数值保持不变的是___________ (填字母)。
A.c(H+)·c(OH-) B.
C. D.
D.
| 物质 | HCN | HClO | H2C2O4 | H2SO3 | NH3·H2O |
| 电离常数 | 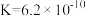 | 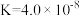 | 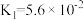 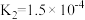 | 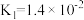 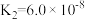 | 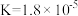 |
(1)下列事实中能说明氢氰酸(HCN)是弱电解质的是___________(填字母)。
| A.0.1mol·L-1的HCN溶液pH=2 |
| B.用HCN溶液做导电试验,灯泡很暗 |
| C.升高温度,HCN溶液的酸性明显增强 |
| D.10mL0.1mol·L-1的HCN溶液恰好与10mL0.1mol·L-1的NaOH溶液完全反应 |
 ”或“
”或“ ”)。
”)。(3)现有pH相同的盐酸、氢氰酸和次氯酸溶液,分别中和等物质的量的NaOH溶液时,需上述三种酸的体积依次是V1L、V2L、V3L、则V1、V2、V3,由大到小的顺序为
(4)将少量SO2通入NaClO溶液中,发生反应的离子方程式为
(5)常温下,向浓度为0.1mol·L-1、体积为VL的氨水中逐滴加入一定浓度的盐酸,测得溶液的pH随盐酸的加入量发生变化的曲线如图所示,d点时两种溶液恰好完全反应。

①该温度下,a、c、d三点对应溶液中,水的电离程度由大到小的顺序为
②由b→c点过程中,下列各项数值保持不变的是
A.c(H+)·c(OH-) B.

C.
 D.
D.
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】某酸HX是一元弱酸,25℃时的电离平衡常数K a= 4.0×10—8。
(1)写出该酸的电离方程式_____________ ,其电离平衡常数表达式K a =_______ 。
(2)25℃时,向1 mol·L-1 HX 溶液中加入1 mol·L-1 盐酸,会________ (“抑制”或“促进”)HX的电离,c(H+)____________ (填“增大”、“减小”或“不变”), 电离平衡常数K a ________ (填“增大”、“减小”或“不变”)。
(3)25℃时,若HX的起始浓度为0.01 mol·L-1,则平衡时c(H+)=_________ mol/L, 由水电离的出的c(H+)=___________ mol/L。
(1)写出该酸的电离方程式
(2)25℃时,向1 mol·L-1 HX 溶液中加入1 mol·L-1 盐酸,会
(3)25℃时,若HX的起始浓度为0.01 mol·L-1,则平衡时c(H+)=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】研究电解质在水溶液中的平衡能了解它的存在形式。
I.食醋(约含 的
的 )、纯碱(
)、纯碱( )和84消毒液(主要成分为
)和84消毒液(主要成分为 )是生活中常见的化学用品,回答下列问题:
)是生活中常见的化学用品,回答下列问题:
(1)醋酸( )属于
)属于_______ 电解质(填“强”“弱”或“非”),在84消毒液中加入少量食醋可以增强其杀菌、消毒的能力,请用离子方程式表示其原因______________ 。
(2)用离子方程式表示纯碱溶液呈碱性的原因______________ 。
(3)将少量纯碱溶液滴入醋酸溶液中,溶液中 的值变化趋势为
的值变化趋势为_______ (填“增大”、“减小”或“不变”)。
(4)常温下, 的醋酸溶液与
的醋酸溶液与 的纯碱溶液中,水电离出的
的纯碱溶液中,水电离出的 之比为
之比为_______ 。
Ⅱ.已知 时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(5)物质的量浓度均为 的下列四种溶液:
的下列四种溶液: 由小到大排列的顺序是
由小到大排列的顺序是________ 。
a. b.
b. c.
c. d.
d.
(6)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:___________ 。
(7) 时,将
时,将 的醋酸溶液与
的醋酸溶液与 氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
_______ (用含a、b的代数式表示)。
(8)标准状况下将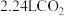 ,通入
,通入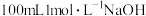 溶液中,用溶液甲微粒的浓度符号完成下列等式:
溶液中,用溶液甲微粒的浓度符号完成下列等式: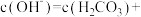
______________ 。
(9) ,氨水的浓度为
,氨水的浓度为 ,溶液中的
,溶液中的
_______  。
。
I.食醋(约含
 的
的 )、纯碱(
)、纯碱( )和84消毒液(主要成分为
)和84消毒液(主要成分为 )是生活中常见的化学用品,回答下列问题:
)是生活中常见的化学用品,回答下列问题:(1)醋酸(
 )属于
)属于(2)用离子方程式表示纯碱溶液呈碱性的原因
(3)将少量纯碱溶液滴入醋酸溶液中,溶液中
 的值变化趋势为
的值变化趋势为(4)常温下,
 的醋酸溶液与
的醋酸溶液与 的纯碱溶液中,水电离出的
的纯碱溶液中,水电离出的 之比为
之比为Ⅱ.已知
 时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:化学式 |
|
|
|
|
电离平衡常数 |
|
|
|
|
 的下列四种溶液:
的下列四种溶液: 由小到大排列的顺序是
由小到大排列的顺序是a.
 b.
b. c.
c. d.
d.
(6)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:
(7)
 时,将
时,将 的醋酸溶液与
的醋酸溶液与 氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
(8)标准状况下将
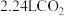 ,通入
,通入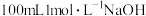 溶液中,用溶液甲微粒的浓度符号完成下列等式:
溶液中,用溶液甲微粒的浓度符号完成下列等式: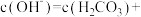
(9)
 ,氨水的浓度为
,氨水的浓度为 ,溶液中的
,溶液中的
 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】已知H2C2O4的电离平衡常数Ka1=5×10-2,Ka2=5×10-5,请回答下列问题:
(1)将10mL0.1mol/L的H2C2O4溶液加蒸馏水稀释到100mL后,下列变化中正确的有__ 。
①稀释前后溶液中c(H+)之比小于10
②溶液中所有离子浓度下降
③ 不变
不变
(2)下列溶液一定呈中性的是____
A.pH=7 B. =10-14 C.c(H+)=
=10-14 C.c(H+)=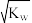
D.H2C2O4和K2C2O4的混合溶液中c(K+)=c(HC2O4-)+2c(C2O42-)
(3)草酸亚铁晶体(FeC2O4.xH2O)为淡黄色粉末,不溶于水,可作照相显影剂和用于制药工业。某化学兴趣小组称取yg样品,加入适量稀硫酸溶解,用0.1mol/L的酸性KMnO4溶液滴定测定x的值,发生的反应为Fe2++C2O42-+MnO4-→Fe3++CO2+Mn2+(未配平),滴定终点的现象为__ ,若滴定终点消耗20.00mLKMnO4溶液,则x=__ (用含y的式子表示)。
(4)已知:亚硝酸(HNO2)性质和硝酸类似,常温下亚硝酸的电离平衡常数Ka=5.1×10-4。在该温度下向含有1mol草酸钠的溶液中加入2mol的亚硝酸,溶液中所发生反应的离子反应方程式为___ 。
(5)T℃时,向某浓度的草酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中三种微粒H2C2O4、HC2O4- 、C2O42-的物质的量分数(δ)与pH的关系如图所示:则A点对应的pH为__ 。

(1)将10mL0.1mol/L的H2C2O4溶液加蒸馏水稀释到100mL后,下列变化中正确的有
①稀释前后溶液中c(H+)之比小于10
②溶液中所有离子浓度下降
③
 不变
不变(2)下列溶液一定呈中性的是
A.pH=7 B.
 =10-14 C.c(H+)=
=10-14 C.c(H+)=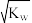
D.H2C2O4和K2C2O4的混合溶液中c(K+)=c(HC2O4-)+2c(C2O42-)
(3)草酸亚铁晶体(FeC2O4.xH2O)为淡黄色粉末,不溶于水,可作照相显影剂和用于制药工业。某化学兴趣小组称取yg样品,加入适量稀硫酸溶解,用0.1mol/L的酸性KMnO4溶液滴定测定x的值,发生的反应为Fe2++C2O42-+MnO4-→Fe3++CO2+Mn2+(未配平),滴定终点的现象为
(4)已知:亚硝酸(HNO2)性质和硝酸类似,常温下亚硝酸的电离平衡常数Ka=5.1×10-4。在该温度下向含有1mol草酸钠的溶液中加入2mol的亚硝酸,溶液中所发生反应的离子反应方程式为
(5)T℃时,向某浓度的草酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中三种微粒H2C2O4、HC2O4- 、C2O42-的物质的量分数(δ)与pH的关系如图所示:则A点对应的pH为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】乙二酸( 或HOOCCOOH)俗称草酸,是一种二元弱酸,在工业上可作漂白剂、鞣革剂,在实验研究和化学工业中应用广泛。
或HOOCCOOH)俗称草酸,是一种二元弱酸,在工业上可作漂白剂、鞣革剂,在实验研究和化学工业中应用广泛。
(1)草酸第一步电离的电离方程式为___________________________ 。
(2)草酸可用来测定未知浓度的 溶液(用草酸滴定
溶液(用草酸滴定 溶液)。
溶液)。
①实验过程中,草酸应用___________ (填“酸式”或“碱式”)滴定管盛装。
②判断达到滴定终点时的现象为_______________________________________________________ 。
③若滴定完成后仰视读数,则测得的 溶液浓度
溶液浓度___________ (“偏高”、“偏低”或“无影响”)。
(3)常温下,草酸溶液中微粒的物质的量分数随溶液pH的变化如图所示:
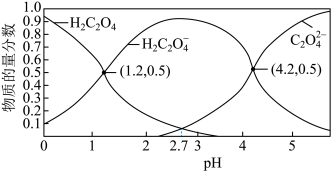
已知:常温下, 的电离平衡常数
的电离平衡常数 ,
, 。
。
①常温下,草酸的电离平衡常数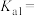
___________ 。
②相同条件下,物质的量浓度均为0.1 的
的 溶液的pH比
溶液的pH比 溶液的pH
溶液的pH__________ (填“大”或“小”)。
③常温下,向10mL 0.1
 溶液中逐滴加入0.1
溶液中逐滴加入0.1 KOH溶液,随着KOH溶液体积的增加,当溶液中
KOH溶液,随着KOH溶液体积的增加,当溶液中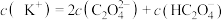 时,加入的V(KOH溶液)
时,加入的V(KOH溶液)___________ (填“>”、“=”或“<”)10mL,若加入KOH溶液体积为10mL溶液中 、
、 、
、 的浓度由大到小的顺序为
的浓度由大到小的顺序为________________________ 。
 或HOOCCOOH)俗称草酸,是一种二元弱酸,在工业上可作漂白剂、鞣革剂,在实验研究和化学工业中应用广泛。
或HOOCCOOH)俗称草酸,是一种二元弱酸,在工业上可作漂白剂、鞣革剂,在实验研究和化学工业中应用广泛。(1)草酸第一步电离的电离方程式为
(2)草酸可用来测定未知浓度的
 溶液(用草酸滴定
溶液(用草酸滴定 溶液)。
溶液)。①实验过程中,草酸应用
②判断达到滴定终点时的现象为
③若滴定完成后仰视读数,则测得的
 溶液浓度
溶液浓度(3)常温下,草酸溶液中微粒的物质的量分数随溶液pH的变化如图所示:

已知:常温下,
 的电离平衡常数
的电离平衡常数 ,
, 。
。①常温下,草酸的电离平衡常数
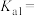
②相同条件下,物质的量浓度均为0.1
 的
的 溶液的pH比
溶液的pH比 溶液的pH
溶液的pH③常温下,向10mL 0.1

 溶液中逐滴加入0.1
溶液中逐滴加入0.1 KOH溶液,随着KOH溶液体积的增加,当溶液中
KOH溶液,随着KOH溶液体积的增加,当溶液中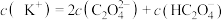 时,加入的V(KOH溶液)
时,加入的V(KOH溶液) 、
、 、
、 的浓度由大到小的顺序为
的浓度由大到小的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】已知25℃时:H2CO3:Ka1=4.5×10-7、Ka2=4.7×10-11;HClO:Ka=4.0×10-8、lg2=0.3;Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=2.6×10-9。
(1)0.4 mol/LHClO溶液的pH=_______ 。
(2)0.4 mol/LNaClO溶液的pH=_______ 。向该溶液中通入少量CO2,发生反应的离子方程式为_______ 。
(3)1.0 L水中投入0.1 mol BaSO4,得到BaSO4的悬浊液,向该悬浊液中投入Na2CO3固体使BaSO4全部转化为BaCO3,理论上需Na2CO3_______ mol(忽略过程中溶液体积的变化)。
(1)0.4 mol/LHClO溶液的pH=
(2)0.4 mol/LNaClO溶液的pH=
(3)1.0 L水中投入0.1 mol BaSO4,得到BaSO4的悬浊液,向该悬浊液中投入Na2CO3固体使BaSO4全部转化为BaCO3,理论上需Na2CO3
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】平衡常数
盐是一类常见的电解质,实验表明盐溶液不一定呈中性,也可能呈酸性和碱性。
(1) 、
、 、
、 的水溶液分别呈
的水溶液分别呈___________ 性、___________ 性、___________ 性。水的电离平衡常数K电离=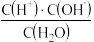 ,则c(H+)·c(OH-)=K电离·c(H2O)。从实验可知,在室温时55.6mol纯水中只有1×10-7molH2O电离,电离前后H2O的物质的量几乎不变,因此c(H2O)可视为常数,K电离也为一常数,所以K电离·c(H2O)必然也为常数,用Kw表示,因此有c(H+)·c(OH-)=Kw。
,则c(H+)·c(OH-)=K电离·c(H2O)。从实验可知,在室温时55.6mol纯水中只有1×10-7molH2O电离,电离前后H2O的物质的量几乎不变,因此c(H2O)可视为常数,K电离也为一常数,所以K电离·c(H2O)必然也为常数,用Kw表示,因此有c(H+)·c(OH-)=Kw。
(2)25℃时,c(H+)=c(OH-)=___________ mol/L;KW=c(H+)·c(OH-)=___________
(3)Kw的影响因素,水的离子积Kw,只受___________ 的影响,___________ ,Kw增大。
(4)25℃时,H2SO3 HSO
HSO +H+的电离常数Ka=1×10-2molL,则该温度下NaHSO3的水解平衡常数Kh=
+H+的电离常数Ka=1×10-2molL,则该温度下NaHSO3的水解平衡常数Kh=___________ mol/L。
盐是一类常见的电解质,实验表明盐溶液不一定呈中性,也可能呈酸性和碱性。
(1)
 、
、 、
、 的水溶液分别呈
的水溶液分别呈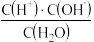 ,则c(H+)·c(OH-)=K电离·c(H2O)。从实验可知,在室温时55.6mol纯水中只有1×10-7molH2O电离,电离前后H2O的物质的量几乎不变,因此c(H2O)可视为常数,K电离也为一常数,所以K电离·c(H2O)必然也为常数,用Kw表示,因此有c(H+)·c(OH-)=Kw。
,则c(H+)·c(OH-)=K电离·c(H2O)。从实验可知,在室温时55.6mol纯水中只有1×10-7molH2O电离,电离前后H2O的物质的量几乎不变,因此c(H2O)可视为常数,K电离也为一常数,所以K电离·c(H2O)必然也为常数,用Kw表示,因此有c(H+)·c(OH-)=Kw。(2)25℃时,c(H+)=c(OH-)=
(3)Kw的影响因素,水的离子积Kw,只受
(4)25℃时,H2SO3
 HSO
HSO +H+的电离常数Ka=1×10-2molL,则该温度下NaHSO3的水解平衡常数Kh=
+H+的电离常数Ka=1×10-2molL,则该温度下NaHSO3的水解平衡常数Kh=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】碳酸钙常用作牙膏的摩擦剂。某同学设计了一种制备碳酸钙的方案,其流程图如下。(所用石灰石含有杂质SiO2)

回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨,则石灰石中碳酸钙的质量分数为______ %。
(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶液性滤渣的成分为___________ 。
(3)第③步反应一般不采用通入CO2的主要原因是_____________ ,相应的离子方程式为_______________ 。
(4)CaCO3是一种难溶液物质,25℃时其Ksp=2.8×10-9。现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是________________ 。
(5)某生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下:

与前一方案相比较,该方案的优点是_______________ 。

回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨,则石灰石中碳酸钙的质量分数为
(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶液性滤渣的成分为
(3)第③步反应一般不采用通入CO2的主要原因是
(4)CaCO3是一种难溶液物质,25℃时其Ksp=2.8×10-9。现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是
(5)某生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下:

与前一方案相比较,该方案的优点是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】常温下,几种物质的溶度积常数如表所示:
回答下列问题:
(1)常温下,某酸性 溶液中含少量的
溶液中含少量的 ,为制得纯净
,为制得纯净 溶液,宜加入
溶液,宜加入 调至溶液
调至溶液 ,使
,使 转化为
转化为 沉淀,此时溶液中
沉淀,此时溶液中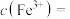
_______ 。
(2)过滤后,将所得滤液经过_______ 、过滤、洗涤、干燥,可得到 晶体。
晶体。
(3)由 晶体得到纯的无水
晶体得到纯的无水 ,需要进行的操作是
,需要进行的操作是_______ 。
(4)某学习小组用“间接碘量法”测定含有 晶体试样(不含能与
晶体试样(不含能与 发生反应的氧化性杂质)的纯度,过程如下:取
发生反应的氧化性杂质)的纯度,过程如下:取 试样溶于水,加入过量KI固体充分反应,生成白色沉淀CuI,向溶液中加少量淀粉溶液,用
试样溶于水,加入过量KI固体充分反应,生成白色沉淀CuI,向溶液中加少量淀粉溶液,用 标准溶液滴定,达到滴定终点时,消耗
标准溶液滴定,达到滴定终点时,消耗 标准溶液
标准溶液 (已知:
(已知: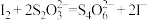 )。
)。
①达到滴定终点的现象是_______ 。
② 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为_______ 。
③该试样中 的质量分数为
的质量分数为_______ 。
| 物质 |  |  |  |  |
 | 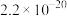 |  |  |  |
(1)常温下,某酸性
 溶液中含少量的
溶液中含少量的 ,为制得纯净
,为制得纯净 溶液,宜加入
溶液,宜加入 调至溶液
调至溶液 ,使
,使 转化为
转化为 沉淀,此时溶液中
沉淀,此时溶液中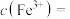
(2)过滤后,将所得滤液经过
 晶体。
晶体。(3)由
 晶体得到纯的无水
晶体得到纯的无水 ,需要进行的操作是
,需要进行的操作是(4)某学习小组用“间接碘量法”测定含有
 晶体试样(不含能与
晶体试样(不含能与 发生反应的氧化性杂质)的纯度,过程如下:取
发生反应的氧化性杂质)的纯度,过程如下:取 试样溶于水,加入过量KI固体充分反应,生成白色沉淀CuI,向溶液中加少量淀粉溶液,用
试样溶于水,加入过量KI固体充分反应,生成白色沉淀CuI,向溶液中加少量淀粉溶液,用 标准溶液滴定,达到滴定终点时,消耗
标准溶液滴定,达到滴定终点时,消耗 标准溶液
标准溶液 (已知:
(已知: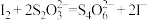 )。
)。①达到滴定终点的现象是
②
 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为③该试样中
 的质量分数为
的质量分数为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】电解质在水溶液中存在各种行为,如电离、水解、沉淀溶解等,据所学知识回答下列问题:
(1)t℃时,纯水中c(H+)=1×10-6 mol·L-1,则该温度下水的离子积常数KW=_______ ;该温度下,pH=10的Ba(OH)2溶液的物质的量浓度为_________ 。
(2)25℃时,相同物质的量浓度的下列溶液中:①NaCl ②NaOH ③H2SO4 ④(NH4)2SO4,其中水的电离程度由大到小顺序为______ (用序号回答)。
(3)25℃时,将 a mol·L-1 的醋酸和 b mol·L-1 的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=__________ ,则a_______ b(填“﹥”、“﹤”或“=”)。
(4)将AgCl分别放入:①5 mL水 ②10 mL 0.1 mol·L-1 MgCl2溶液 ③20 mL 0.5 mol·L-1 NaCl溶液 ④40 mL 0.3mol·L-1 盐酸溶液中溶解至溶液饱和,各溶液中Ag+的浓度分别为a、b、 c、d,它们由大到小的排列顺序是_____ (用字母表示)。
(1)t℃时,纯水中c(H+)=1×10-6 mol·L-1,则该温度下水的离子积常数KW=
(2)25℃时,相同物质的量浓度的下列溶液中:①NaCl ②NaOH ③H2SO4 ④(NH4)2SO4,其中水的电离程度由大到小顺序为
(3)25℃时,将 a mol·L-1 的醋酸和 b mol·L-1 的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=
(4)将AgCl分别放入:①5 mL水 ②10 mL 0.1 mol·L-1 MgCl2溶液 ③20 mL 0.5 mol·L-1 NaCl溶液 ④40 mL 0.3mol·L-1 盐酸溶液中溶解至溶液饱和,各溶液中Ag+的浓度分别为a、b、 c、d,它们由大到小的排列顺序是
您最近一年使用:0次