名校
解题方法
1 . 用氨水吸收 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
___________ 。(已知: 时,电离常数
时,电离常数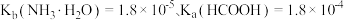 )
)
 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
 时,电离常数
时,电离常数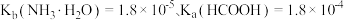 )
)
您最近一年使用:0次
2 . 肼在水溶液中为二元弱碱,在水中的电离方式与氨相似。常温下,向0.1mol·L-1肼溶液中,滴加稀盐酸调节pH。溶液中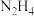 、
、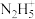 、
、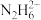 占含氮物种的物质的量分数为
占含氮物种的物质的量分数为 (如
(如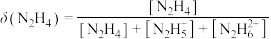 ),
), 随溶液pH变化的曲线如下图所示:
随溶液pH变化的曲线如下图所示:
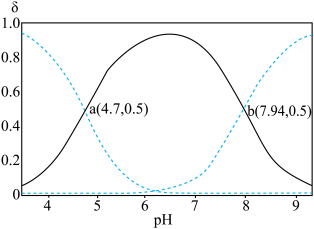
(1)常温下中性溶液中,各含氮物种的浓度大小关系为______________。
(2)室温时,反应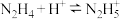 平衡常数K的数值为_____________。
平衡常数K的数值为_____________。
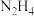 、
、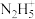 、
、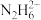 占含氮物种的物质的量分数为
占含氮物种的物质的量分数为 (如
(如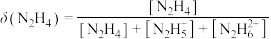 ),
), 随溶液pH变化的曲线如下图所示:
随溶液pH变化的曲线如下图所示:
(1)常温下中性溶液中,各含氮物种的浓度大小关系为______________。
A.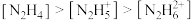 | B.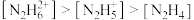 |
C.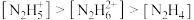 | D.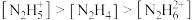 |
(2)室温时,反应
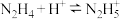 平衡常数K的数值为_____________。
平衡常数K的数值为_____________。A.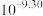 | B.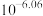 | C. | D.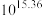 |
您最近一年使用:0次
3 . 据报道,我国科学家利用镓锡氧化物电催化还原CO2制得高附加值的草酸(H2C2O4)。
已知:草酸溶液中含碳微粒的分布系数(某微粒物质的量浓度与三种微粒物质的量浓度和的比值)与pH的关系如下图所示【比如 的分布系数:
的分布系数: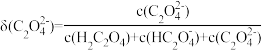 】:
】:_____ 2c( )(选填“>”、“=”、“<”),解释原因:
)(选填“>”、“=”、“<”),解释原因:_____ 。
(2)用NaOH溶液滴定未知浓度的H2C2O4溶液,下列说法正确的是_____。
(3)根据题中有关信息,当溶液pH=5时,列式计算溶液中 =
=_____ 。
已知:草酸溶液中含碳微粒的分布系数(某微粒物质的量浓度与三种微粒物质的量浓度和的比值)与pH的关系如下图所示【比如
 的分布系数:
的分布系数: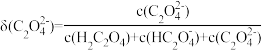 】:
】:
 )(选填“>”、“=”、“<”),解释原因:
)(选填“>”、“=”、“<”),解释原因:(2)用NaOH溶液滴定未知浓度的H2C2O4溶液,下列说法正确的是_____。
A.滴定过程中存在:c( )+c( )+c( )+c(OH—)= c(H+)+ c(Na+) )+c(OH—)= c(H+)+ c(Na+) |
B.在NaHC2O4溶液中c( )<c(H2C2O4) )<c(H2C2O4) |
C.在NaHC2O4溶液中c(Na+)= c( )+c( )+c( ) +2 c(H2C2O4) ) +2 c(H2C2O4) |
| D.向pH=1.2的反应混合液中加NaOH溶液至a点过程中,水的电离度一直增大 |
 =
=
您最近一年使用:0次
4 . 钠碱法的启动吸收剂为NaOH溶液,捕捉SO2后生成Na2SO3和NaHSO3的混合液。
(1)常温下进行“钠碱法”的模拟实验。用12gNaOH固体配成一定浓度的溶液,这些NaOH理论上最多可吸收SO2的体积约为______ L(折算成标准状况)。若实验时只吸收了0.10molSO2,则反应后的吸收液中,所含负离子的浓度由大到小的顺序为______ 。
(2)当钠碱法的吸收液pH达到4~6时,混合液中含较多量NaHSO3.加热该溶液可回收得到较高纯度的SO2,剩余溶液可循环使用,进一步吸收SO2,剩余溶液的主要溶质是______ (填写化学式)。
(3)将SO2通入NaOH溶液时,得到一组c(H2SO3)+c(HSO )+c(SO
)+c(SO )=0.100mol·L-1的混合溶液,溶液中部分微粒的物质的量浓度随pH的关系曲线如下图所示。
)=0.100mol·L-1的混合溶液,溶液中部分微粒的物质的量浓度随pH的关系曲线如下图所示。
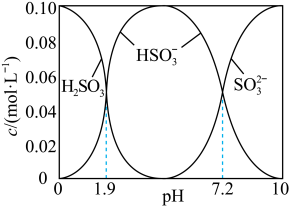
若溶液的pH=7,溶液中c(Na+)=c( )+
)+______ ,此时溶液中c(Na+)______ 0.100mol·L-1.(选填“>”、“<”或“=”)
(4)上述混合液中存在多个水解平衡,与化学平衡一样,水解平衡也有自己的平衡常数(Kh)。以醋酸钠(CH3COONa)为例,其水解平衡常数存在以下定量关系:Kh=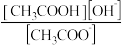
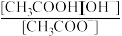 =
=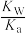 (Kw为水的离子积常数,Ka为CH3COOH的电离常数)亚硫酸为二元弱酸,25℃时,其电离常数Ka1=1.54×10-2,Ka2=1.02×10-7。请结合相关数据说明NaHSO3溶液呈酸性的理由。
(Kw为水的离子积常数,Ka为CH3COOH的电离常数)亚硫酸为二元弱酸,25℃时,其电离常数Ka1=1.54×10-2,Ka2=1.02×10-7。请结合相关数据说明NaHSO3溶液呈酸性的理由。______ 。
(5)“钙碱法”的工作原理与“钠碱法”相似,一般选择消石灰的悬浊液为SO2吸收剂。请对照“钠碱法”,尝试通过比较反应物和生成物的不同性质,从生产成本和设备维护两方面对“钙碱法”做出评价______ 。
(1)常温下进行“钠碱法”的模拟实验。用12gNaOH固体配成一定浓度的溶液,这些NaOH理论上最多可吸收SO2的体积约为
(2)当钠碱法的吸收液pH达到4~6时,混合液中含较多量NaHSO3.加热该溶液可回收得到较高纯度的SO2,剩余溶液可循环使用,进一步吸收SO2,剩余溶液的主要溶质是
(3)将SO2通入NaOH溶液时,得到一组c(H2SO3)+c(HSO
 )+c(SO
)+c(SO )=0.100mol·L-1的混合溶液,溶液中部分微粒的物质的量浓度随pH的关系曲线如下图所示。
)=0.100mol·L-1的混合溶液,溶液中部分微粒的物质的量浓度随pH的关系曲线如下图所示。
若溶液的pH=7,溶液中c(Na+)=c(
 )+
)+(4)上述混合液中存在多个水解平衡,与化学平衡一样,水解平衡也有自己的平衡常数(Kh)。以醋酸钠(CH3COONa)为例,其水解平衡常数存在以下定量关系:Kh=
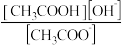
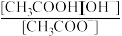 =
=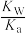 (Kw为水的离子积常数,Ka为CH3COOH的电离常数)亚硫酸为二元弱酸,25℃时,其电离常数Ka1=1.54×10-2,Ka2=1.02×10-7。请结合相关数据说明NaHSO3溶液呈酸性的理由。
(Kw为水的离子积常数,Ka为CH3COOH的电离常数)亚硫酸为二元弱酸,25℃时,其电离常数Ka1=1.54×10-2,Ka2=1.02×10-7。请结合相关数据说明NaHSO3溶液呈酸性的理由。(5)“钙碱法”的工作原理与“钠碱法”相似,一般选择消石灰的悬浊液为SO2吸收剂。请对照“钠碱法”,尝试通过比较反应物和生成物的不同性质,从生产成本和设备维护两方面对“钙碱法”做出评价
您最近一年使用:0次
名校
解题方法
5 . 燃料燃烧产生的二氧化碳有多种捕捉方式,在自然界中存在着二氧化碳气体与其他物质的反应过程,而实验室中一般使用碱溶液来吸收二氧化碳气体。
(1)向1L 1 的NaOH溶液中通入0.5mol二氧化碳气体,最终所得溶液中各离子浓度关系正确的选项有(假设溶液体积不发生变化):___________。
的NaOH溶液中通入0.5mol二氧化碳气体,最终所得溶液中各离子浓度关系正确的选项有(假设溶液体积不发生变化):___________。
(2)已知:25℃时,① 的电离平衡常数
的电离平衡常数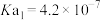 ,
,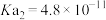 。
。
②盐类水解常数 可以表示盐溶液水解平衡的限度,书写方式与电离平衡常数一致。
可以表示盐溶液水解平衡的限度,书写方式与电离平衡常数一致。
写出 溶液中
溶液中 水解的平衡常数的表达式,并根据上述数据计算出
水解的平衡常数的表达式,并根据上述数据计算出 的数值:
的数值:
___________ (表达式)=___________ (数值)。
(3)根据 的
的 数值和
数值和 电离平衡常数的数值,判断至下
电离平衡常数的数值,判断至下 溶液的酸碱性,并结合适当的化学语言说明理由:
溶液的酸碱性,并结合适当的化学语言说明理由:___________ 。
(1)向1L 1
 的NaOH溶液中通入0.5mol二氧化碳气体,最终所得溶液中各离子浓度关系正确的选项有(假设溶液体积不发生变化):___________。
的NaOH溶液中通入0.5mol二氧化碳气体,最终所得溶液中各离子浓度关系正确的选项有(假设溶液体积不发生变化):___________。A.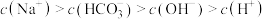 |
B.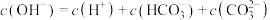 |
C.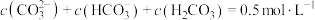 |
D. |
 的电离平衡常数
的电离平衡常数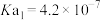 ,
,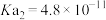 。
。②盐类水解常数
 可以表示盐溶液水解平衡的限度,书写方式与电离平衡常数一致。
可以表示盐溶液水解平衡的限度,书写方式与电离平衡常数一致。写出
 溶液中
溶液中 水解的平衡常数的表达式,并根据上述数据计算出
水解的平衡常数的表达式,并根据上述数据计算出 的数值:
的数值:
(3)根据
 的
的 数值和
数值和 电离平衡常数的数值,判断至下
电离平衡常数的数值,判断至下 溶液的酸碱性,并结合适当的化学语言说明理由:
溶液的酸碱性,并结合适当的化学语言说明理由:
您最近一年使用:0次
名校
解题方法
6 . 常温下,向1mol•L-1NH4Cl溶液中加入足量的镁条,该体系pH随时间变化的曲线如图所示。验观察到b点开始溶液中有白色沉淀生成,已知Ksp[Mg(OH)2]=1.8×10-11。下列说法错误的是


| A.常温下,NH4Cl的水解平衡常数数量级为10-10 |
| B.体系中,水的电离程度大小关系为a>c>b |
| C.b点时,溶液中c(Mg2+)=0.18mol∙L-1 |
D.a点溶液中,c( )+c(H+)<c(Cl-)+c(OH-) )+c(H+)<c(Cl-)+c(OH-) |
您最近一年使用:0次
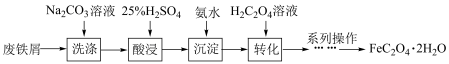
7 . 草酸亚铁 作为一种化工原料,可广泛用于生产锂离子电池材料、感光材料。以废铁屑为原料生产草酸亚铁的流程如下:
作为一种化工原料,可广泛用于生产锂离子电池材料、感光材料。以废铁屑为原料生产草酸亚铁的流程如下:
Ⅰ、 为淡黄色固体,难溶于水。
为淡黄色固体,难溶于水。
Ⅱ、25℃时,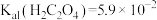 、
、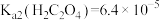 。
。
Ⅲ、25℃时,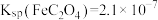 、
、 。
。
(1)用热的饱和碳酸钠溶液洗涤废铁屑的原因是_____ 。
(2)由题中信息判断,25℃时,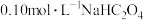 溶液中存在:
溶液中存在: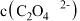
_____  (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。
(3)“转化”步骤在如图所示的装置中进行。

仪器X的名称是_____ ,导管A的作用是_____ 。
(4)“转化”步骤的离子方程式为_____。
(5)说明“转化”步骤中不能用 溶液代替
溶液代替 溶液的原因
溶液的原因_____ 。
(6)流程图中“系列操作”指的是_____ 。
A.过滤、洗涤、干燥
B.蒸发结晶、趁热过滤、洗涤、干燥
C.蒸发浓缩、冷却结晶、过滤、洗涤、干燥
上述制备的草酸亚铁晶体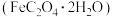 含有
含有 杂质,测定其纯度步骤如下:
杂质,测定其纯度步骤如下:
①准确称取 草酸亚铁晶体样品,溶于稀硫酸中,配成100mL溶液。
草酸亚铁晶体样品,溶于稀硫酸中,配成100mL溶液。
②取20.00mL①中所得的溶液,用 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 。
。
③向滴定后的溶液中加入适量锌粉充分反应后,过滤,洗涤,洗涤液并入滤液中。
④继续用 标准溶液滴定步骤③中所得滤液至终点,消耗
标准溶液滴定步骤③中所得滤液至终点,消耗 。
。
已知:
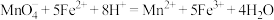
(7)配制上述100mL溶液,用到的玻璃仪器除了玻璃棒、烧杯外,还有_____ 。
(8)步骤②滴定终点的现象为_____ ;步骤③中加入锌粉的目的是_____ 。
(9)草酸亚铁晶体样品的纯度为_____ 。(用 、
、 、
、 、
、 表示)
表示)
 作为一种化工原料,可广泛用于生产锂离子电池材料、感光材料。以废铁屑为原料生产草酸亚铁的流程如下:
作为一种化工原料,可广泛用于生产锂离子电池材料、感光材料。以废铁屑为原料生产草酸亚铁的流程如下:
Ⅰ、
 为淡黄色固体,难溶于水。
为淡黄色固体,难溶于水。Ⅱ、25℃时,
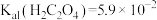 、
、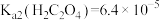 。
。Ⅲ、25℃时,
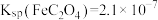 、
、 。
。(1)用热的饱和碳酸钠溶液洗涤废铁屑的原因是
(2)由题中信息判断,25℃时,
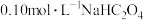 溶液中存在:
溶液中存在: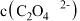
 (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。(3)“转化”步骤在如图所示的装置中进行。

仪器X的名称是
(4)“转化”步骤的离子方程式为_____。
A.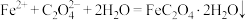 |
B.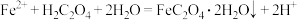 |
C.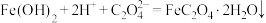 |
D.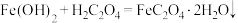 |
(5)说明“转化”步骤中不能用
 溶液代替
溶液代替 溶液的原因
溶液的原因(6)流程图中“系列操作”指的是
A.过滤、洗涤、干燥
B.蒸发结晶、趁热过滤、洗涤、干燥
C.蒸发浓缩、冷却结晶、过滤、洗涤、干燥
上述制备的草酸亚铁晶体
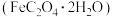 含有
含有 杂质,测定其纯度步骤如下:
杂质,测定其纯度步骤如下:①准确称取
 草酸亚铁晶体样品,溶于稀硫酸中,配成100mL溶液。
草酸亚铁晶体样品,溶于稀硫酸中,配成100mL溶液。②取20.00mL①中所得的溶液,用
 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 。
。③向滴定后的溶液中加入适量锌粉充分反应后,过滤,洗涤,洗涤液并入滤液中。
④继续用
 标准溶液滴定步骤③中所得滤液至终点,消耗
标准溶液滴定步骤③中所得滤液至终点,消耗 。
。已知:

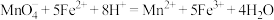
(7)配制上述100mL溶液,用到的玻璃仪器除了玻璃棒、烧杯外,还有
(8)步骤②滴定终点的现象为
(9)草酸亚铁晶体样品的纯度为
 、
、 、
、 、
、 表示)
表示)
您最近一年使用:0次
名校
解题方法
8 . 许多含硫化合物在生产生活中有着重要的应用。
I.某学习小组为了探究铜丝与浓硫酸反应并验证其产物性质,设计了如下实验装置:

实验过程中的实验现象记录如下表:
(1)试管①中的白色固体是 ,请简述一种简单的验证方法:反应结束后,待装置冷却后,
,请简述一种简单的验证方法:反应结束后,待装置冷却后,_______ 。
(2)结合试管②中现象,试管①中产生的“白雾”的主要成分是_______ (填化学式);为避免“白雾”对后续实验产生干扰,可在试管①和试管②之间接入一个盛有_______ 的洗气装置(填序号)。
a.浓硫酸 b.饱和 溶液 c.饱和
溶液 c.饱和 溶液 d.碱石灰
溶液 d.碱石灰
(3)试管③中有少量白色沉淀产生的原因是_______ (请用方程式表示), 是工业尾气的主要成分之一,充分处理尾气可有效较少酸雨的形成。
是工业尾气的主要成分之一,充分处理尾气可有效较少酸雨的形成。
(4)工业上可以用 溶液或氨水吸收
溶液或氨水吸收 ,若
,若 过量,可分别生成
过量,可分别生成 、
、 ,其水溶液均呈酸性。
,其水溶液均呈酸性。
①相同条件下,同浓度的两种酸式盐的水溶液中 较小的是
较小的是_______ ,用文字和化学用语解释原因_______ 。
②若向 溶液中加入少量的
溶液中加入少量的 ,则溶液中
,则溶液中 将
将_______ (填“增大”“减小”或“不变”)。
③用 溶液吸收
溶液吸收 ,当吸收液呈中性时,溶液中离子浓度关系正确的是
,当吸收液呈中性时,溶液中离子浓度关系正确的是_______ (填字母)。
a.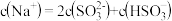
b.
c.
(5)向 溶液中缓慢通入
溶液中缓慢通入 和
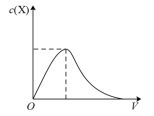
和 的混合气体至过量,反应过程中某微粒X的物质的量浓度随通入混合气体的体积(V)变化如图所示。该微粒X为
的混合气体至过量,反应过程中某微粒X的物质的量浓度随通入混合气体的体积(V)变化如图所示。该微粒X为_______ 。请写出X浓度刚刚开始下降的时候的离子方程式_______ 。
I.某学习小组为了探究铜丝与浓硫酸反应并验证其产物性质,设计了如下实验装置:

实验过程中的实验现象记录如下表:
| 试管 | ① | ② | ③ | ④ |
| 实验现象 | 溶液仍为无色,有白雾、白色固体产生 | 有大量白色沉淀产生 | 有少量白色沉淀产生 | 溶液褪色 |
 ,请简述一种简单的验证方法:反应结束后,待装置冷却后,
,请简述一种简单的验证方法:反应结束后,待装置冷却后,(2)结合试管②中现象,试管①中产生的“白雾”的主要成分是
a.浓硫酸 b.饱和
 溶液 c.饱和
溶液 c.饱和 溶液 d.碱石灰
溶液 d.碱石灰(3)试管③中有少量白色沉淀产生的原因是
 是工业尾气的主要成分之一,充分处理尾气可有效较少酸雨的形成。
是工业尾气的主要成分之一,充分处理尾气可有效较少酸雨的形成。(4)工业上可以用
 溶液或氨水吸收
溶液或氨水吸收 ,若
,若 过量,可分别生成
过量,可分别生成 、
、 ,其水溶液均呈酸性。
,其水溶液均呈酸性。①相同条件下,同浓度的两种酸式盐的水溶液中
 较小的是
较小的是②若向
 溶液中加入少量的
溶液中加入少量的 ,则溶液中
,则溶液中 将
将③用
 溶液吸收
溶液吸收 ,当吸收液呈中性时,溶液中离子浓度关系正确的是
,当吸收液呈中性时,溶液中离子浓度关系正确的是a.
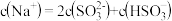
b.

c.

(5)向
 溶液中缓慢通入
溶液中缓慢通入 和
和 的混合气体至过量,反应过程中某微粒X的物质的量浓度随通入混合气体的体积(V)变化如图所示。该微粒X为
的混合气体至过量,反应过程中某微粒X的物质的量浓度随通入混合气体的体积(V)变化如图所示。该微粒X为
您最近一年使用:0次



