名校
解题方法
1 . X、Y、Z、M、W五种主族元素位于前四周期,原子序数依次增大,且这五种元素的最外层电子数之和为16。其中X、Y、Z、M为短周期主族元素,M的最外层电子数为Z的两倍,只有Y、M位于同一主族,且只有Z、M位于同一周期。
回答下列问题:
(1)X、Y、M的有关化学键键能如表所示,简要分析和解释下列有关事实:
①Y与M位于同一主族,但Y元素形成的物质种类远多于M元素形成的物质种类,原因为______ 。
②稳定性:YX4_____ (填“>”或“<”)MX4。
(2)由Y原子与M原子以1∶1的个数比相互交替结合形成晶体(Q)。则Q的化学式为______ 。
(3)在元素周期表中,某些主族元素与其右下方的主族元素的有些性质是相似的,这种相似性被称为对角线规则,在前三周期元素中,若元素R与元素Z是“对角关系”,则在加热条件下,单质R与氧气发生反应的化学方程式为______ 。
(4)常温下,X3WO4的电离平衡常数如表所示:
①请根据结构与性质的关系解释X3WO4第一步电离大于第二步电离的原因:______ 。_______ (lg2≈0.3)。
回答下列问题:
(1)X、Y、M的有关化学键键能如表所示,简要分析和解释下列有关事实:
| 化学键 | Y-Y | Y-X | M-M | M-X |
| 键能/(kJ•mol-1) | 356 | 413 | 226 | 318 |
②稳定性:YX4
(2)由Y原子与M原子以1∶1的个数比相互交替结合形成晶体(Q)。则Q的化学式为
(3)在元素周期表中,某些主族元素与其右下方的主族元素的有些性质是相似的,这种相似性被称为对角线规则,在前三周期元素中,若元素R与元素Z是“对角关系”,则在加热条件下,单质R与氧气发生反应的化学方程式为
(4)常温下,X3WO4的电离平衡常数如表所示:
| 电离平衡常数 | Ka1 | Ka2 | Ka3 |
| X3WO4 | 5×10-3 | 2×10-7 | 4.0×10-12 |
②已知磷酸的结构式为 ,请画出X3WO4分子的结构:
,请画出X3WO4分子的结构:
您最近一年使用:0次
2023-04-16更新
|
110次组卷
|
4卷引用:河南省周口市项城市五校联考2022-2023学年高二下学期4月月考化学试题
名校
2 . 回答下列问题:
(1)已知25℃时, 的
的 mol·L
mol·L ,则当溶液中
,则当溶液中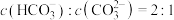 时,溶液的
时,溶液的
_______ 。
(2)0.1 mol·L
 溶液中
溶液中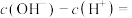
_______ (用含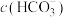 、
、 的关系式表示)。
的关系式表示)。
(3)向 溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式:
溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式:_______ 。
(4)用电解法将 转化为燃料是实现碳循环的一种途径,原理如图所示。铜电极上产生
转化为燃料是实现碳循环的一种途径,原理如图所示。铜电极上产生 的电极反应式为
的电极反应式为_______ ,若阴极只产生HCOOH,则相同条件下Pt电极产生的 与Cu电极上产生的HCOOH的物质的量之比为
与Cu电极上产生的HCOOH的物质的量之比为_______ 。

(1)已知25℃时,
 的
的 mol·L
mol·L ,则当溶液中
,则当溶液中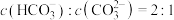 时,溶液的
时,溶液的
(2)0.1 mol·L

 溶液中
溶液中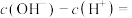
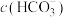 、
、 的关系式表示)。
的关系式表示)。(3)向
 溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式:
溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式:(4)用电解法将
 转化为燃料是实现碳循环的一种途径,原理如图所示。铜电极上产生
转化为燃料是实现碳循环的一种途径,原理如图所示。铜电极上产生 的电极反应式为
的电极反应式为 与Cu电极上产生的HCOOH的物质的量之比为
与Cu电极上产生的HCOOH的物质的量之比为
您最近一年使用:0次
解题方法
3 . 高中化学涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和沉淀溶解平衡等,它们在工农业生产中都有广泛的应用。请回答下列问题:
Ⅰ.化学平衡
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g) CO(NH2)2(1)+H2O(l)
CO(NH2)2(1)+H2O(l)
(1)将2 mol NH3和1 mol CO2投到一个温度恒定、体积恒定的容器中进行上述反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是_______ (填字母)。
a.2υ正(NH3) = υ逆(CO2)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d. CO2、NH3的体积分数均不再改变
(2)取一定量的NH3和CO2放在一个带活塞的密闭真空容器中在一定温度 下反应达平衡,若在恒温、恒压下充入气体He, CO(NH2)2(l)的质量_______ (填“增加”“减小”或“不变”)。
Ⅱ.电离平衡、水解平衡
(3)某温度下,纯水中c(H+)=2.0 ×10−7 mol∙L−1, 该温度下,0.09 mol∙L−1NaOH溶液与0.01 mol∙L−1 HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=_______ 。
(4)H2A是一种二元弱酸,25℃时不同pH,H2A、HA-、A2−的物种分布如图所示:

①向0.1 mol∙L−1H2A的溶液中逐滴滴加NaOH溶液,写出pH由3~5时所发生反应的离子方程式:_______ 。
②pH=2.2时,溶液c(H2A):c(HA-)=_______ 。
③0.1 mol∙L−1NaHA溶液显_______ (填“酸性 ”碱性”或“中性”) 。
Ⅲ.沉淀溶解平衡
(5)如图为某温度下,PbS(s)、 ZnS(s)、 FeS(s)分 别在溶液中达到沉淀溶解平衡后,溶液c(S2−)、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是_______ (填化学式)。

(6)已知常温下,FeS的Ksp= 6.3 ×10−18, H2S的饱和溶液中c(H+)与c(S2−)之间存在如下关系: c2(H+)·c(S2−)=1.0×10−22,将适量FeS投入到氢硫酸饱和溶液中,欲使溶液中c(Fe2+)达到0.063 mol∙L−1,应调节溶液的pH=_______ 。
Ⅰ.化学平衡
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)
 CO(NH2)2(1)+H2O(l)
CO(NH2)2(1)+H2O(l)(1)将2 mol NH3和1 mol CO2投到一个温度恒定、体积恒定的容器中进行上述反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是
a.2υ正(NH3) = υ逆(CO2)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d. CO2、NH3的体积分数均不再改变
(2)取一定量的NH3和CO2放在一个带活塞的密闭真空容器中在一定温度 下反应达平衡,若在恒温、恒压下充入气体He, CO(NH2)2(l)的质量
Ⅱ.电离平衡、水解平衡
(3)某温度下,纯水中c(H+)=2.0 ×10−7 mol∙L−1, 该温度下,0.09 mol∙L−1NaOH溶液与0.01 mol∙L−1 HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=
(4)H2A是一种二元弱酸,25℃时不同pH,H2A、HA-、A2−的物种分布如图所示:

①向0.1 mol∙L−1H2A的溶液中逐滴滴加NaOH溶液,写出pH由3~5时所发生反应的离子方程式:
②pH=2.2时,溶液c(H2A):c(HA-)=
③0.1 mol∙L−1NaHA溶液显
Ⅲ.沉淀溶解平衡
(5)如图为某温度下,PbS(s)、 ZnS(s)、 FeS(s)分 别在溶液中达到沉淀溶解平衡后,溶液c(S2−)、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是

(6)已知常温下,FeS的Ksp= 6.3 ×10−18, H2S的饱和溶液中c(H+)与c(S2−)之间存在如下关系: c2(H+)·c(S2−)=1.0×10−22,将适量FeS投入到氢硫酸饱和溶液中,欲使溶液中c(Fe2+)达到0.063 mol∙L−1,应调节溶液的pH=
您最近一年使用:0次
4 . 草酸(H2C2O4)及其化合物在医药、印染、塑料等方面扮演着重要角色,同时广泛应用于化学实验中。
(1)氧化还原滴定法是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法,应用非常广泛。某草酸亚铁( )样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中
)样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中 的含量。实验方案如下:
的含量。实验方案如下:
Ⅰ.称量0.50g样品于锥形瓶中,加入适量稀硫酸溶解,水浴加热至70℃,加入足量 溶液,使其充分反应。
溶液,使其充分反应。
Ⅱ.向反应后的溶液中加入过量锌粉与稀硫酸,煮沸且完全反应后,用KSCN在点滴板上检验至溶液不变红,过滤至另一洁净的锥形瓶中,用0.0200mol/L的酸性高锰酸钾标准液滴定该溶液至终点,消耗高锰酸钾标准液16.00mL。
请回答下列问题:
①高锰酸钾标准液用___________ (填“酸式”或“碱式”)滴定管盛装,达到滴定终点的现象是___________ 。
②下列关于实验误差的说法正确的是___________ (填标号)。
A.步骤Ⅰ中,若加入的 溶液的量不足,则测得的
溶液的量不足,则测得的 含量偏高
含量偏高
B.步骤Ⅱ中,滴定前读数正确,滴定终点时仰视读数,测得的 含量偏低
含量偏低
C.步骤Ⅱ中,锥形瓶中有少量水未干燥,测得的 含量偏低
含量偏低
D.步骤Ⅱ中,过滤时间过长,可能导致测得的 含量偏低
含量偏低
③0.50g该样品中 的质量分数为
的质量分数为___________ (不考虑损耗)。
(2)常温下,改变0.1mol/L的 溶液的pH,溶液中
溶液的pH,溶液中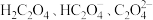 的物质的量分数(
的物质的量分数( )溶液pH的关系如图所示。回答下列问题:
)溶液pH的关系如图所示。回答下列问题:
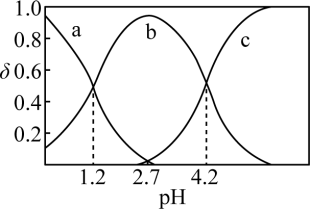
①曲线___________ (填“a”、“b”或“c”)代表 ,
, 时,溶液中
时,溶液中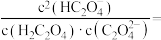
___________ 。
②pH从1.2增大至4.2的过程中,水的电离程度___________ (填“增大”、“减小”或“不变”)。
③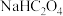 溶液中存在的离子浓度大小关系为
溶液中存在的离子浓度大小关系为___________ 。
(1)氧化还原滴定法是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法,应用非常广泛。某草酸亚铁(
 )样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中
)样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中 的含量。实验方案如下:
的含量。实验方案如下:Ⅰ.称量0.50g样品于锥形瓶中,加入适量稀硫酸溶解,水浴加热至70℃,加入足量
 溶液,使其充分反应。
溶液,使其充分反应。Ⅱ.向反应后的溶液中加入过量锌粉与稀硫酸,煮沸且完全反应后,用KSCN在点滴板上检验至溶液不变红,过滤至另一洁净的锥形瓶中,用0.0200mol/L的酸性高锰酸钾标准液滴定该溶液至终点,消耗高锰酸钾标准液16.00mL。
请回答下列问题:
①高锰酸钾标准液用
②下列关于实验误差的说法正确的是
A.步骤Ⅰ中,若加入的
 溶液的量不足,则测得的
溶液的量不足,则测得的 含量偏高
含量偏高B.步骤Ⅱ中,滴定前读数正确,滴定终点时仰视读数,测得的
 含量偏低
含量偏低C.步骤Ⅱ中,锥形瓶中有少量水未干燥,测得的
 含量偏低
含量偏低D.步骤Ⅱ中,过滤时间过长,可能导致测得的
 含量偏低
含量偏低③0.50g该样品中
 的质量分数为
的质量分数为(2)常温下,改变0.1mol/L的
 溶液的pH,溶液中
溶液的pH,溶液中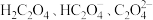 的物质的量分数(
的物质的量分数( )溶液pH的关系如图所示。回答下列问题:
)溶液pH的关系如图所示。回答下列问题:
①曲线
 ,
, 时,溶液中
时,溶液中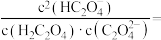
②pH从1.2增大至4.2的过程中,水的电离程度
③
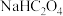 溶液中存在的离子浓度大小关系为
溶液中存在的离子浓度大小关系为
您最近一年使用:0次
2022-01-21更新
|
129次组卷
|
3卷引用:河南省许平汝联盟2021-2022学年高二下学期开学考试化学试题
解题方法
5 . 请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ/moL、497kJ/mol。N2 (g)+ O2 (g)=2NO(g) ∆H=+180.0kJ/moL。则相同条件下破坏1molNO中化学键需要吸收的能量为_____ kJ.
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=_____ mol/L。
若加入少量NaOH固体,则溶液中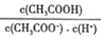
_____ (填"增大”、“减小”或“不变”)。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其含碳元素的微粒物质的量分数(ψ)随溶液pH变化的部分情况如图所示。
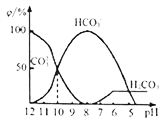
①在同一溶液中,H2CO3、HCO3-、CO32-____ (填“能”或“不能”) 大量共存。
②pH=12时,Na2CO3溶液中物料守恒关系为______ 。当pH=7时,溶液中含碳元素的微粒主要为_________ 。
③反应的CO32-+H2O HCO3-+OH-的平衡常数Kh=
HCO3-+OH-的平衡常数Kh=_____ 。
(1)已知:N2、O2分子中化学键的键能分别是946kJ/moL、497kJ/mol。N2 (g)+ O2 (g)=2NO(g) ∆H=+180.0kJ/moL。则相同条件下破坏1molNO中化学键需要吸收的能量为
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=
若加入少量NaOH固体,则溶液中
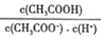
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其含碳元素的微粒物质的量分数(ψ)随溶液pH变化的部分情况如图所示。

①在同一溶液中,H2CO3、HCO3-、CO32-
②pH=12时,Na2CO3溶液中物料守恒关系为
③反应的CO32-+H2O
 HCO3-+OH-的平衡常数Kh=
HCO3-+OH-的平衡常数Kh=
您最近一年使用:0次
名校
解题方法
6 . 碲(Te)的单质和化合物在化工生产等方面具有重要应用。
(1)下列关于碲及其化合物的叙述不正确的是_______。
(2)25℃时,亚碲酸(H2TeO3)的 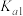 = 1×10-3,
= 1×10-3, 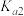 =2×10-8。0. 1 mol . L-1H2TeO3 的电离度 a 约为
=2×10-8。0. 1 mol . L-1H2TeO3 的电离度 a 约为___________ ( ); NaHTeO3的溶液的pH
); NaHTeO3的溶液的pH_______ 7(填“>”、“=”或“<”)。
(3)TeO2微溶于水,易溶于较浓的强酸和强碱。工业上常用铜阳极泥(主要含有TeO2、少量Ag、Au)为原料制备单质碲,其工艺流程如下:

①“碱浸”时TeO2发生反应的化学方程式为_________ 。
②“沉碲”时控制溶液的pH为4. 5~5. 0,生成Tea沉淀。酸性不能过强的原因是_________ ;防止局部酸度过大的操作方法是____________ 。
③“酸溶”后,将SO2通入TeCl4酸性溶液中进行“还原”得到碲,该反应的化学方程式是____________ 。
④工业上还可以通过电解铜阳极泥碱浸、过滤后的滤液得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为__________ 。
(1)下列关于碲及其化合物的叙述不正确的是_______。
| A.Te位于元素周期表的第五周期ⅣA族 |
| B.Te的氧化物通常有TeO2和TeO3 |
| C.H2TeO4的酸性比H2SO4酸性强 |
| D.热稳定性H2Te比H2S弱,H2Te比HI强 |
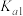 = 1×10-3,
= 1×10-3, 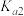 =2×10-8。0. 1 mol . L-1H2TeO3 的电离度 a 约为
=2×10-8。0. 1 mol . L-1H2TeO3 的电离度 a 约为 ); NaHTeO3的溶液的pH
); NaHTeO3的溶液的pH(3)TeO2微溶于水,易溶于较浓的强酸和强碱。工业上常用铜阳极泥(主要含有TeO2、少量Ag、Au)为原料制备单质碲,其工艺流程如下:

①“碱浸”时TeO2发生反应的化学方程式为
②“沉碲”时控制溶液的pH为4. 5~5. 0,生成Tea沉淀。酸性不能过强的原因是
③“酸溶”后,将SO2通入TeCl4酸性溶液中进行“还原”得到碲,该反应的化学方程式是
④工业上还可以通过电解铜阳极泥碱浸、过滤后的滤液得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为
您最近一年使用:0次
2017-03-22更新
|
720次组卷
|
3卷引用:2017届河南省洛阳市高三第二次统一考试(3月)理综化学试卷



