1 . 根据下列实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由 水解引起的 水解引起的 |
| B | 室温下,用pH试纸测定浓度均为0.1mol/L的NaClO溶液、CH3COONa溶液pH | NaClO溶液的pH较大 | 酸性:HClO<CH3COOH |
| C | 向1mL 0.1mol/LNaOH溶液中滴入2滴0.1mol/L MgCl2溶液,再滴入2滴0.1mol/L CuSO4溶液 | 沉淀颜色变化:白色—蓝色 | Ksp:Cu(OH)2<Mg(OH)2 |
| D | 分别向两支试管中加入同浓度、同体积的草酸溶液,再分别加入同体积、不同浓度的酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色时间不同 | 浓度不同反应速率不同 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-16更新
|
359次组卷
|
2卷引用:福建省厦门第一中学2022-2023学年高三上学期12月月考化学试题
名校
解题方法
2 . 下列现象和结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 等体积等浓度的MgCl2和NaOH溶液混合后,再滴加几滴FeCl3 | 先产生白色沉淀,后沉淀消失 | Fe3+水解出H+造成Mg(OH)2溶解 |
| B | 将通过灼热碎瓷片后的石蜡油蒸气通入到溴水中 | 溴水褪色 | 产物中一定含乙烯 |
| C | SO2分别通入石蕊、品红溶液 | 前者变红,后者褪色 | SO2漂白具有选择性 |
| D | 向5mL0.1mol/LK2Cr2O7溶液滴加5滴浓硫酸 | 溶液颜色由橙色变黄色 | 浓硫酸溶于水放热使平衡移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-12-09更新
|
539次组卷
|
4卷引用:四川省成都第七中学2022-2023学年高三上学期期中化学试题
名校
3 .  的化学性质与
的化学性质与 相似。用
相似。用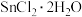 配制氯化亚锡溶液的操作为:加盐酸溶解→加水稀释→加4~5粒锡→移液保存。下列关于
配制氯化亚锡溶液的操作为:加盐酸溶解→加水稀释→加4~5粒锡→移液保存。下列关于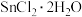 的相关实验叙述正确的是
的相关实验叙述正确的是

 的化学性质与
的化学性质与 相似。用
相似。用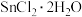 配制氯化亚锡溶液的操作为:加盐酸溶解→加水稀释→加4~5粒锡→移液保存。下列关于
配制氯化亚锡溶液的操作为:加盐酸溶解→加水稀释→加4~5粒锡→移液保存。下列关于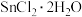 的相关实验叙述正确的是
的相关实验叙述正确的是
| A.用A装置稀释浓盐酸 | B.用B装置加快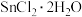 溶解 溶解 |
C.用C装置保存 溶液 溶液 | D.用D装置制备无水 |
您最近一年使用:0次
4 . 两种溶液混合后的成分与溶液酸碱性的变化可能有关,下列说法正确的是
A. 的 的 溶液与 溶液与 的NaOH溶液等体积混合后所得溶液中: 的NaOH溶液等体积混合后所得溶液中: |
B.等体积、等物质的量浓度的 溶液和 溶液和 溶液混合: 溶液混合: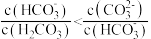 |
C.常温下, 的HA溶液与 的HA溶液与 的BOH溶液等体积混合,所得溶液pH>7,则 的BOH溶液等体积混合,所得溶液pH>7,则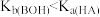 |
D.向某 溶液中加入少量 溶液中加入少量 晶体,所得溶液中 晶体,所得溶液中 水解程度增大,pH增大 水解程度增大,pH增大 |
您最近一年使用:0次
2022-11-24更新
|
552次组卷
|
6卷引用:河北省部分学校2022-2023学年高三上学期11月联考化学试题
名校
解题方法
5 . 测定
 溶液先升温再降温过程中的
溶液先升温再降温过程中的 ,数据如下。
,数据如下。
实验过程中,取①④时刻的溶液,加入盐酸酸化的 溶液做对比实验,④产生白色沉淀多。下列说法不正确的是
溶液做对比实验,④产生白色沉淀多。下列说法不正确的是

 溶液先升温再降温过程中的
溶液先升温再降温过程中的 ,数据如下。
,数据如下。| 时刻 | ① | ② | ③ | ④ |
| 温度/℃ | 25 | 30 | 40 | 25 |
 | 9.66 | 9.52 | 9.37 | 9.25 |
 溶液做对比实验,④产生白色沉淀多。下列说法不正确的是
溶液做对比实验,④产生白色沉淀多。下列说法不正确的是A.④溶液的 小于①,是由于 小于①,是由于 浓度增大造成的 浓度增大造成的 |
| B.水的电离程度①>④ |
C. 值①<②<③ 值①<②<③ |
| D.③→④的过程中,温度和浓度对水解平衡移动方向的影响不同 |
您最近一年使用:0次
2022-11-19更新
|
134次组卷
|
2卷引用:河北省张家口市第一中学2022-2023学年高三上学期期中考试化学试题
名校
6 . 无水 是一种重要的化工原料,其熔点306℃、沸点316℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。一般采用低共熔混合物反应法(熔融法)制备高纯度的三氯化铁,其模拟反应装置如下:
是一种重要的化工原料,其熔点306℃、沸点316℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。一般采用低共熔混合物反应法(熔融法)制备高纯度的三氯化铁,其模拟反应装置如下:
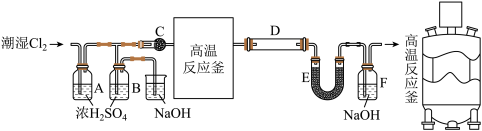
实验过程:在一个带有耐酸衬里的反应器中(即图中的高温反应釜),将70% 和30%KCl在600℃下共熔。再将铁屑溶解于共熔物中,再通入干燥氯气。反应生成的升华后导出,再经冷凝收集。
和30%KCl在600℃下共熔。再将铁屑溶解于共熔物中,再通入干燥氯气。反应生成的升华后导出,再经冷凝收集。
回答下列问题:
(1)C装置的名称为_______ ;
(2)当氯气通入时,A中有酸雾产生。为吸收酸雾,C中应盛放的物质为_______;(填字母)
(3)高温反应釜中发生反应的化学方程式为_______ ;
(4)E装置的作用为_______ ;
(5)为研究 的性质,某化学兴趣小组取一定质量的
的性质,某化学兴趣小组取一定质量的 (摩尔质量为
(摩尔质量为 )在惰性气体保护下受热分解时,所得固体产物的剩余质量分数(剩余质量与原样品质量的百分比)随温度变化的曲线如图所示。试利用图中信息并结合所学的知识,回答下列各问题:
)在惰性气体保护下受热分解时,所得固体产物的剩余质量分数(剩余质量与原样品质量的百分比)随温度变化的曲线如图所示。试利用图中信息并结合所学的知识,回答下列各问题:

已知:A为红褐色固体,B中含有三种元素,C为红棕色固体,D为黑色固体。
①固体产物的化学式B是_______ ,D是_______ ;
②由C得到D的化学方程式为_______ 。
 是一种重要的化工原料,其熔点306℃、沸点316℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。一般采用低共熔混合物反应法(熔融法)制备高纯度的三氯化铁,其模拟反应装置如下:
是一种重要的化工原料,其熔点306℃、沸点316℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。一般采用低共熔混合物反应法(熔融法)制备高纯度的三氯化铁,其模拟反应装置如下:
实验过程:在一个带有耐酸衬里的反应器中(即图中的高温反应釜),将70%
 和30%KCl在600℃下共熔。再将铁屑溶解于共熔物中,再通入干燥氯气。反应生成的升华后导出,再经冷凝收集。
和30%KCl在600℃下共熔。再将铁屑溶解于共熔物中,再通入干燥氯气。反应生成的升华后导出,再经冷凝收集。回答下列问题:
(1)C装置的名称为
(2)当氯气通入时,A中有酸雾产生。为吸收酸雾,C中应盛放的物质为_______;(填字母)
A. | B.CaO | C. | D.NaOH |
(4)E装置的作用为
(5)为研究
 的性质,某化学兴趣小组取一定质量的
的性质,某化学兴趣小组取一定质量的 (摩尔质量为
(摩尔质量为 )在惰性气体保护下受热分解时,所得固体产物的剩余质量分数(剩余质量与原样品质量的百分比)随温度变化的曲线如图所示。试利用图中信息并结合所学的知识,回答下列各问题:
)在惰性气体保护下受热分解时,所得固体产物的剩余质量分数(剩余质量与原样品质量的百分比)随温度变化的曲线如图所示。试利用图中信息并结合所学的知识,回答下列各问题:
已知:A为红褐色固体,B中含有三种元素,C为红棕色固体,D为黑色固体。
①固体产物的化学式B是
②由C得到D的化学方程式为
您最近一年使用:0次
2022-11-03更新
|
422次组卷
|
3卷引用:湖北省鄂东南联盟2022-2023学年高三上学期期中联考化学试题
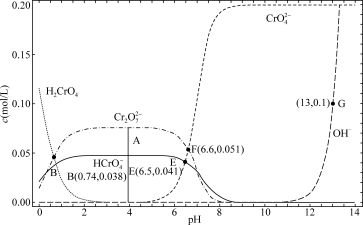
7 . 某温度下,改变
 溶液的pH时,各种含铬元素微粒及
溶液的pH时,各种含铬元素微粒及 浓度变化如图所示(已知
浓度变化如图所示(已知 是二元酸),下列说法中正确的是
是二元酸),下列说法中正确的是

 溶液的pH时,各种含铬元素微粒及
溶液的pH时,各种含铬元素微粒及 浓度变化如图所示(已知
浓度变化如图所示(已知 是二元酸),下列说法中正确的是
是二元酸),下列说法中正确的是
A.溶液中存在平衡 ,该温度下此反应的平衡常数 ,该温度下此反应的平衡常数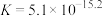 |
B.该温度下的中性溶液的 |
C.向10 mL   溶液中滴入几滴 溶液中滴入几滴  溶液,溶液橙色变浅 溶液,溶液橙色变浅 |
D.B点溶液中存在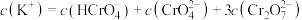 |
您最近一年使用:0次
名校
8 . 用如图所示装置(夹持装置均已省略)进行实验能达到目的的是


| A.甲装置可检验溶液中是否有K+ | B.乙装置可验证浓硫酸的脱水性 |
C.丙装置可制备无水 | D.丁装置可制取并收集干燥、纯净的NO |
您最近一年使用:0次
2022-10-12更新
|
142次组卷
|
2卷引用:山东省潍坊五县市2022-2023学年高三上学期10月质量检测联考化学试题
名校
解题方法
9 . 氨基羧酸盐在工农业、生活中有着广泛应用,其中氨基甲酸铵(NH2COONH4)可用作肥料、洗涤剂等。实验室用下图所示装置制备氨基甲酸铵,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则主要生成碳酸氢铵。
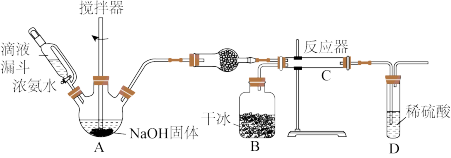
(1)盛放NaOH固体的仪器名称是_______ ,干燥管中的试剂为_______ 。
(2)无水条件下合成氨基甲酸铵的化学反应方程式为_______ ;若该反应能自发进行,则该反应的
_______ 0,(填“>”或“<”);对比碳酸钙和盐酸反应制取CO2,该实验利用干冰升华制取CO2,其优点有_______ 。
A.提供较低的反应温度,有利于过程的自发进行
B.所得氨基甲酸铵含杂质较少
C.更加绿色环保
D.对CO2的流速能更好的调控与掌握
(3)上述实验装置存在缺陷,改进的方法是_______ 。(写出其中任意1条)
(4)某小组拟在相同温度下,探究氨基甲酸铵浓度对氨基甲酸铵水解反应速率的影响。限选试剂与仪器:2.0mol/L NH2COONH4溶液、蒸馏水、烧杯、量筒、秒表、电导率仪、恒温水浴槽。设计实验方案:在不同氨基甲酸铵溶液浓度下,测定电导率数值的变化量相同所需的时间。参照下表格式,在表中的空白栏目填上需记录的待测物理量和所拟定的数据。(数据用字母表示,其中体积用V1、V2等表示)______
(5)该小组在上述实验方案基础上又进行了探究,分别用两份不同初始浓度的氨基甲酸铵溶液在不同温度下测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。根据图中信息,能说明该水解反应速率随温度升高而加快的证据是_______ 。


(1)盛放NaOH固体的仪器名称是
(2)无水条件下合成氨基甲酸铵的化学反应方程式为

A.提供较低的反应温度,有利于过程的自发进行
B.所得氨基甲酸铵含杂质较少
C.更加绿色环保
D.对CO2的流速能更好的调控与掌握
(3)上述实验装置存在缺陷,改进的方法是
(4)某小组拟在相同温度下,探究氨基甲酸铵浓度对氨基甲酸铵水解反应速率的影响。限选试剂与仪器:2.0mol/L NH2COONH4溶液、蒸馏水、烧杯、量筒、秒表、电导率仪、恒温水浴槽。设计实验方案:在不同氨基甲酸铵溶液浓度下,测定电导率数值的变化量相同所需的时间。参照下表格式,在表中的空白栏目填上需记录的待测物理量和所拟定的数据。(数据用字母表示,其中体积用V1、V2等表示)
| 物理量 实验序号 | 温度T(℃) | 导电率变化量∆S | … | |||
| 1 | a | b | ||||
| 2 | a | b |

您最近一年使用:0次
2022-10-09更新
|
275次组卷
|
3卷引用:广东省六校2022-2023学年高三上学期第二次联考化学试题
10 .  俗名绿矾,可用于制铁盐、氧化铁颜料、净水剂、消毒剂等。由硫铁矿烧渣(主要成分:
俗名绿矾,可用于制铁盐、氧化铁颜料、净水剂、消毒剂等。由硫铁矿烧渣(主要成分: 、
、 、FeO、
、FeO、 )制备绿矾流程如下:
)制备绿矾流程如下:

已知:① 难溶于水,能还原
难溶于水,能还原 ,硫元素被氧化成
,硫元素被氧化成 。
。
②金属离子生成氢氧化物沉淀的pH范围见下表:
(1)提高“酸浸”速率的措施有___________ (任写一点即可):写出滤渣Ⅰ与某种酸反应的化学方程式___________ ;滤渣Ⅱ经灼烧后可用于___________ (写出一种用途即可)。
(2)写出“还原”步骤中涉及反应的离子方程式___________ 。
(3)“除铝”需控制的pH范围是___________ 。
(4)“酸化”步骤中加入稀硫酸的目的是___________ 。操作Ⅲ为___________ ;“洗涤”时的试剂最好选用下列中的___________ (填代号)
A.热水 B.氯水 C.乙醇 D.饱和食盐水
(5)设计实验检验制得的绿矾晶体中是否含有 :
:___________ 。
 俗名绿矾,可用于制铁盐、氧化铁颜料、净水剂、消毒剂等。由硫铁矿烧渣(主要成分:
俗名绿矾,可用于制铁盐、氧化铁颜料、净水剂、消毒剂等。由硫铁矿烧渣(主要成分: 、
、 、FeO、
、FeO、 )制备绿矾流程如下:
)制备绿矾流程如下:
已知:①
 难溶于水,能还原
难溶于水,能还原 ,硫元素被氧化成
,硫元素被氧化成 。
。②金属离子生成氢氧化物沉淀的pH范围见下表:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
 | 1.5 | 3.2 |
 | 3.0 | 5.0 |
 | 6.3 | 8.3 |
(1)提高“酸浸”速率的措施有
(2)写出“还原”步骤中涉及反应的离子方程式
(3)“除铝”需控制的pH范围是
(4)“酸化”步骤中加入稀硫酸的目的是
A.热水 B.氯水 C.乙醇 D.饱和食盐水
(5)设计实验检验制得的绿矾晶体中是否含有
 :
:
您最近一年使用:0次



