解题方法
1 . 氰化钠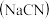 ,白色结晶颗粒或粉末,易潮解,应用于合成、电镀、冶金、药物等多个领域,是一种重要的基本化工原料.
,白色结晶颗粒或粉末,易潮解,应用于合成、电镀、冶金、药物等多个领域,是一种重要的基本化工原料.
 氰化钠中含有化学键的类型为
氰化钠中含有化学键的类型为______  碳的化合价为
碳的化合价为______ 价,据此推测,氰化钠中碳可能表现的性质是______  填序号
填序号 ;
;
 只具有氧化性
只具有氧化性  只具有还原性
只具有还原性  既有氧化性又有还原性
既有氧化性又有还原性
工业上生产氰化钠的方程式为: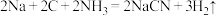 该反应的还原剂为:
该反应的还原剂为:______  填化学式
填化学式 ,当反应得到
,当反应得到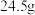 氰化钠时,转移电子数为
氰化钠时,转移电子数为______ ,同时产生标况下氢气______ L;
 氰化钠遇水时极易与水反应,产生一种具有挥发性的可燃物,最终所得溶液呈强碱性
氰化钠遇水时极易与水反应,产生一种具有挥发性的可燃物,最终所得溶液呈强碱性 强于同条件等浓度的碳酸氢钠溶液
强于同条件等浓度的碳酸氢钠溶液 ,写出相关的离子方程式
,写出相关的离子方程式______ ,溶液中各离子浓度由大到小的顺序为______  配制氰化钠溶液的方法是
配制氰化钠溶液的方法是______  填序号
填序号 ;
;
 在通风橱中,直接将其溶解于水
在通风橱中,直接将其溶解于水
 在通风橱中,先将其溶解于氢氧化钠溶液,再稀释到相应浓度
在通风橱中,先将其溶解于氢氧化钠溶液,再稀释到相应浓度
 在通风橱中,边通
在通风橱中,边通 边将其溶解于水
边将其溶解于水
 时向等体积
时向等体积 的氢氧化钠溶液和
的氢氧化钠溶液和 的氰化钠溶液中不断滴加同浓度的稀盐酸至
的氰化钠溶液中不断滴加同浓度的稀盐酸至 ,消耗盐酸的体积前者
,消耗盐酸的体积前者______ 后者 填“大于”、“等于”或“小于”
填“大于”、“等于”或“小于” ;
;
 氰化钠可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物
氰化钠可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物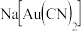 ,其反应方程式为:
,其反应方程式为: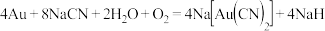 ,
,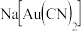 在水溶液中的电离方程式为:
在水溶液中的电离方程式为: 然后再用锌从溶液中把金置换出来,锌转化为
然后再用锌从溶液中把金置换出来,锌转化为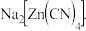 据此,请写出在空气中用氰化钠溶液提取金的电极反应式:正极:
据此,请写出在空气中用氰化钠溶液提取金的电极反应式:正极:______ ;负极:______ ;
 含氰化钠的废水可以在碱性条件下,加入
含氰化钠的废水可以在碱性条件下,加入 或通入
或通入
______  填常用试剂名称
填常用试剂名称 处理,使
处理,使 转变为无危害的气体.若人不慎氰化钠中毒,可用
转变为无危害的气体.若人不慎氰化钠中毒,可用 缓解,二者反应得到两种含硫元素的离子,其中一种遇到
缓解,二者反应得到两种含硫元素的离子,其中一种遇到 可变为血红色.写出解毒原理相关离子方程式
可变为血红色.写出解毒原理相关离子方程式______ .
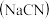 ,白色结晶颗粒或粉末,易潮解,应用于合成、电镀、冶金、药物等多个领域,是一种重要的基本化工原料.
,白色结晶颗粒或粉末,易潮解,应用于合成、电镀、冶金、药物等多个领域,是一种重要的基本化工原料. 氰化钠中含有化学键的类型为
氰化钠中含有化学键的类型为 碳的化合价为
碳的化合价为 填序号
填序号 ;
; 只具有氧化性
只具有氧化性  只具有还原性
只具有还原性  既有氧化性又有还原性
既有氧化性又有还原性工业上生产氰化钠的方程式为:
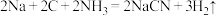 该反应的还原剂为:
该反应的还原剂为: 填化学式
填化学式 ,当反应得到
,当反应得到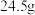 氰化钠时,转移电子数为
氰化钠时,转移电子数为 氰化钠遇水时极易与水反应,产生一种具有挥发性的可燃物,最终所得溶液呈强碱性
氰化钠遇水时极易与水反应,产生一种具有挥发性的可燃物,最终所得溶液呈强碱性 强于同条件等浓度的碳酸氢钠溶液
强于同条件等浓度的碳酸氢钠溶液 ,写出相关的离子方程式
,写出相关的离子方程式 配制氰化钠溶液的方法是
配制氰化钠溶液的方法是 填序号
填序号 ;
; 在通风橱中,直接将其溶解于水
在通风橱中,直接将其溶解于水 在通风橱中,先将其溶解于氢氧化钠溶液,再稀释到相应浓度
在通风橱中,先将其溶解于氢氧化钠溶液,再稀释到相应浓度 在通风橱中,边通
在通风橱中,边通 边将其溶解于水
边将其溶解于水 时向等体积
时向等体积 的氢氧化钠溶液和
的氢氧化钠溶液和 的氰化钠溶液中不断滴加同浓度的稀盐酸至
的氰化钠溶液中不断滴加同浓度的稀盐酸至 ,消耗盐酸的体积前者
,消耗盐酸的体积前者 填“大于”、“等于”或“小于”
填“大于”、“等于”或“小于” ;
; 氰化钠可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物
氰化钠可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物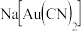 ,其反应方程式为:
,其反应方程式为: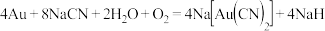 ,
,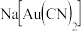 在水溶液中的电离方程式为:
在水溶液中的电离方程式为: 然后再用锌从溶液中把金置换出来,锌转化为
然后再用锌从溶液中把金置换出来,锌转化为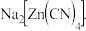 据此,请写出在空气中用氰化钠溶液提取金的电极反应式:正极:
据此,请写出在空气中用氰化钠溶液提取金的电极反应式:正极: 含氰化钠的废水可以在碱性条件下,加入
含氰化钠的废水可以在碱性条件下,加入 或通入
或通入
 填常用试剂名称
填常用试剂名称 处理,使
处理,使 转变为无危害的气体.若人不慎氰化钠中毒,可用
转变为无危害的气体.若人不慎氰化钠中毒,可用 缓解,二者反应得到两种含硫元素的离子,其中一种遇到
缓解,二者反应得到两种含硫元素的离子,其中一种遇到 可变为血红色.写出解毒原理相关离子方程式
可变为血红色.写出解毒原理相关离子方程式
您最近一年使用:0次
名校
解题方法
2 . 劳动创造美好生活。下列劳动项目与所述的化学知识有关联的是
| 选项 | 劳动项目 | 化学原理 |
| A | 洗涤餐具时可用热的纯碱溶液去油污 | 油脂在碱性条件下能发生水解反应 |
| B | 医生使用含微量硝酸银的滴眼液 | 硝酸根离子有强氧化性 |
| C | 面包师用小苏打作发泡剂烘焙面包 | Na2CO3可与酸反应 |
| D | 雕刻师用FeCl3溶液在铜板上刻出精美图案 | FeCl3溶液显酸性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 某实验小组通过以下实验,探究镀件表面镀铜的最佳条件。
【查阅资料】①Cu2++2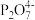
 [Cu(P2O7)2]6-K=1×109
[Cu(P2O7)2]6-K=1×109
②Cu+在溶液中不稳定,容易发生歧化。
【实验设计】用CuSO4·5H2O、Na4P2O7·10H2O(焦磷酸钠)、添加剂配制一定浓度的电镀液,分别用纯铜和镀件作为两极材料,探究电镀液的pH、电流密度、电极板间距对层的影响。
(1)要配制一定体积40g/L的CuSO4溶液,以下仪器不需要用到的是_______ (填仪器名称)。
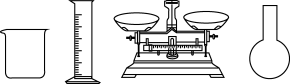
(2)镀件表面的油污可用_______ 清洗。
(3)电镀时阴极上发生的主要反应的电极反应式为_______ 。
【实验结果与数据分析】
ⅰ.其他条件不变时,电位10min,pH对电镀的影响如下表:
(4)实验3中,铜镀层的沉积速率v(Cu)=_______ mol/min(保留两位有效数字)。
(5)实验1和实验4中,酸性或碱性较强时,镀层出现斑驳的可能原因是_______ 。
ⅱ.电流密度、电极板间距与镀膜质量的关系

(6)电流密度小于0.50A/dm2时镀膜质量随电流密度增大而增大的原因是_______ 。
(7)本实验电镀的最佳条件是pH为8.5、_______ 、_______ 。
(8)使用最佳条件电镀时,在阳极附近的电镀液中出现红色固体沉积物,其可能原因用离子方程式表示为_______ ,通空气搅拌可防止红色固体沉积物形成。
【查阅资料】①Cu2++2
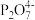
 [Cu(P2O7)2]6-K=1×109
[Cu(P2O7)2]6-K=1×109②Cu+在溶液中不稳定,容易发生歧化。
【实验设计】用CuSO4·5H2O、Na4P2O7·10H2O(焦磷酸钠)、添加剂配制一定浓度的电镀液,分别用纯铜和镀件作为两极材料,探究电镀液的pH、电流密度、电极板间距对层的影响。
(1)要配制一定体积40g/L的CuSO4溶液,以下仪器不需要用到的是

(2)镀件表面的油污可用
(3)电镀时阴极上发生的主要反应的电极反应式为
【实验结果与数据分析】
ⅰ.其他条件不变时,电位10min,pH对电镀的影响如下表:
| 实验信号 | pH值 | 镀膜质量/g | 镀层外观 |
| 1 | 3 | 0.0136 | 表面斑驳 |
| 2 | 7 | 0.0258 | 光亮,不光滑 |
| 3 | 8.5 | 0.0356 | 光亮,光滑 |
| 4 | 10 | 0.0216 | 表面部分斑驳 |
(5)实验1和实验4中,酸性或碱性较强时,镀层出现斑驳的可能原因是
ⅱ.电流密度、电极板间距与镀膜质量的关系

(6)电流密度小于0.50A/dm2时镀膜质量随电流密度增大而增大的原因是
(7)本实验电镀的最佳条件是pH为8.5、
(8)使用最佳条件电镀时,在阳极附近的电镀液中出现红色固体沉积物,其可能原因用离子方程式表示为
您最近一年使用:0次
4 . 电镀废液中含有Cu2+、Mg2+、Ca2+、Ni2+和Fe3+,某专利申请用下列方法从该类废液中制备高纯度的铜粉。

已知导体和其接触的溶液的界面上会形成一定的电位差,被称作电极电位。如反应Cu2+(氧化态)+2e-=Cu(还原态)的标准电极电位表示为Cu2+/Cu=0.34,该值越大氧化态的氧化性越强,越小还原态的还原性越强。两个电对间的电极电位差别越大,二者之间的氧化还原反应越易发生。某些电对的电极电位如下表所示:
回答下列问题:
(1)蒸发浓缩后的溶液中,Cu2+的物质的量浓度≥_______ (结果保留两位小数)。分离固液混合物时,需要用真空抽滤的方法提高过滤的速度和效果,其原因是_______ 。
(2)溶液的氧化还原电位越高,其氧化能力同样越强。溶液的氧化还原电位,与溶液中离子等微粒的种类及其浓度相关,实验测得Cu2+与SO2反应体系的氧化还原电位与铜粉的回收率和纯度的关系如下表所示:
①由此可知,制备过程中进行电位检测时,要把溶液的氧化还原电位控制在_______ mV左右。
②专利申请书指出,反应液的反应历程为Cu2+首先被还原为Cu+,Cu+再歧化为Cu和Cu2+。反应历程不是Cu2+直接被还原为Cu的原因是_______ 。反应生成Cu+的离子方程式是_______ 。
(3)废液2中含有的金属离子除Mg2+、Ca2+外还有_______ 。为了使这些离子均除去,使水得到进一步的净化,应该在调节溶液pH使其他杂质离子沉淀后,再使Ca2+转化为_______ (填化学式)而除去。

已知导体和其接触的溶液的界面上会形成一定的电位差,被称作电极电位。如反应Cu2+(氧化态)+2e-=Cu(还原态)的标准电极电位表示为Cu2+/Cu=0.34,该值越大氧化态的氧化性越强,越小还原态的还原性越强。两个电对间的电极电位差别越大,二者之间的氧化还原反应越易发生。某些电对的电极电位如下表所示:
| Fe3+/Fe2+ | Cu2+/Cu+ | Cu2+/Cu |  /SO2 /SO2 | Fe2+/Fe | Ni2+/Ni | Mg2+/Mg | Ca2+/Ca |
| 0.77 | 0.52 | 0.34 | 0.17 | -0.44 | -0.23 | -2.38 | -2.76 |
(1)蒸发浓缩后的溶液中,Cu2+的物质的量浓度≥
(2)溶液的氧化还原电位越高,其氧化能力同样越强。溶液的氧化还原电位,与溶液中离子等微粒的种类及其浓度相关,实验测得Cu2+与SO2反应体系的氧化还原电位与铜粉的回收率和纯度的关系如下表所示:
| 反应液的电位(mV) | 360 | 340 | 320 | 300 | 280 | 260 |
| 铜粉的回收率(%) | 86.5 | 90.2 | 95.6 | 97.2 | 97.3 | 97.4 |
| 产品的纯度(%) | 99.9 | 99.9 | 99.9 | 99.9 | 99.9 | 99.9 |
②专利申请书指出,反应液的反应历程为Cu2+首先被还原为Cu+,Cu+再歧化为Cu和Cu2+。反应历程不是Cu2+直接被还原为Cu的原因是
(3)废液2中含有的金属离子除Mg2+、Ca2+外还有
您最近一年使用:0次
名校
5 . 下列有关物质的性质与用途具有对应关系的是
| A.碳酸钠溶液呈碱性,可用于清洗油污 |
| B.NH3极易溶于水,可用作制冷剂 |
| C.浓硫酸具有强氧化性,可用于干燥氯化氢气体 |
| D.NaHCO3受热易分解,可用于制抗酸药物 |
您最近一年使用:0次
6 . 下列说法正确的是
| A.SiO2为非金属的酸性氧化物,其不能与任何酸发生化学反应 |
| B.SO2能使品红溶液、溴水褪色,分别说明SO2具有强氧化性、还原性 |
| C.将AlCl3溶液和Al2(SO4)3溶液分别蒸干和灼烧,最终所得产物的成分均为Al2O3 |
| D.反应物和生成物各具有的总能量决定了该反应是放热反应还是吸热反应 |
您最近一年使用:0次
2019-11-03更新
|
302次组卷
|
3卷引用:2020届高三《新题速递·化学》12月第02期(考点01-06)
7 . 劳动成就梦想。下列劳动项目与所述的化学知识没有关联的是
| 选项 | 劳动项目 | 化学知识 |
| A | 厨房帮厨:炒菜时,时常会添加料酒 | 将乙醇氧化为可调味的乙酸 |
| B | 工厂消毒:向各个办公场所喷洒“84”消毒液 | NaClO具有强氧化性,能使蛋白质变性杀灭病毒 |
| C | 社区服务:用泡沫灭火器演练如何灭火 | 铝离子与碳酸氢根离子在溶液中相互促进水解 |
| D | 自主探究:锌、铜和柠檬为原料制作水果电池 | 锌能与柠檬中酸性物质发生氧化还原反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-08-28更新
|
1363次组卷
|
4卷引用:回归教材重难点01 化学与STSE-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)
(已下线)回归教材重难点01 化学与STSE-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)广东省深圳市光明区2023届高三上学期第一次模拟考试化学试题广东省珠海市第一中学2022-2023学年高三上学期11月份阶段考试化学试题广东省深圳市新安中学2022-2023学年高三上学期周末测试(2022.9.25)化学试题
8 . 废镍催化剂主要含Ni,还有少量Cu、Fe、Al及其氧化物、SiO2.某研究小组设计如图所示工艺流程制备硫酸镍晶体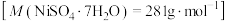 。
。
①镍的化学性质与铁相似,能与酸缓慢反应。
②一定条件下,一些金属氢氧化物沉淀时的pH如下表:
(1)“滤渣2”的成分是___________ (用化学式表示)。溶液中加入H2O2的目的是___________ (用离子方程式表示)。
(2)“调pH”可选用的物质___________ (填序号)。
A.Na2CO3 B.NiCO3 C.H2SO4 D.NiSO4
“调pH”的范围为___________ 。
(3)下列有关说法不正确 的是___________。
(4)测定产品的纯度。
计算产品的纯度为___________ 。
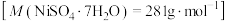 。
。
①镍的化学性质与铁相似,能与酸缓慢反应。
②一定条件下,一些金属氢氧化物沉淀时的pH如下表:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀的pH | 7.2 | 4.0 | 2.2 | 7.5 |
| 沉淀完全的pH | 9.0 | 5.6 | 3.2 | 9.0 |
(1)“滤渣2”的成分是
(2)“调pH”可选用的物质
A.Na2CO3 B.NiCO3 C.H2SO4 D.NiSO4
“调pH”的范围为
(3)下列有关说法
| A.酸浸步骤可用水浴加热,以加速反应 |
| B.操作A中的有机溶剂可选用乙醇 |
| C.调pH后过滤,需用玻璃棒对漏斗中的混合物充分搅拌 |
| D.操作B中包含“结晶、过滤、洗涤、煅烧”等操作 |
(4)测定产品的纯度。
| 操作步骤 | 涉及反应 |
| ①准确称取制备的硫酸镍样品5.620g,加入含0.0200molEDTA的二钠盐溶液(用H2Y2-表示),充分反应后定容成100mL。 | 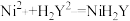 |
②取25.00mL上述溶液于锥形瓶中,加二甲酚橙作指示剂,用 标准液滴定到终点,平行实验三次,平均消耗20.00mLZn2+标准液。 标准液滴定到终点,平行实验三次,平均消耗20.00mLZn2+标准液。 |  |
您最近一年使用:0次
9 . 铁和钛是重要的金属材料。 合金是优良的储氢合金。一种利用钛铁矿(主要成分为
合金是优良的储氢合金。一种利用钛铁矿(主要成分为 ,另含
,另含 和
和 等杂质)制备钛和绿矾的工艺流程如下。下列说法错误的是
等杂质)制备钛和绿矾的工艺流程如下。下列说法错误的是

 合金是优良的储氢合金。一种利用钛铁矿(主要成分为
合金是优良的储氢合金。一种利用钛铁矿(主要成分为 ,另含
,另含 和
和 等杂质)制备钛和绿矾的工艺流程如下。下列说法错误的是
等杂质)制备钛和绿矾的工艺流程如下。下列说法错误的是
| A.“浸出”过程中Ti元素的化合价没有发生改变 |
B.氧化性: |
C.若制得 金属钛,则步骤Ⅲ中转移电子的物质的量至少为 金属钛,则步骤Ⅲ中转移电子的物质的量至少为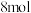 |
D. 被还原为Ti的过程也可以用Na代替Mg 被还原为Ti的过程也可以用Na代替Mg |
您最近一年使用:0次
2023-10-28更新
|
190次组卷
|
3卷引用:选择题11-15
解题方法
10 . 某实验小组用废铁屑制备Fe(NO3)2·6H2O的流程如图1所示。

已知:Fe(NO3)2·6H2O呈淡绿色,熔点为60.5℃,易溶于水。FeSO4·7H2O在60℃时溶解度最大,温度降低会结晶析出。
回答下列问题:
(1)步骤Ⅰ的目的是_______ 。
(2)步骤Ⅱ的趁热过滤装置如图2所示,下列说法正确的是_______ (填标号)。

A.漏斗颈要紧贴接受滤液的容器内壁,以加快过滤速度
B.漏斗颈要短,以免过滤时溶液在漏斗颈内停留过久,因散热降温析出晶体而堵塞
C.过滤前先用少量热溶剂润湿滤纸,以免干燥的滤纸吸附溶剂而使溶液浓缩析出晶体
(3)步骤Ⅲ的抽滤装置如图3所示,若转移BaSO4沉淀时,烧杯内壁残留少量沉淀,可用吸滤瓶中的滤液进行冲洗。冲洗操作的合理顺序为(填标号,下同)→_______ →将BaSO4及滤液转移至布氏漏斗。

a.拔掉橡皮管 b.拔下布氏漏斗 c.将吸滤瓶倾斜支管口向上 d.将吸滤瓶倾斜支管口向下 e.从支管小心倒出滤液冲洗沉淀 f.从上口用玻璃棒引流部分滤液入烧杯
(4)步骤Ⅳ中一系列操作包括减压蒸馏、冷却结晶、抽滤、洗涤、真空干燥。蒸馏时减压的目的是_______ 。
(5)产品分析:称取1.000 g制备的试样,加入适量浓盐酸溶解,用还原剂除去 并将Fe3+还原成Fe2+,再除去过量还原剂,进行适当处理后用标准的氧化性试剂A进行滴定。
并将Fe3+还原成Fe2+,再除去过量还原剂,进行适当处理后用标准的氧化性试剂A进行滴定。
①用离子方程式表示加入浓盐酸,试样溶液中Fe2+变为Fe3+的原因:_______ 。
②若某同学用标准KMnO4溶液作为试剂A,测定结果总是偏大,试回答可能原因:_______ 。

已知:Fe(NO3)2·6H2O呈淡绿色,熔点为60.5℃,易溶于水。FeSO4·7H2O在60℃时溶解度最大,温度降低会结晶析出。
回答下列问题:
(1)步骤Ⅰ的目的是
(2)步骤Ⅱ的趁热过滤装置如图2所示,下列说法正确的是

A.漏斗颈要紧贴接受滤液的容器内壁,以加快过滤速度
B.漏斗颈要短,以免过滤时溶液在漏斗颈内停留过久,因散热降温析出晶体而堵塞
C.过滤前先用少量热溶剂润湿滤纸,以免干燥的滤纸吸附溶剂而使溶液浓缩析出晶体
(3)步骤Ⅲ的抽滤装置如图3所示,若转移BaSO4沉淀时,烧杯内壁残留少量沉淀,可用吸滤瓶中的滤液进行冲洗。冲洗操作的合理顺序为(填标号,下同)→

a.拔掉橡皮管 b.拔下布氏漏斗 c.将吸滤瓶倾斜支管口向上 d.将吸滤瓶倾斜支管口向下 e.从支管小心倒出滤液冲洗沉淀 f.从上口用玻璃棒引流部分滤液入烧杯
(4)步骤Ⅳ中一系列操作包括减压蒸馏、冷却结晶、抽滤、洗涤、真空干燥。蒸馏时减压的目的是
(5)产品分析:称取1.000 g制备的试样,加入适量浓盐酸溶解,用还原剂除去
 并将Fe3+还原成Fe2+,再除去过量还原剂,进行适当处理后用标准的氧化性试剂A进行滴定。
并将Fe3+还原成Fe2+,再除去过量还原剂,进行适当处理后用标准的氧化性试剂A进行滴定。①用离子方程式表示加入浓盐酸,试样溶液中Fe2+变为Fe3+的原因:
②若某同学用标准KMnO4溶液作为试剂A,测定结果总是偏大,试回答可能原因:
您最近一年使用:0次



