1 . 工业产生的废气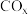 、
、 、
、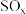 对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)光气 是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过
是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过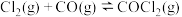 制备。图1为此反应的反应速率随温度变化的曲线,图2为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
制备。图1为此反应的反应速率随温度变化的曲线,图2为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
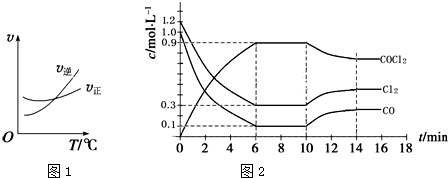
①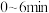 内,反应的平均速率
内,反应的平均速率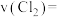
________ ;
② 改变的条件是
改变的条件是________ ,该反应平衡常数变化的趋势是________ (填“增大”、“减小”或“不变”)。
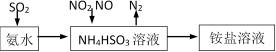
(2)利用氨水可以将 和
和 吸收,原理如下图所示:
吸收,原理如下图所示: 被吸收的离子方程式为
被吸收的离子方程式为________ 。
(3) 在自然界循环时可与
在自然界循环时可与 反应,
反应, 难溶于水,可溶于盐酸,请用平衡移动原理解释
难溶于水,可溶于盐酸,请用平衡移动原理解释 可溶于盐酸的原因
可溶于盐酸的原因________ 。
 、
、 、
、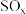 对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。(1)光气
 是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过
是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过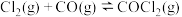 制备。图1为此反应的反应速率随温度变化的曲线,图2为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
制备。图1为此反应的反应速率随温度变化的曲线,图2为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
①
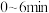 内,反应的平均速率
内,反应的平均速率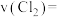
②
 改变的条件是
改变的条件是(2)利用氨水可以将
 和
和 吸收,原理如下图所示:
吸收,原理如下图所示: 被吸收的离子方程式为
被吸收的离子方程式为
(3)
 在自然界循环时可与
在自然界循环时可与 反应,
反应, 难溶于水,可溶于盐酸,请用平衡移动原理解释
难溶于水,可溶于盐酸,请用平衡移动原理解释 可溶于盐酸的原因
可溶于盐酸的原因
您最近一年使用:0次
真题
名校
2 . 二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如下图所示。下列叙述错误的是
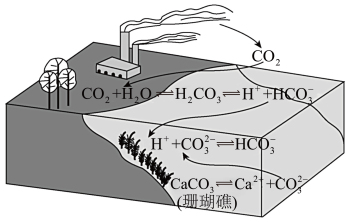

A.海水酸化能引起 浓度增大、 浓度增大、 浓度减小 浓度减小 |
| B.海水酸化能促进CaCO3的溶解,导致珊瑚礁减少 |
C.CO2能引起海水酸化,其原理为  H++ H++ |
| D.使用太阳能、氢能等新能源可改善珊瑚的生存环境 |
您最近一年使用:0次
2020-07-08更新
|
12120次组卷
|
48卷引用:上海市七宝中学2021届高三上学期期中考试化学试题
上海市七宝中学2021届高三上学期期中考试化学试题2020年全国统一考试化学试题(新课标Ⅱ)(已下线)专题10 水溶液中的离子平衡-2020年高考真题和模拟题化学分项汇编(已下线)专题01 STSE 化学用语-2020年高考真题和模拟题化学分项汇编(已下线)第06讲 离子反应 离子方程式(精讲)——2021年高考化学一轮复习讲练测甘肃省武威第六中学2021届高三上学期第三次过关考试化学试题河南省郑州市巩义市第四高级中学2021届高三上学期期中考试化学试题(已下线)专题07 电解质溶液——备战2021年高考化学纠错笔记(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)小题02 化学与社会生产生活环境(STSE)——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)第04讲 离子反应 离子方程式(精讲)-2022年一轮复习讲练测(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点32 化学反应条件的控制-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第4讲 离子反应 (讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)课时36 化学平衡及平衡移动-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考向24 弱电解质的电离平衡-备战2022年高考化学一轮复习考点微专题(已下线)专题10 化学反应速率与化学平衡-备战2022年高考化学学霸纠错(全国通用)江苏省徐州市王杰中学2021-2022学年高三10月学情调研化学试题(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)2020年全国卷Ⅱ化学真题变式题天津市部分区2021-2022学年高三上学期期末考试化学试题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点06 化学反应速率与化学平衡-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)湖南省娄底涟源市第一中学2022届高三下学期四月月考化学试题新疆喀什市普通高中2021-2022学年高三上学期期末考试化学试题(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第21讲 电离平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)陕西省富平县蓝光中学2021-2022学年高三上学期期末教学检测化学试题(已下线)第一部分 二轮专题突破 专题8 常见无机物性质的转化(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第八章 水溶液中的离子反应与平衡 第52讲 难溶电解质的溶解平衡(已下线)题型64 碳及其化合物的性质上海市华东政法大学附属中学2022-2023学年高二下学期期中考试(等级考)化学试题(已下线)第7讲 碳、硅及无机非金属材料(已下线)第5讲 难溶电解质的溶解平衡上海师范大学附属中学宝山分校2023-2024学年高二上学期12月阶段性测试 化学(等级)试题吉林省长春市实验中学2020-2021学年高二上学期开学考试化学试题河南省开封市铁路中学2020-2021学年高二下学期期中考试化学试题选择性必修1 专题3素养检测(已下线)3.1 电离平衡-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)湖北省蕲春县2021-2022学年高二上学期期中考试化学试题四川省内江市第六中学2021-2022学年高二下学期入学考试(创新班)化学试题江苏省南通市海安李堡中学2021-2022学年高二上学期期中考试化学试题广东省广州市第一中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
3 . 某同学为了验证难溶的氯化银在水中也存在溶解平衡,设计了如下实验方案:( )
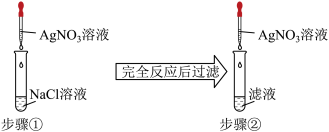

| A.步骤①中应加入过量的AgNO3溶液 |
| B.步骤①中应使NaCl溶液过量 |
| C.步骤②中现象是无沉淀产生 |
| D.步骤②中选用的AgNO3溶液浓度应小于步骤① |
您最近一年使用:0次
2020-04-03更新
|
220次组卷
|
2卷引用:2018年上海市高中学生化学竞赛(“华理一化工杯”)初赛试题
2012·上海虹口·二模
4 . 下列现象可以用勒夏特列原理解释的是
| A.高炉炼铁时焦炭和铁矿石要预先粉碎 |
| B.工业上在制盐酸的合成塔内往往输入过量氢气 |
| C.人们食用了酸性食品或碱性食品后,血液pH值仍稳定在7.4 ± 0.05 |
| D.在饱和硫酸铜溶液中放入胆矾晶体,几天后晶体外形发生改变,但质量未变 |
您最近一年使用:0次
2012·上海奉贤·二模
5 . 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为
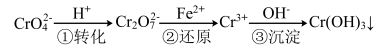
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显____________ 色.
(2)能说明第①步反应达平衡状态的是_____________ 。
a Cr2O72-和CrO42-的浓度相同 b 2v(Cr2O72-)=v(CrO42-)
c 溶液的颜色不变 d.溶液的pH值不变
(3)第②步中,还原0.01mol Cr2O72-离子,需要________ mol的FeSO4·7H2O。
(4)许多过渡(金属)元素的氢氧化物在水中有两种电离方式,Cr(OH)3在溶液中存在以下平衡:H+ + CrO2-(亮绿色)+H2O Cr(OH)3(s)
Cr(OH)3(s) Cr3+(紫色)+ 3OH-
Cr3+(紫色)+ 3OH-
下列有关说法中正确的是_______
a 加酸则平衡向右移动,则生成Cr3+盐,加碱则平衡向左移动,生成亚铬酸盐(CrO2-)
b 在一定条件下存在:Cr(OH)3+OH-=CrO2-+2H2O;Cr(OH)3+3H+=Cr3++3H2O
c Cr3+盐中加入NaOH溶液,先产生沉淀,后沉淀消失,溶液变成无色
d Cr(OH)3(固)在水中的存在叁个平衡

其中第①步存在平衡:2CrO42-(黄色)+2H+
 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O(1)若平衡体系的pH=2,则溶液显
(2)能说明第①步反应达平衡状态的是
a Cr2O72-和CrO42-的浓度相同 b 2v(Cr2O72-)=v(CrO42-)
c 溶液的颜色不变 d.溶液的pH值不变
(3)第②步中,还原0.01mol Cr2O72-离子,需要
(4)许多过渡(金属)元素的氢氧化物在水中有两种电离方式,Cr(OH)3在溶液中存在以下平衡:H+ + CrO2-(亮绿色)+H2O
 Cr(OH)3(s)
Cr(OH)3(s) Cr3+(紫色)+ 3OH-
Cr3+(紫色)+ 3OH-下列有关说法中正确的是
a 加酸则平衡向右移动,则生成Cr3+盐,加碱则平衡向左移动,生成亚铬酸盐(CrO2-)
b 在一定条件下存在:Cr(OH)3+OH-=CrO2-+2H2O;Cr(OH)3+3H+=Cr3++3H2O
c Cr3+盐中加入NaOH溶液,先产生沉淀,后沉淀消失,溶液变成无色
d Cr(OH)3(固)在水中的存在叁个平衡
您最近一年使用:0次
12-13高三上·上海·期末
解题方法
6 . 下列有关室温时电解质溶液的叙述可能 正确的是( )
| A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 |
| B.pH=a的强酸与pH=b的碱等体积混合后,溶液的pH=7 |
| C.稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小 |
| D.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
您最近一年使用:0次
名校
7 . 把氢氧化钙放入蒸馏水中,一定时间后达到如下平衡:Ca(OH)2(s)⇌Ca2++2OH-,如在其中加入少量CaO后,恢复到原温度,下列说法正确的是
| A.溶液的pH不变 | B.溶液质量不变 |
| C.溶质质量不变 | D.氢氧根浓度增大 |
您最近一年使用:0次
2014·上海奉贤·二模
8 . 对于难溶盐MX,其饱和溶液Mn+和Xn-的离子的物质的量浓度之间的关系近似于水的离子积Kw(Kw=[H+][OH-]),存在着[Mn+] [Xn-]=Ksp的关系(Ksp为常数).现将足量的AgCl固体分别放入下列物质中,AgCl的溶解度由大到小排列的顺序是
①20mL0.1mol/L(NH4)2CO3 溶液②40 mL 0.03 mol/LHCl ③50mL0.05mol/L AgNO3溶液 ④30mL0.02mol/ LCaCl2溶液 ⑤10 mL蒸馏水 ⑥30mL0.02mol/LNH4NO3溶液
①20mL0.1mol/L(NH4)2CO3 溶液②40 mL 0.03 mol/LHCl ③50mL0.05mol/L AgNO3溶液 ④30mL0.02mol/ LCaCl2溶液 ⑤10 mL蒸馏水 ⑥30mL0.02mol/LNH4NO3溶液
| A.⑤>②>④>③>⑥>① | B.①>⑥>⑤>②>④>③ |
| C.①>②>③>④>⑤>⑥ | D.③>②>④>⑥>①>⑤ |
您最近一年使用:0次
9 . 已知25℃时溶解度:AgCl> AgI,若在5 mL含有KCl和KI各为0.01mol/L的溶液中,加入8 mL 0.01 mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
| A.c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) | B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) | D.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
您最近一年使用:0次
10 . 饱和食盐水中加入碳酸氢铵可制备小苏打,滤出小苏打后,向母液中通入氨,再冷却、加食盐,过滤,得到氯化铵固体.下列分析错误的是( )
| A.该制备小苏打的方程式为:NaCl+NH4HCO3→NaHCO3↓+NH4Cl |
| B.母液中通入的氨气与HCO3﹣反应:NH3+HCO3﹣→CO32﹣+NH4+ |
| C.加食盐是为增大溶液中Cl﹣的浓度 |
| D.由题可知温度较低时,氯化铵的溶解度比氯化钠的大 |
您最近一年使用:0次



