名校
解题方法
1 . I.某酸H2A在水中的电离方程式是:H2A=H++HA-,HA-⇌H++A2-。回答下列问题:
(1)Na2A溶液显______ (填“酸性”“中性”或“碱性”),用离子方程式表示其原因________ 。
(2)在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是_______。
II.痛风是以关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下;
①HUr(尿酸,aq)⇌Ur-(尿酸根,aq)+H+(aq)(37℃时,Ka=4.0×10-6)
②NaUr(s)⇌Ur-(aq)+Na+(aq)
(3)37℃时,1.0L水中最多可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为________ 。
(4)关节炎发作多在脚趾和手指的关节处,当天气变冷时,关节炎变得严重,这说明温度降低时,尿酸钠的Ksp________ (填“增大”“减小”或“不变”),生成尿酸钠晶体的反应是_____ (填“放热”或“吸热”)反应。
(5)37℃时,某尿酸结石病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol·L-1,其中尿酸分子的浓度为5.0×10-4mol·L-1,该病人尿液的c(H+)为_______ ,pH______ 7(填“>”“=”或“<”)。
(1)Na2A溶液显
(2)在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是_______。
| A.c(A2-)+c(HA-)+c(H2A)=0.1mol·L-1 | B.c(OH-)=c(H+)+c(HA-)+2c(H2A) |
| C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-) | D.c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) |
II.痛风是以关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下;
①HUr(尿酸,aq)⇌Ur-(尿酸根,aq)+H+(aq)(37℃时,Ka=4.0×10-6)
②NaUr(s)⇌Ur-(aq)+Na+(aq)
(3)37℃时,1.0L水中最多可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为
(4)关节炎发作多在脚趾和手指的关节处,当天气变冷时,关节炎变得严重,这说明温度降低时,尿酸钠的Ksp
(5)37℃时,某尿酸结石病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol·L-1,其中尿酸分子的浓度为5.0×10-4mol·L-1,该病人尿液的c(H+)为
您最近一年使用:0次
名校
解题方法
2 . Ⅰ.(化学与生活)材料是人类赖以生存和发展的重要物质基础。
(1)生产水泥的主要原料是___________ 和___________ (填名称)。
(2)有机玻璃(聚甲基丙烯酸甲酯)实际上不是硅酸盐材料,而是一种___________ 。(选填“橡胶”或“纤维”或“塑料”)
(3)上海世博会中国馆用到一种涂料一氟碳涂层聚酯(FEP),它的单体为CF3—CF=CF2,这种涂料具有___________ (选填“热塑性”或“热固性”)。
(4)由聚氯乙烯等塑料垃圾引起的污染称为“___________ ”。
(5)玻璃钢具有耐腐蚀、质量轻、强度高的性能,它属于___________ 材料(选填“合金”或“复合”)。
Ⅱ.(化学反应原理)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(6)A为0.1mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小的顺序为___________ 。
(7)B为0.1mol·L-1的Na2CO3溶液,实验测得该溶液的pH___________ 7(填“>”“=”或“<”)
(8)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入盐酸,目的是___________ ;若把该溶液加热蒸干,得到的固体物质为___________ (填化学式)。
(9)D为含有足量AgCl固体的饱和溶液,请写出AgCl在水中存在溶解平衡的表达式:___________ 。
(1)生产水泥的主要原料是
(2)有机玻璃(聚甲基丙烯酸甲酯)实际上不是硅酸盐材料,而是一种
(3)上海世博会中国馆用到一种涂料一氟碳涂层聚酯(FEP),它的单体为CF3—CF=CF2,这种涂料具有
(4)由聚氯乙烯等塑料垃圾引起的污染称为“
(5)玻璃钢具有耐腐蚀、质量轻、强度高的性能,它属于
Ⅱ.(化学反应原理)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(6)A为0.1mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小的顺序为
(7)B为0.1mol·L-1的Na2CO3溶液,实验测得该溶液的pH
(8)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入盐酸,目的是
(9)D为含有足量AgCl固体的饱和溶液,请写出AgCl在水中存在溶解平衡的表达式:
您最近一年使用:0次
名校
解题方法
3 . 下列方程式书写错误的是
| A.Al(OH)3⇌A13++3OH- | B.Al(OH)3(s)⇌Al3+(aq)+3OH-(aq) |
C.BaSO4(s)⇌Ba2+(aq)+ (aq) (aq) | D.BaSO4⇌Ba2++ |
您最近一年使用:0次
2022-03-19更新
|
1951次组卷
|
7卷引用:河北省保定市部分学校2021-2022学年高二上学期第三次月考化学试题
名校
4 . AgCl和 的溶解度随温度变化的曲线如图所示,下列说法不正确的是
的溶解度随温度变化的曲线如图所示,下列说法不正确的是
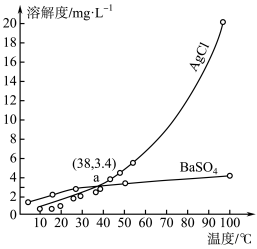
 的溶解度随温度变化的曲线如图所示,下列说法不正确的是
的溶解度随温度变化的曲线如图所示,下列说法不正确的是
A.a点时,AgCl和 饱和溶液的密度基本相同 饱和溶液的密度基本相同 |
| B.AgCl的溶解是吸热过程 |
C.常温时,向等体积的饱和AgCl和 溶液中分别加入足量的浓 溶液中分别加入足量的浓 溶液,析出 溶液,析出 沉淀的质量比AgCl多 沉淀的质量比AgCl多 |
D.可以用重结晶的方法分离AgCl和 |
您最近一年使用:0次
名校
5 . 把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(固)⇌Ca2++2OH-。当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是
| A.溶液中Ca2+数目减少 | B.溶液中c(Ca2+)增大 |
| C.溶液pH值减小 | D.溶液pH值增大 |
您最近一年使用:0次
名校
解题方法
6 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。
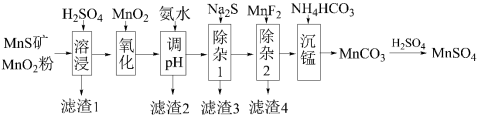
已知:①“滤渣1”含有S和 ;
;
②相关金属离子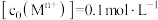 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)“氧化”中添加适量的 的作用是
的作用是________ 。
(2)“调pH”的目的是除铁和铝,则溶液的pH范围应调节为________ ~6之间。
(3)“除杂1”的目的是除去 和
和 ,“滤渣3”的主要成分是
,“滤渣3”的主要成分是________ 。
(4)“除杂2”的目的是生成 时沉淀除去
时沉淀除去 。该步骤维持溶液pH恒为4.0,若1 L溶液中
。该步骤维持溶液pH恒为4.0,若1 L溶液中 的初始浓度为0.1 mol/L,现欲将
的初始浓度为0.1 mol/L,现欲将 沉淀完全(即剩余离子浓度小于
沉淀完全(即剩余离子浓度小于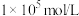 时),则需要加入的
时),则需要加入的 固体至少达到
固体至少达到________ mol( 为易溶的强电解质,忽略加入固体时溶液体积改变)。若溶液中酸度过高,
为易溶的强电解质,忽略加入固体时溶液体积改变)。若溶液中酸度过高, 沉淀不完全,原因是
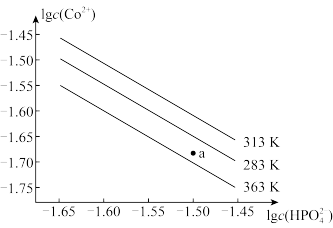
沉淀不完全,原因是________ 。(已知: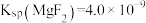 ;
; )
)
(5)写出“沉猛”的离子方程式:________ 。
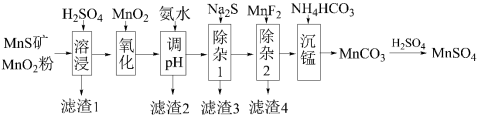
已知:①“滤渣1”含有S和
 ;
;②相关金属离子
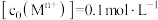 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:| 金属离子 |  |  |  |  |  |  |  |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“氧化”中添加适量的
 的作用是
的作用是(2)“调pH”的目的是除铁和铝,则溶液的pH范围应调节为
(3)“除杂1”的目的是除去
 和
和 ,“滤渣3”的主要成分是
,“滤渣3”的主要成分是(4)“除杂2”的目的是生成
 时沉淀除去
时沉淀除去 。该步骤维持溶液pH恒为4.0,若1 L溶液中
。该步骤维持溶液pH恒为4.0,若1 L溶液中 的初始浓度为0.1 mol/L,现欲将
的初始浓度为0.1 mol/L,现欲将 沉淀完全(即剩余离子浓度小于
沉淀完全(即剩余离子浓度小于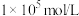 时),则需要加入的
时),则需要加入的 固体至少达到
固体至少达到 为易溶的强电解质,忽略加入固体时溶液体积改变)。若溶液中酸度过高,
为易溶的强电解质,忽略加入固体时溶液体积改变)。若溶液中酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是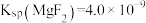 ;
; )
)(5)写出“沉猛”的离子方程式:
您最近一年使用:0次
2022-03-08更新
|
184次组卷
|
2卷引用:河南省范县第一中学等学校2021-2022学年高二上学期联考检测化学试题
名校
7 . CoHPO4在水中的沉淀溶解平衡曲线如图,下列说法正确的是

A.温度一定时,Ksp(CoHPO4)随c(HP ) 的增大而减小 ) 的增大而减小 |
| B.三个不同温度中,313 K时Ksp(CoHPO4)最大 |
| C.283 K时,图中a点对应的溶液是饱和溶液 |
| D.283 K下的CoHPO4饱和溶液升温到363 K后变为不饱和溶液 |
您最近一年使用:0次
2022-03-08更新
|
125次组卷
|
3卷引用:河南省范县第一中学等学校2021-2022学年高二上学期联考检测化学试题
8 .  时,AgX(X=Cl、Br)的溶度积与
时,AgX(X=Cl、Br)的溶度积与 和
和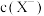 的相互关系如图所示,已知
的相互关系如图所示,已知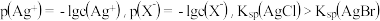 。下列说法不正确的是
。下列说法不正确的是
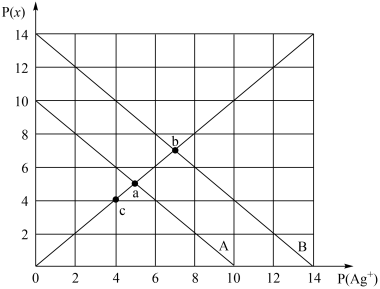
 时,AgX(X=Cl、Br)的溶度积与
时,AgX(X=Cl、Br)的溶度积与 和
和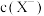 的相互关系如图所示,已知
的相互关系如图所示,已知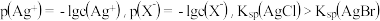 。下列说法不正确的是
。下列说法不正确的是
A. 点可表示 点可表示 的过饱和溶液,在此条件下会生成 的过饱和溶液,在此条件下会生成 沉淀 沉淀 |
B.反应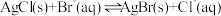 的平衡常数 的平衡常数 |
C.取 点的 点的 溶液和 溶液和 点 点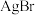 溶液等体积混合,会析出 溶液等体积混合,会析出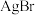 沉淀 沉淀 |
D. 点的 点的 溶液加入 溶液加入 晶体可以移到 晶体可以移到 点 点 |
您最近一年使用:0次
2022-03-04更新
|
87次组卷
|
2卷引用:湖北省石首市第一中学2021-2022学年高二上学期12月月考化学试题
名校
9 . 在25℃时,碳酸钙在水中的溶解平衡曲线如图所示,已知25℃硫酸钙的Ksp=9.1×10-6。下列说法错误的是

| A.通过蒸发,可使溶液由a点变化到c点 |
| B.图中b点碳酸钙的结晶速率大于其溶解速率 |
| C.除去锅炉水垢中硫酸钙的办法是将其转化为碳酸钙,然后用酸去除 |
D.在25℃时,反应CaSO4(s)+CO (aq)=CaCO3(s)+SO (aq)=CaCO3(s)+SO (aq)的平衡常数K=3250 (aq)的平衡常数K=3250 |
您最近一年使用:0次
10 . 铬酸银(Ag2CrO4)微溶于水。常用作分析试剂,有机合成催化剂,电镀, 卤化物滴定确定终点的指示剂等。在 t ℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp = 1.8×10−10。下列说法不正确的是
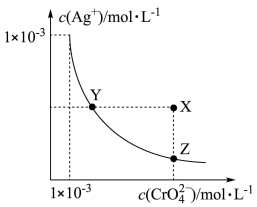

| A.t ℃时,Y点和Z点时Ag2CrO4的Ksp相等 |
| B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 |
| C.t ℃时,Ag2CrO4的Ksp为 1×10−9 |
D.t ℃时,将 0.01 mol·L−1AgNO3溶液滴入20 mL0.01mol·L−1KCl和 0.01 mol·L−1K2CrO4的混合溶液中,CrO 先沉淀 先沉淀 |
您最近一年使用:0次



