名校
1 . 某化学兴趣小组以含钴废渣(主要成分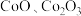 ,还含有
,还含有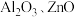 等杂质)为原料制备
等杂质)为原料制备 的一种实验流程如下。下列与流程相关的原理、装置和操作能达到实验目的的是
的一种实验流程如下。下列与流程相关的原理、装置和操作能达到实验目的的是
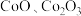 ,还含有
,还含有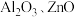 等杂质)为原料制备
等杂质)为原料制备 的一种实验流程如下。下列与流程相关的原理、装置和操作能达到实验目的的是
的一种实验流程如下。下列与流程相关的原理、装置和操作能达到实验目的的是
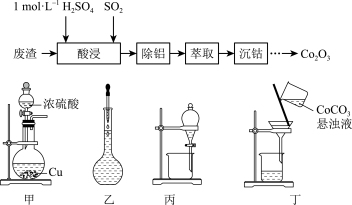
A.将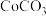 固体放入蒸发血中灼烧制 固体放入蒸发血中灼烧制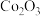 |
B.“酸浸”所需的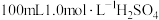 溶液用装置乙配制 溶液用装置乙配制 |
C.“萃取”的目的是除去 ,用装置丙,振荡时分液漏斗下口应倾斜向上 ,用装置丙,振荡时分液漏斗下口应倾斜向上 |
D.用装置甲制备“酸浸”所需的 ,“酸浸”时 ,“酸浸”时 为还原剂 为还原剂 |
您最近一年使用:0次
2023-12-18更新
|
299次组卷
|
3卷引用:江西省宜春市宜丰中学2023-2024学年高一上学期1月期末化学试题
名校
解题方法
2 . 由下列实验操作及现象,不能推出相应结论的是
| 操作 | 现象 | 结论 | |
| A | 往Fe2(SO4)3溶液中加入Cu片 | 溶液由棕色变为蓝色 | Fe3+的氧化能力比Cu2+强 |
| B | 向某溶液样品中加入浓NaOH溶液并加热,将湿润的红色石蕊试纸靠近试管口 | 试纸变蓝 | 溶液样品中含 |
| C | 常温下,向2mL0.1mol•L-1MgSO4溶液中加入2mL0.1mol•L-1NaOH溶液,再滴加5~6滴0.1mol•L-1CuSO4溶液 | 先产生白色沉淀,后部分白色沉淀变为蓝色 | 相同温度下Ksp:Cu(OH)2<Mg(OH)2 |
| D | 将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加KSCN溶液 | 溶液呈浅绿色 | 食品脱氧剂样品中没有+3价铁 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-03-30更新
|
354次组卷
|
3卷引用:江西省丰城中学2022-2023学年高一下学期4月期中考试化学试题
名校
3 . 龋齿是牙釉质溶解后病菌趁虚而入的结果。已知牙釉质的主要成分是羟磷灰石,口腔中存在如下平衡:
①羟磷灰石Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO
5Ca2+(aq)+3PO (aq)+OH(aq)
(aq)+OH(aq)
②氟磷灰石的化学式是Ca5(PO4)3F,Ca5(PO4)3F(s) 5Ca2+(aq)+3PO
5Ca2+(aq)+3PO (aq)+F(aq),
(aq)+F(aq),
氟磷灰石的溶解度比羟磷灰石小。下列有关说法中不正确的是
①羟磷灰石Ca5(PO4)3OH(s)
 5Ca2+(aq)+3PO
5Ca2+(aq)+3PO (aq)+OH(aq)
(aq)+OH(aq) ②氟磷灰石的化学式是Ca5(PO4)3F,Ca5(PO4)3F(s)
 5Ca2+(aq)+3PO
5Ca2+(aq)+3PO (aq)+F(aq),
(aq)+F(aq),氟磷灰石的溶解度比羟磷灰石小。下列有关说法中不正确的是
| A.一定条件下,羟磷灰石可以转化为氟磷灰石 |
| B.氟磷灰石可阻止龋齿的发生 |
| C.使用添加NaF等氟化物的牙膏可以防治龋齿 |
| D.当糖附着在牙齿上发酵时,会产生H+,所以多吃糖可以防治龋齿 |
您最近一年使用:0次
2023-03-27更新
|
283次组卷
|
3卷引用:江西省丰城中学2022-2023学年高一下学期4月期中考试化学试题
江西省丰城中学2022-2023学年高一下学期4月期中考试化学试题广东省深圳市龙华区2022-2023学年高二上学期期末质量检测化学试题(已下线)专题08 沉淀溶解平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)
名校
4 . 根据下列各图曲线表征的信息,得出的结论不正确的是
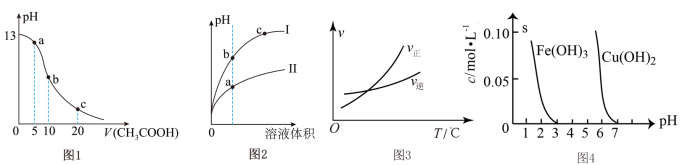

| A.图1表示常温下向体积为10 mL 0.1 mol·L−1NaOH溶液中逐滴加入0.1 mol·L−1CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH−) |
| B.图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a |
C.图3可判断可逆反应A(g)+3B(g)  2C(g)的∆H>0 2C(g)的∆H>0 |
| D.由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右 |
您最近一年使用:0次
名校
5 . “翠矾”(NiSO4·7H2O)在印染工业作媒染剂,生产酞菁艳蓝络合剂;氟镍化钾(K2NiF4)是结构化学研究的热点物质。以镍废渣(主要成分为Ni,含少量Fe、Al、Fe3O4、Al2O3和不溶性杂质等)为原料合成“翠矾”和氟镍化钾的流程如下:
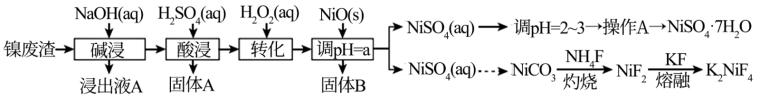
几种金属离子的氢氧化物沉淀pH如表:
请回答下列问题:
(1)“碱浸”过程中,为提高浸出率,可采取的措施是___________ (写一种即可)。
(2)“转化”过程中加入H2O2的目的是___________ (用离子方程式表示),经实验测定该过程温度高于40℃,转化率急速降低的原因可能是______________________ 。
(3)调节pH=a,其中a的取值范围是___________ 。
(4)写出“灼烧”NiCO3和NH4F的混合物时的化学反应方程式:___________ ,为避免污染环境,选择下列装置吸收尾气,最宜选择___________ (填选项)。
A. B.
B.
C.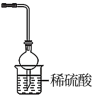 D.
D.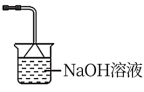

几种金属离子的氢氧化物沉淀pH如表:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 5.2 |
| Fe2+ | 7.6 | 9.7 |
| Ni2+ | 7.1 | 9.2 |
(1)“碱浸”过程中,为提高浸出率,可采取的措施是
(2)“转化”过程中加入H2O2的目的是
(3)调节pH=a,其中a的取值范围是
(4)写出“灼烧”NiCO3和NH4F的混合物时的化学反应方程式:
A.
 B.
B.
C.
 D.
D.
您最近一年使用:0次
2021-11-05更新
|
97次组卷
|
3卷引用:江西省赣州市赣县第三中学2022-2023学年高一上学期10月月考化学试题
名校
6 . 通过表中的相关数据,计算、分析、判断给出结论,题目所给数据和条件均为常温下:
(1)NH4F溶液显_______ 性。
(2)NH4HCO3 溶液与少量NaOH溶液反应时,_______ (填离子符号)先与 NaOH溶液中的OH-反应。
(3)①反应 CuS(s) + H2SO4(aq)⇌H2S(aq) + CuSO4(aq)的 K=_______ ;反应 FeS(s) + H2SO4(aq)⇌H2S(aq)+FeSO4 (aq)的 K= 3.9×103;
②反应 CuS(s)+Fe2+(aq)⇌FeS(s)+Cu2+(aq)的 K=_______ (以上计算结果均保留两位有效数字)。
③由计算结果可以知道实验室制备H2S气体应选用_______ ,检验H2S气体应选用_______ (均用上述反应中的盐类物质作答)
(4)除去废水中的Cu2+使用过量的FeS固体的优点有:
①可以除去废水中的Cu2+,过量的FeS和生成的CuS可以通过过滤一并除去;
②_______ 。
| NH3•H2O | Kb=1.8×10-5 |
| H2CO3 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
| HF | Ka=6.8×10-4 |
| H2S | Ka1=1.3×10-7 Ka2=7.1×10-15 |
| H2O | Kw=10-14 |
| Cu(OH)2 | Ksp=2.2×10-20 |
| Fe(OH)3 | Ksp=4.0×10-38 |
| CuS | Ksp=6.3×10-36 |
| FeS | Ksp=3.6×10-18 |
| 常用对数 | lg2=0.3 lg2.2=0.34 lg3=0.48 |
(1)NH4F溶液显
(2)NH4HCO3 溶液与少量NaOH溶液反应时,
(3)①反应 CuS(s) + H2SO4(aq)⇌H2S(aq) + CuSO4(aq)的 K=
②反应 CuS(s)+Fe2+(aq)⇌FeS(s)+Cu2+(aq)的 K=
③由计算结果可以知道实验室制备H2S气体应选用
(4)除去废水中的Cu2+使用过量的FeS固体的优点有:
①可以除去废水中的Cu2+,过量的FeS和生成的CuS可以通过过滤一并除去;
②
您最近一年使用:0次
名校
7 . 按要求填空。
(1)工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。回答下列问题:
为除去溶液中的Fe2+,可先加入_______ ,(从下面四个选项选择)将Fe2+氧化为Fe3+,反应的离子方程式为_______ ,然后加入适量的_______ (写化学式)调整溶液的pH使Fe3+转化为Fe(OH)3沉淀。
A.KMnO4 B.Cl2 C.浓硫酸 D.H2O2
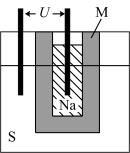
(2)如图为钠硫高能电池的结构示意图,该电池的工作温度为320 ℃左右,电池反应为2Na+xS=Na2Sx,正极的电极反应式为_______ 。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的_______ 倍。
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,当溶液pH=7时,溶液中各离子浓度由大到小的排列顺序是_______ 。
(1)工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。回答下列问题:
为除去溶液中的Fe2+,可先加入
A.KMnO4 B.Cl2 C.浓硫酸 D.H2O2
(2)如图为钠硫高能电池的结构示意图,该电池的工作温度为320 ℃左右,电池反应为2Na+xS=Na2Sx,正极的电极反应式为

(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,当溶液pH=7时,溶液中各离子浓度由大到小的排列顺序是
您最近一年使用:0次
8 . 常温下,几种铜盐的溶度积常数如下表所示:
下列说法正确的是
| 化合物 |  |  |  |  |  |
 | 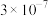 | 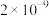 | 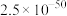 | 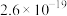 | 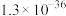 |
A.常温下,溶解度: |
B.向 悬浊液中加入 悬浊液中加入 溶液,碱性明显减弱 溶液,碱性明显减弱 |
C.反应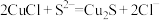 的平衡常数很大,反应趋于完全 的平衡常数很大,反应趋于完全 |
D.已知 在溶液中满足 在溶液中满足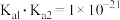 ,可判断 ,可判断 易溶于稀盐酸 易溶于稀盐酸 |
您最近一年使用:0次
2021-03-19更新
|
883次组卷
|
7卷引用:江西省景德镇一中2021-2022学年高一下学期期中质量检测(18)班化学试题
江西省景德镇一中2021-2022学年高一下学期期中质量检测(18)班化学试题广东省湛江市2021届高三下学期3月普通高考测试(一)化学试题(已下线)小题22 难溶电解质的溶解平衡——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)考点26 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考向27 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点微专题疑难压轴1 电解质溶液中“四大常数”的相关计算广东省茂名市高州市第一中学2021届高三下学期3月月考化学试题
9 . 已知常温下,Ksp(Ag2SO4)=2.0×10-5。取适量Ag2SO4溶于蒸馏水得到200 mL饱和溶液,在该饱和溶液中c(SO42-)=0.017 mol·L-1。向该饱和溶液中加入0.020 mol·L-1 Na2SO4溶液200 mL,得到溶液R。(不考虑混合后溶液体积的变化)下列说法正确的是
| A.R中c(Ag+)=2c(SO42-) |
| B.得到溶液R的过程中会产生沉淀 |
| C.R中c(Ag+)=0.017 mol·L-1 |
| D.加入Na2SO4溶液促进沉淀溶解平衡向左移动 |
您最近一年使用:0次
名校
解题方法
10 . 下列叙述中不正确的是
| A.对于阴阳离子个数比相同的难溶电解质,溶度积大的溶解度也大 |
| B.向含有Ca(OH)2固体的溶液中加入适量的水使Ca(OH)2溶解,又达到平衡时,Ca(OH)2的溶度积不变 |
| C.将难溶电解质放入纯水中,达到沉淀溶解平衡时,难溶电解质电离出的离子的浓度之积就是该难溶电解质的溶度积 |
| D.AgCl水溶液的导电性很弱,但AgCl是强电解质 |
您最近一年使用:0次
2020-04-29更新
|
72次组卷
|
2卷引用:江西省萍乡市莲花中学2019-2020高一下学期3月特色班月考化学试题



