名校
1 . 常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示,已知常温下Ksp(CaSO4)=9×10-6.下列说法正确的是

| A.升高温度曲线会往左下方移动 |
| B.b点加水可以变到b',且此时的Ksp(CaSO4)=9×10-6 |
| C.d点表示CaSO4的过饱和溶液 |
| D.加入Na2SO4(s),可以使溶液由c点变到a点 |
您最近一年使用:0次
名校
2 . 下列反应的离子方程式书写正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=2HClO+CO |
B.用纯碱溶液转化水垢中的CaSO4:CO (aq)+CaSO4(s)=SO (aq)+CaSO4(s)=SO (aq)+CaCO3(s) (aq)+CaCO3(s) |
C.磁性氧化铁溶于稀HNO3:Fe3O4+12H++NO =3Fe3++NO↑+6H2O =3Fe3++NO↑+6H2O |
D.电解MgCl2水溶液:2Cl-+2H2O 2OH-+Cl2↑+H2↑ 2OH-+Cl2↑+H2↑ |
您最近一年使用:0次
名校
3 . 电解质水溶液中存在电离平衡,水解平衡、沉淀溶解平衡。请回答下列问题:
(1)常温下,部分弱酸的电离平衡常数如表:
①等浓度 、
、 、
、 和
和 溶液中,碱性最强的是
溶液中,碱性最强的是___________ (写化学式)。
②等浓度的 与
与 混合溶液中离子浓度由大到小的顺序为
混合溶液中离子浓度由大到小的顺序为___________ 。
(2)室温下,用 盐酸溶液滴定
盐酸溶液滴定 氨水溶液,滴定曲线如图所示。
氨水溶液,滴定曲线如图所示。
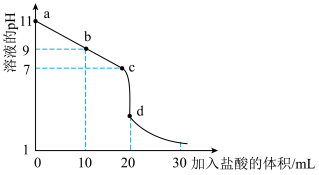
①该中和滴定选用___________ (填“甲基橙”或“酚酞”)作指示剂。
②室温下, 氨水溶液中
氨水溶液中 的电离平衡常数约为
的电离平衡常数约为___________ 
③b点所示的溶液中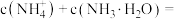
___________ (用溶液的其它离子浓度表示)。
(3)工业上向锅炉里注入所得到的 溶液浸泡,将水垢中的
溶液浸泡,将水垢中的 转化为
转化为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ 。当把水垢中 完全转化时,混合溶液中的
完全转化时,混合溶液中的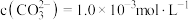 ,则
,则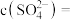
___________  (保留小数点后一位)。
(保留小数点后一位)。
已知: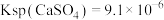 ,
,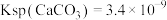
(1)常温下,部分弱酸的电离平衡常数如表:
| 弱酸 |  |  |  |
| 电离平衡常数 | 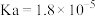 | 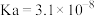 | 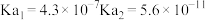 |
 、
、 、
、 和
和 溶液中,碱性最强的是
溶液中,碱性最强的是②等浓度的
 与
与 混合溶液中离子浓度由大到小的顺序为
混合溶液中离子浓度由大到小的顺序为(2)室温下,用
 盐酸溶液滴定
盐酸溶液滴定 氨水溶液,滴定曲线如图所示。
氨水溶液,滴定曲线如图所示。
①该中和滴定选用
②室温下,
 氨水溶液中
氨水溶液中 的电离平衡常数约为
的电离平衡常数约为
③b点所示的溶液中
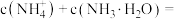
(3)工业上向锅炉里注入所得到的
 溶液浸泡,将水垢中的
溶液浸泡,将水垢中的 转化为
转化为 ,写出该反应的离子方程式:
,写出该反应的离子方程式: 完全转化时,混合溶液中的
完全转化时,混合溶液中的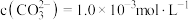 ,则
,则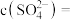
 (保留小数点后一位)。
(保留小数点后一位)。已知:
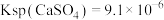 ,
,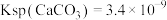
您最近一年使用:0次
名校
4 . 下列实验操作、现象及结论均正确的是
| 选项 | 实验操作及现象 | 结论 |
| A | 以 为电极,以酸化的 为电极,以酸化的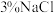 溶液作电解质溶液,连接成原电池装置,过一段时间,从 溶液作电解质溶液,连接成原电池装置,过一段时间,从 电极区域取少量溶液于试管中,再向试管中滴入2滴 电极区域取少量溶液于试管中,再向试管中滴入2滴 溶液,观察现象 溶液,观察现象 | 探究金属的电化学保护法 |
| B | 向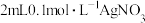 溶液中先滴加4滴 溶液中先滴加4滴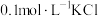 溶液,再滴加4滴 溶液,再滴加4滴 溶液。先产生白色沉淀,再产生黄色沉淀 溶液。先产生白色沉淀,再产生黄色沉淀 |  转化为 转化为 , , 溶解度小于 溶解度小于 溶解度 溶解度 |
| C | 向某溶液中滴加浓盐酸,将产生气体通入石蕊试液,溶液先变红后褪色 | 溶液中含有 或 或 |
| D | 室温下,测定浓度均为 的 的 与 与 溶液的 溶液的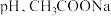 溶液的 溶液的 大 大 | 结合 的能力: 的能力: |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-07更新
|
83次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高二下学期开学考试化学试题(创新部)
5 . 常温下, 在水中的沉淀溶解平衡曲线如图所示,已知常温下
在水中的沉淀溶解平衡曲线如图所示,已知常温下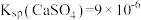 。下列说法正确的是
。下列说法正确的是
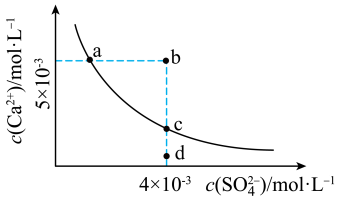
 在水中的沉淀溶解平衡曲线如图所示,已知常温下
在水中的沉淀溶解平衡曲线如图所示,已知常温下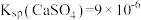 。下列说法正确的是
。下列说法正确的是
| A.升高温度曲线会往右上方移动 |
B.d点表示 的过饱和溶液,b点表示 的过饱和溶液,b点表示 的不饱和溶液 的不饱和溶液 |
C.b点加水可以变到如图的曲线上,且此时的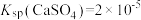 |
D.加入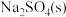 ,可以使溶液由c点变到a点 ,可以使溶液由c点变到a点 |
您最近一年使用:0次
名校
解题方法
6 . 高磷镍铁是生产钙镁磷肥的副产品。以高磷镍铁(主要含金属单质 、
、 、非金属单质P,还含有少量
、非金属单质P,还含有少量 、
、 、
、 的磷化物)为原料生产硫酸镍晶体
的磷化物)为原料生产硫酸镍晶体 的工艺流程如图。
的工艺流程如图。
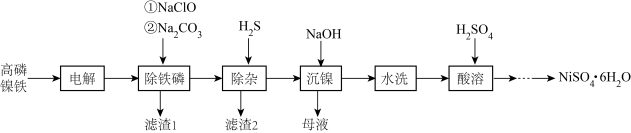
(1)“电解”时,选用 硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作
硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作___________ (填“阳极”或“阴极”);另一极的主要电极反应为:_____________________ 。此外,溶液中的 有部分在阴极放电。
有部分在阴极放电。
(2)“沉镍”时,离子方程式为___________________________________________ ,为确保镍沉淀完全,理论上应调节溶液
_____________ (已知:在该工业环境下, ;当溶液中离子浓度
;当溶液中离子浓度 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
(3)已知: 时,
时, 、
、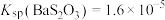 。向上述流程制得的
。向上述流程制得的 溶液中加入
溶液中加入 固体,充分反应后,过滤可得到
固体,充分反应后,过滤可得到 溶液。生成
溶液。生成 的化学方程式为
的化学方程式为________ 。
(4)从 溶液里获取
溶液里获取 的操作主要有:
的操作主要有:___________ 、__________ 、过滤、洗涤、干燥。
 、
、 、非金属单质P,还含有少量
、非金属单质P,还含有少量 、
、 、
、 的磷化物)为原料生产硫酸镍晶体
的磷化物)为原料生产硫酸镍晶体 的工艺流程如图。
的工艺流程如图。
(1)“电解”时,选用
 硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作
硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作 有部分在阴极放电。
有部分在阴极放电。(2)“沉镍”时,离子方程式为

 ;当溶液中离子浓度
;当溶液中离子浓度 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。(3)已知:
 时,
时, 、
、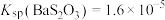 。向上述流程制得的
。向上述流程制得的 溶液中加入
溶液中加入 固体,充分反应后,过滤可得到
固体,充分反应后,过滤可得到 溶液。生成
溶液。生成 的化学方程式为
的化学方程式为(4)从
 溶液里获取
溶液里获取 的操作主要有:
的操作主要有:
您最近一年使用:0次
2024-03-01更新
|
109次组卷
|
2卷引用:江西省上饶市2023-2024学年高二上学期期末教学质量测试化学试卷
名校
7 . 化学与生产、生活息息相关。下列说法正确的是
| A.锅炉内壁安装镁合金防止受腐蚀,利用的是电解原理 |
| B.电子跃迁到激发态过程中释放能量产生紫色光,因此钾盐可用作紫色烟花的原料 |
| C.牙膏中添加氟化物用于预防龋齿是利用了氧化还原反应的原理 |
| D.食品袋中放入盛有硅胶和铁粉的透气小袋的目的是防止食物受潮、氧化 |
您最近一年使用:0次
2024-02-26更新
|
195次组卷
|
3卷引用:江西省宜春市宜丰中学2023-2024学年高二下学期3月月考化学试题
8 . 常温下,用 溶液分别滴定浓度均为
溶液分别滴定浓度均为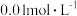 的
的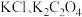 溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O
溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O 的水解)。其中Xn-表示
的水解)。其中Xn-表示 或
或 ,下列叙述错误的是
,下列叙述错误的是
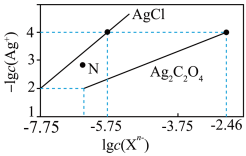
 溶液分别滴定浓度均为
溶液分别滴定浓度均为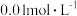 的
的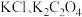 溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O
溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O 的水解)。其中Xn-表示
的水解)。其中Xn-表示 或
或 ,下列叙述错误的是
,下列叙述错误的是 
A.Ksp(Ag2C2O4)的数量级为 |
B. 点表示 点表示 的过饱和溶液 的过饱和溶液 |
C.向c(Cl-)=c(C2O )的混合溶液中滴入 )的混合溶液中滴入 溶液时,先生成 溶液时,先生成 沉淀 沉淀 |
D.常温下,Ag2C2O4(s)+2Cl-(aq) 2AgCl(s)+C2O 2AgCl(s)+C2O 的平衡常数为108.04 的平衡常数为108.04 |
您最近一年使用:0次
9 . 已知:常温下 ,
,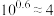 。向10
。向10 0.10
0.10
 溶液中滴加0.10
溶液中滴加0.10 的
的 溶液,滴加过程中
溶液,滴加过程中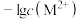 (M表示金属)与加入的溶液体积(V)的关系如图所示,下列说法正确的是
(M表示金属)与加入的溶液体积(V)的关系如图所示,下列说法正确的是
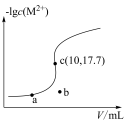
 ,
,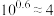 。向10
。向10 0.10
0.10
 溶液中滴加0.10
溶液中滴加0.10 的
的 溶液,滴加过程中
溶液,滴加过程中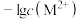 (M表示金属)与加入的溶液体积(V)的关系如图所示,下列说法正确的是
(M表示金属)与加入的溶液体积(V)的关系如图所示,下列说法正确的是
A.常温下,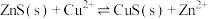 的平衡常数 的平衡常数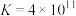 |
B.常温下, 饱和溶液中 饱和溶液中 的数量级为 的数量级为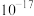 |
C.b点体系中, 的溶解速率大于其生成速率 的溶解速率大于其生成速率 |
D.若用 代替 代替 (其他不变),则c点应向下移动 (其他不变),则c点应向下移动 |
您最近一年使用:0次
2024-02-11更新
|
411次组卷
|
3卷引用:江西省宜春市宜丰中学2023-2024学年高二上学期1月月考化学试题
10 .  是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:
是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:
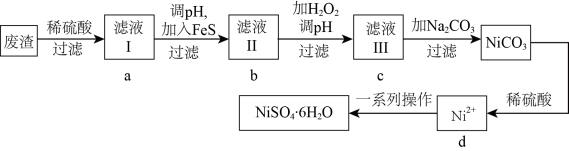
已知:各离子开始沉淀及完全沉淀时的 如表所示:
如表所示:
根据要求回答下列问题
(1)基态 原子核外电子的空间运动状态有
原子核外电子的空间运动状态有______________ 种,画出基态原子的价电子轨道表示式______________ 。
(2)向滤液Ⅰ中加入 固体是为了生成更难溶于水的硫化物沉淀而除去
固体是为了生成更难溶于水的硫化物沉淀而除去 、
、 等杂质,则除去
等杂质,则除去 的离子方程式为
的离子方程式为_______________________________________ ,当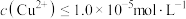 时,可认为
时,可认为 已沉淀完全,此时溶液中
已沉淀完全,此时溶液中 的浓度不小于
的浓度不小于_____________ 。[已知: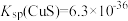 ]
]
(3)根据对滤液Ⅱ的操作作答:
①向滤液Ⅱ中加 的目的是将
的目的是将 氧化成
氧化成 ,试从结构的角度解释
,试从结构的角度解释 易被氧化为
易被氧化为 的原因
的原因__________________________ ;
②调节滤液Ⅱ的 ,
, 应控制在范围为
应控制在范围为__________________________ ;
③检验滤液Ⅲ中杂质金属离子是否除尽最合理的试剂是_______________________________________ 。
(4)滤液Ⅲ溶质的主要成分是 ,加
,加 过滤后得到
过滤后得到 固体,再加适量稀硫酸溶解又生成
固体,再加适量稀硫酸溶解又生成 ,这两步操作的目的是
,这两步操作的目的是_______________________________________ 。
 是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:
是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:
已知:各离子开始沉淀及完全沉淀时的
 如表所示:
如表所示:离子 | 开始沉淀时的 | 完全沉淀时的 |
| 6.3 | 9.7 |
| 2.2 | 3.2 |
| 6.4 | 8.4 |
(1)基态
 原子核外电子的空间运动状态有
原子核外电子的空间运动状态有(2)向滤液Ⅰ中加入
 固体是为了生成更难溶于水的硫化物沉淀而除去
固体是为了生成更难溶于水的硫化物沉淀而除去 、
、 等杂质,则除去
等杂质,则除去 的离子方程式为
的离子方程式为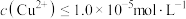 时,可认为
时,可认为 已沉淀完全,此时溶液中
已沉淀完全,此时溶液中 的浓度不小于
的浓度不小于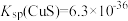 ]
](3)根据对滤液Ⅱ的操作作答:
①向滤液Ⅱ中加
 的目的是将
的目的是将 氧化成
氧化成 ,试从结构的角度解释
,试从结构的角度解释 易被氧化为
易被氧化为 的原因
的原因②调节滤液Ⅱ的
 ,
, 应控制在范围为
应控制在范围为③检验滤液Ⅲ中杂质金属离子是否除尽最合理的试剂是
(4)滤液Ⅲ溶质的主要成分是
 ,加
,加 过滤后得到
过滤后得到 固体,再加适量稀硫酸溶解又生成
固体,再加适量稀硫酸溶解又生成 ,这两步操作的目的是
,这两步操作的目的是
您最近一年使用:0次




