1 . 已知常温下 ,
,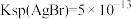 ,下列有关说法不正确的是
,下列有关说法不正确的是
 ,
,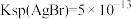 ,下列有关说法不正确的是
,下列有关说法不正确的是| A.在饱和AgCl、AgBr的混合溶液中: c(Cl-): c(Br-)=360 |
| B.AgCl在水中溶解度及Ksp均比在NaCl溶液中的小 |
| C.向AgCl悬浊液中滴加浓NaBr溶液会产生淡黄色沉淀 |
| D.在含有AgCl、AgBr固体悬浊液中加入少量NaBr固体,c(Cl-)增大 |
您最近一年使用:0次
名校
2 . 化学与社会、生产、生活密切相关,下列说法不正确的是
| A.可先用纯碱溶液处理锅炉水垢中的CaSO4 |
| B.在环保领域,碱性废水可利用烟道气中和 |
| C.生活中使用的泡沫灭火器是利用了硫酸铝和碳酸钠溶液水解的性质 |
| D.实验中常将FeCl3晶体溶于较浓盐酸中配制FeCl3溶液 |
您最近一年使用:0次
2022-04-09更新
|
62次组卷
|
2卷引用:江西省山江湖协作体2021-2022学年高二上学期联考(统招班)化学试题
10-11高二下·浙江杭州·期中
名校
解题方法
3 . 下列化学原理的应用,可以用沉淀溶解平衡原理来解释的是
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强
②误将钡盐[ 、
、 ]当作食盐食用后,常用0.5%的
]当作食盐食用后,常用0.5%的 溶液解毒
溶液解毒
③石灰岩(喀斯特地貌)溶洞的形成
④ 不能作“钡餐”,而
不能作“钡餐”,而 可以
可以
⑤泡沫灭火器灭火原理
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强
②误将钡盐[
 、
、 ]当作食盐食用后,常用0.5%的
]当作食盐食用后,常用0.5%的 溶液解毒
溶液解毒 ③石灰岩(喀斯特地貌)溶洞的形成
④
 不能作“钡餐”,而
不能作“钡餐”,而 可以
可以 ⑤泡沫灭火器灭火原理
| A.②③④ | B.①②③ | C.③④⑤ | D.①②③④⑤ |
您最近一年使用:0次
2022-04-06更新
|
1241次组卷
|
55卷引用:江西省遂川中学2021-2022学年高二上学期第二次月考化学(A卷)试题
江西省遂川中学2021-2022学年高二上学期第二次月考化学(A卷)试题(已下线)2010—2011学年浙江省杭州师范大学附属中学高二下学期期中考试化学试卷(已下线)2011-2012年山西省平遥中学高二上学期期中考试化学(理)试卷吉林省延边第二中学2017-2018学年高二上学期第二次月考化学试题2017-2018学年四川省乐山四校高二第二学期半期联考化学试题【全国百强校】河北省辛集中学2018-2019学年高二上学期期中考试化学试题(已下线)2019年1月7日 《每日一题》人教选修4-沉淀的生成与溶解【全国百强校】河北省冀州市中学2018-2019学年高二上学期第五次月考化学试题黑龙江省哈尔滨市第六中学2019-2020学年高二上学期期中考试化学试题北京市2019—2020学年高二上学期期中考试化学试题(选修4人教版)苏教版选修四化学反应原理专题3第四单元 难溶电解质的沉淀溶解平衡 同步检测试卷山西省太原市太原师范学院附属中学2019-2020学年高二上学期12月月考理科化学试题高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 课时1 溶解平衡及其应用(已下线)第3章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)河北省石家庄市辛集市第一中学2019-2020学年高二第二次考试(二)化学试题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡湖南省常德市淮阳中学2019-2020学年高二下学期期中考试化学试题(已下线)3.4 难溶电解质的溶解平衡(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)3.4.2 沉淀溶解平衡原理的应用(重点练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)湖北省武汉市钢城四中2020-2021学年高二上学期期中考试化学试题陕西省宝鸡市宝鸡中学2020-2021学年高二上学期阶段考试(一)化学试题山西省怀仁市第一中学云东校区2020-2021学年高二上学期第三次月考化学试题云南省永胜县第一中学2020-2021学年高二下学期6月份考试化学试题选择性必修1(SJ)专题3第四单元 沉淀溶解平衡课时1 沉淀溶解平衡及其应用(已下线)专题3.4.2 沉淀溶解平衡的应用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)北京市首都师范大学附属中学2021-2022学年高二上学期期中考试化学试题(已下线)必考点08 沉淀溶解平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)(已下线)3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)3.4.2 沉淀溶解平衡的应用(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)黑龙江省哈尔滨市第一六二中学2021-2022学年高二上学期期末考试化学试题(已下线)第10练 沉淀溶解平衡-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)(已下线)3.4.2 沉淀溶解平衡原理的应用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)黑龙江省大庆中学2021-2022学年高二下学期开学考试化学试题江苏省天一中学2021-2022学年高二上学期期末考试化学试题黑龙江省双鸭山市第一中学2021-2022学年高二下学期开学考试化学试题陕西省黄陵中学2021-2022学年高二上学期期中考试化学试题(已下线)第三章 水溶液中的离子反应与平衡(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)山西省太原师范学院附属中学2022-2023学年高二上学期12月月考化学试题新疆阿克苏市实验中学2022-2023学年高二上学期期末考试化学试题3.4.1沉淀溶解平衡原理 课后作业(二十一) 沉淀溶解平衡的应用河北省衡水中学2016-2017学年高一下学期三调考试化学试题2019年10月20日《每日一题》2020年高考化学一轮复习—— 每周一测(已下线)小题22 难溶电解质的溶解平衡——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)第26讲 难溶电解质的溶解平衡(精讲)-2022年一轮复习讲练测(已下线)第24讲 沉淀溶解平衡(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第26讲 难溶电解质的溶解平衡(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第24讲 沉淀溶解平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第24讲 沉淀溶解平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)山东省淄博市桓台第二中学2021-2022学年高一9月月考化学试题(已下线)第八章 水溶液中的离子反应与平衡 第52练 难溶电解质的溶解平衡(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)
4 . 氨是重要的基础化工原料,工业上常用于制备氨水、亚硝酸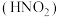 、连二次硝酸
、连二次硝酸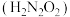 、尿素
、尿素 等多种含氮的化工产品。
等多种含氮的化工产品。
(1)已知: 时,连二次硝酸
时,连二次硝酸 的电离常数为
的电离常数为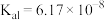 、
、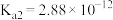 ;往
;往 溶液中滴加氢氧化钠溶液至
溶液中滴加氢氧化钠溶液至 ,
, 、
、 、离子浓度由大到小的顺序为
、离子浓度由大到小的顺序为___________ 。
(2)常温下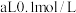 的
的 和
和 的
的 混合,混合后溶液呈中性,
混合,混合后溶液呈中性, 的电离常数为
的电离常数为___________ (用含a、b的式子表示)
(3)向浓度均为 的
的 和
和 混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中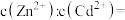
___________ 。[已知: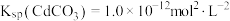 ,
,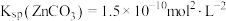 ]
]
可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为 ,沸点高难挥发)有一定关系。
,沸点高难挥发)有一定关系。
(4)羟基磷灰石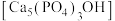 是牙釉质的主要成分,在唾液中存在平衡:
是牙釉质的主要成分,在唾液中存在平衡: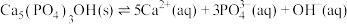 。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:
。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:___________
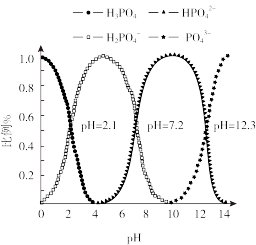
(5)常温下,向磷酸溶液中滴加 溶液,含磷微粒的分布比例与
溶液,含磷微粒的分布比例与 的关系如图所示。
的关系如图所示。 溶液显酸性,下列有关分析正确的是___________。
溶液显酸性,下列有关分析正确的是___________。
(6)联氨(又称联肼, 无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为:
无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为:____________ 平衡常数值为___________ (已知: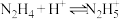 的
的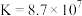 ;
;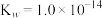 )。
)。
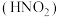 、连二次硝酸
、连二次硝酸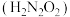 、尿素
、尿素 等多种含氮的化工产品。
等多种含氮的化工产品。(1)已知:
 时,连二次硝酸
时,连二次硝酸 的电离常数为
的电离常数为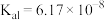 、
、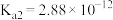 ;往
;往 溶液中滴加氢氧化钠溶液至
溶液中滴加氢氧化钠溶液至 ,
, 、
、 、离子浓度由大到小的顺序为
、离子浓度由大到小的顺序为(2)常温下
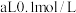 的
的 和
和 的
的 混合,混合后溶液呈中性,
混合,混合后溶液呈中性, 的电离常数为
的电离常数为(3)向浓度均为
 的
的 和
和 混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中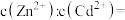
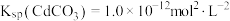 ,
,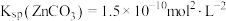 ]
]可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为
 ,沸点高难挥发)有一定关系。
,沸点高难挥发)有一定关系。(4)羟基磷灰石
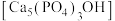 是牙釉质的主要成分,在唾液中存在平衡:
是牙釉质的主要成分,在唾液中存在平衡: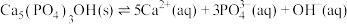 。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:
。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:(5)常温下,向磷酸溶液中滴加
 溶液,含磷微粒的分布比例与
溶液,含磷微粒的分布比例与 的关系如图所示。
的关系如图所示。 溶液显酸性,下列有关分析正确的是___________。
溶液显酸性,下列有关分析正确的是___________。
A.溶液中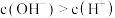 |
B. 的电离程度大于其水解程度 的电离程度大于其水解程度 |
C. c(Na+)+ c(H+)=c(H2PO )+2c(HPO )+2c(HPO )+3c(PO )+3c(PO )+c(OH—) )+c(OH—) |
| D.溶液中水的电离程度比纯水大 |
(6)联氨(又称联肼,
 无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为:
无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为: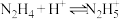 的
的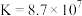 ;
;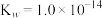 )。
)。
您最近一年使用:0次
名校
解题方法
5 . 化学与社会、生活密切相关。下列说法不正确的是
A.锅炉水垢中含有的 ,可先用 ,可先用 溶液处理,后用酸除去 溶液处理,后用酸除去 |
B.用 作沉淀剂,除去水中的 作沉淀剂,除去水中的 和 和 |
| C.疫苗一般应冷藏存放,以减小蛋白质变性的速率。 |
| D.在其他外界条件不变的情况下,汽车排气管中使用催化剂,可改变产生尾气的反应方向 |
您最近一年使用:0次
6 . 常温下,Ksp(MnS)=2.5×10-13,Ksp(FeS)=6.3×10-18。FeS和MnS在水中的沉淀溶解平衡曲线如图所示(X2+表示Fe2+或Mn2+),下列说法错误的是

| A.曲线Ⅱ表示MnS的沉淀溶解平衡曲线 |
| B.升高温度,曲线Ⅱ上的c点可沿虚线平移至e点 |
C.常温下,反应MnS(s)+Fe2+(aq) FeS(s)+Mn2+(aq)的平衡常数K≈4×104 FeS(s)+Mn2+(aq)的平衡常数K≈4×104 |
| D.向b点溶液中加入少量Na2S固体,溶液组成由b点沿Ⅰ线向a点方向移动 |
您最近一年使用:0次
2022-03-29更新
|
701次组卷
|
7卷引用:江西省宜春市铜鼓中学2021-2022学年高二下学期开学考化学试题
名校
7 . 室温下进行下列实验,根据实验操作和现象,所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 乙醇钠的水溶液呈强碱性 | C2H5O-结合H+的能力强 |
| B | 将某黄色溶液滴在KI淀粉试纸上,试纸变蓝 | 原溶液中一定含有Cl2 |
| C | 分别向等物质的量浓度的苯酚钠溶液和碳酸钠溶液中滴加酚酞,后者红色更深 | 酸性:碳酸强于苯酚 |
| D | 向盛有2mL一定浓度的Na3[Ag(S2O3)2]溶液的试管中,滴入5滴2mol•L-1的KI溶液,产生黄色沉淀 | [Ag(S2O3)2]3-具有较强的还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
8 . 某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下:

已知:有关金属离子生成氢氧化物沉淀所需的pH如下表:
(1)滤渣1的主要成分为_______ 。
(2)从滤液2中获得NiSO4∙6H2O的实验操作_______ 、_______ 、过滤、洗涤、干燥。
(3)用离子方程式解释加入H2O2的作用______ 。
(4)加NiO调节溶液的pH至3.2,则生成沉淀的离子方程式_______ 。
(5)电解浓缩后的滤液2可获得金属镍,其基本反应原理如图:

若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),能得到Ni______ g。

已知:有关金属离子生成氢氧化物沉淀所需的pH如下表:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀时pH | 1.5 | 3.6 | 7.3 | 7.0 | 9.6 |
| 完全沉淀时pH | 3.8 | 4.7 | 9.3 | 9.0 | 12.0 |
(1)滤渣1的主要成分为
(2)从滤液2中获得NiSO4∙6H2O的实验操作
(3)用离子方程式解释加入H2O2的作用
(4)加NiO调节溶液的pH至3.2,则生成沉淀的离子方程式
(5)电解浓缩后的滤液2可获得金属镍,其基本反应原理如图:

若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),能得到Ni
您最近一年使用:0次
名校
解题方法
9 . 表中实验操作、现象与结论对应关系均正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 等体积pH=2的两种酸HX和HY分别与足量的锌反应 | HX溶液中放出的H2多 | HX的酸性比HY强 |
| B | 用广泛pH试纸测定1mol/LNaHSO3溶液的酸碱性 | 测得pH=3.2 | NaHSO3溶液呈酸性,证明HSO 在水中的电离程度小于水解程度 在水中的电离程度小于水解程度 |
| C | 在KSCN与FeCl3的混合液中再加入KCl固体 | 溶液颜色变浅 | 增大生成物浓度,平衡逆向移动 |
| D | 向浓度均为0.1mol/L的NaCl和NaI的混合溶液中滴加少量0.1mol/L的AgNO3溶液 | 产生黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-16更新
|
683次组卷
|
8卷引用:江西省临川第二中学2022-2023学年高二上学期第三次月考化学试题
江西省临川第二中学2022-2023学年高二上学期第三次月考化学试题江西省宜春市宜丰中学2023-2024学年高二上学期10月月考化学试题辽宁省实验中学、大连八中、大连二十四中、鞍山一中、东北育才学校五校协作体2020-2021学年高二上学期期末化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二上学期期末考试化学试题湖南省永州市宁远县第一中学2022-2023学年高二上学期期中考试化学试题广东省江门市培英高级中学2022-2023学年高二上学期期中考试化学试题湖南省衡阳县2022-2023学年高二上学期期末考试化学试题广东省梅州市兴宁市沐彬中学2021-2022学年高二下学期期中考试化学试题
10 . 关于沉淀溶解平衡和溶度积常数,下列说法不正确的是
| A.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
| B.已知25℃时Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe(OH)3+3H+⇌Fe3++3H2O的平衡常数K=4.0×104 |
| C.将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]>Ksp(CaSO4) |
| D.已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,在MgCl2溶液中加入氨水调混合液的pH=11,产生沉淀,则此时溶液中的c(Mg2+)=1.8×10-5mol·L-1 |
您最近一年使用:0次
2022-03-10更新
|
491次组卷
|
3卷引用:江西省抚州市南城县第二中学2021-2022年高二上学期第二次月考化学试题



