1 . 常温下,难溶物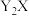 与ZX在水中的沉淀溶解平衡曲线如图所示,若定义其坐标图示,
与ZX在水中的沉淀溶解平衡曲线如图所示,若定义其坐标图示,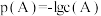 ,
, 表示
表示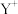 或
或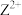 。下列说法错误的是
。下列说法错误的是
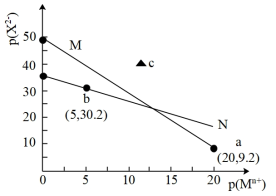
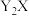 与ZX在水中的沉淀溶解平衡曲线如图所示,若定义其坐标图示,
与ZX在水中的沉淀溶解平衡曲线如图所示,若定义其坐标图示,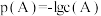 ,
, 表示
表示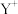 或
或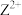 。下列说法错误的是
。下列说法错误的是
A.N表示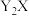 的溶解平衡曲线 的溶解平衡曲线 |
B.常温下,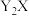 的分散系在c点时为悬浊液 的分散系在c点时为悬浊液 |
C.向b点溶液中加入 饱和溶液,析出ZX固体 饱和溶液,析出ZX固体 |
D.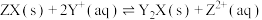 的平衡常数 的平衡常数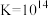 |
您最近一年使用:0次
2022-12-06更新
|
127次组卷
|
2卷引用:江西省丰城中学2022-2023学年高二下学期开学考试化学试题
名校
2 . 下列实验方案能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 证明 沉淀可以转化为 沉淀可以转化为 沉淀 沉淀 | 向 溶液中先加入3滴 溶液中先加入3滴 溶液,再加入3滴 溶液,再加入3滴 溶液 溶液 |
| B | 测定中和反应的反应热 | 酸碱中和滴定的同时,用温度传感器采集锥形瓶内溶液的温度 |
| C | 测定未知浓度的NaOH溶液 | 用甲基橙作指示剂,标准盐酸溶液滴定NaOH溶液时,当溶液颜色由黄色变为橙色,且半分钟内不视色即为滴定终点 |
| D | 验证可溶性MR为强酸强碱盐 | 25℃,测得可溶性正盐MR的 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-12-06更新
|
263次组卷
|
4卷引用:2023-2024学年高二化学下学期月考1试卷
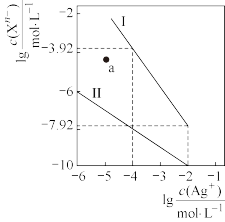
3 . 常温下,用 溶液分别滴定浓度均为
溶液分别滴定浓度均为 的
的 、
、 溶液,所得的沉淀溶解平衡图像如图所示。下列叙述错误的是
溶液,所得的沉淀溶解平衡图像如图所示。下列叙述错误的是
 溶液分别滴定浓度均为
溶液分别滴定浓度均为 的
的 、
、 溶液,所得的沉淀溶解平衡图像如图所示。下列叙述错误的是
溶液,所得的沉淀溶解平衡图像如图所示。下列叙述错误的是
A.曲线Ⅱ表示 溶解平衡曲线 溶解平衡曲线 |
B. 点表示的是 点表示的是 的不饱和溶液 的不饱和溶液 |
C.沉淀废液中的 用 用 溶液比等浓度的 溶液比等浓度的 溶液效果好 溶液效果好 |
D.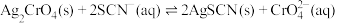 的平衡常数为 的平衡常数为 |
您最近一年使用:0次
2022-11-30更新
|
460次组卷
|
5卷引用:江西省赣州市重点中学六校2022-2023学年高二上学期期中联考化学试题
名校
解题方法
4 . 下列实验能达到预期目的的是
| 编号 | 实验内容 | 实验目的 |
| A | 取两支试管,分别加入4mL 0.01mol/L KMnO4酸性溶液,然后向一支试管中加入0.1mol/L H2C2O4溶液2mL,向另一支试管中加入0.1mol/L H2C2O4溶液4mL,记录褪色时间。 | 可以证明H2C2O4浓度越大反应速率越快。 |
| B | 向1mL0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀。 | 可以证明在相同温度下,溶解度Mg(OH)2>Fe(OH)3 |
| C | 测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大。 | 证明了非金属性S>C |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色会变浅。 | 可以证明Na2CO3溶液中存在水解平衡。 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 下列实验事实不能用平衡移动原理解释的是
| A.向pH=4的乙酸溶液稀释10倍后溶液pH<5 |
| B.相比较于常温,加热后的纯碱溶液去除厨房的油污的效果更好 |
C.对 平衡体系压缩容器后可使气体颜色变深 平衡体系压缩容器后可使气体颜色变深 |
| D.水垢中含有CaSO4,可先用Na2CO3溶液浸泡处理,而后用盐酸去除 |
您最近一年使用:0次
6 . 根据下列图示所得出的结论正确的是
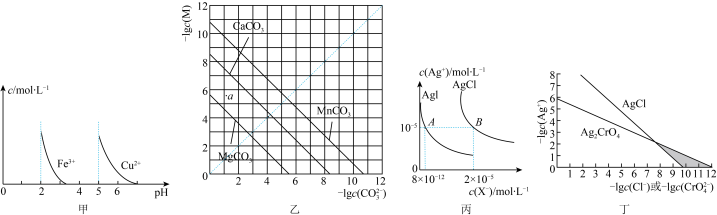

| A.由图甲可知,除去CuSO4溶液中的Fe3+可加入适量NaOH溶液调节pH至4左右 |
B.图乙是一定温度下三种碳酸盐的沉淀溶解平衡曲线,a点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO ) ) |
| C.图丙是室温下AgCl和AgI的饱和溶液中离子浓度的关系曲线,该温度下反应AgCl(s)+I-(aq)⇌AgI(s)+Cl-(aq)的平衡常数K=2.5×106 |
| D.图丁是室温下AgCl和Ag2CrO4的沉淀溶解平衡曲线,阴影区域中的点可以同时生成Ag2CrO4沉淀和AgCl沉淀 |
您最近一年使用:0次
2022-11-26更新
|
398次组卷
|
2卷引用:江西省新余市第一中学2022-2023高二上学期期末考试化学试题
名校
解题方法
7 . 根据下列实验操作和实验现象,得出的实验结论正确的是
| 实验操作 | 实验现象 | 实验结论 | |
| A | 常温下,分别测定0.01mol/L的NaHSO3溶液和0.01mol/L的NaHCO3溶液的pH值 | NaHCO3的pH值大 | 非金属性:S>C |
| B | 向某钠盐中滴加稀盐酸,将产生的无色气体通入品红溶液 | 品红溶液褪色 | 该钠盐可能为Na2S2O3 |
| C | 将 样品溶于稀硫酸,滴加KSCN溶液 样品溶于稀硫酸,滴加KSCN溶液 | 溶液变红 |  样品已变质 样品已变质 |
| D | 向盛有过量AgNO3溶液的试管中滴加少量NaCl溶液,再向其中滴加Na2CrO4溶液 | 先观察到白色沉淀,后产生砖红色沉淀 | AgCl沉淀可转化为更难溶的沉淀Ag2CrO4 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-26更新
|
268次组卷
|
2卷引用:江西省新余市第一中学2022-2023高二上学期期末考试化学试题
名校
解题方法
8 . 水溶液中的离子反应与平衡在工农业生产和日常生活中有着广泛的应用,下列说法错误的是
| A.明矾净水的原理与Al3+的水解有关 |
| B.用醋酸浸泡可以除去锅炉水垢中的CaSO4 |
| C.误服BaCl2或BaCO3后可用Na2SO4溶液解毒 |
D.长期使用 化肥的土壤酸性会增强 化肥的土壤酸性会增强 |
您最近一年使用:0次
2022-11-26更新
|
297次组卷
|
2卷引用:江西省新余市第一中学2022-2023高二上学期期末考试化学试题
22-23高二上·北京西城·期中
9 . 下列实验方案不能达到相应目的的是
| 目的 | A.验证Fe是否被氧化 | B.研究浓度对FeCl3水解平衡的影响 |
| 实验方案 | 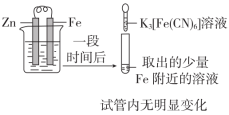 |  |
| 目的 | C.比较CH3COOH和H3BO3(硼酸,一元弱酸)酸性的强弱 | D.比较AgCl和AgI溶解度的大小 |
| 实验方案 |  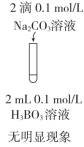 | 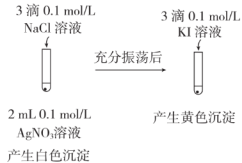 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
10 . 25°C时,向10mL0.05mol·L-1的MgCl2溶液中通入氨气,测得溶液中的p(OH-)与p(Mg2+)之间的变化曲线如图所示,[已知:Kb(NH3·H2O)=1.8×10-5,p(X)=-lgc(X),忽略反应过程中溶液体积的变化]。下列说法正确为是


A.a点溶液满足:c(NH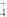 )>c(NH3·H2O)>c(Mg2+)>c(OH-) )>c(NH3·H2O)>c(Mg2+)>c(OH-) |
| B.b点溶液中无Mg(OH)2沉淀产生 |
C.c点溶液满足:2c(Mg2+)+c( )>c(Cl-) )>c(Cl-) |
| D.Ksp[Mg(OH)2]的数量级是10-12 |
您最近一年使用:0次
2022-10-27更新
|
427次组卷
|
3卷引用:江西省宜春市第一中学2022-2023学年高二上学期期末考试化学试题



