解题方法
1 . 某些可溶性氯化物中氯含量的测定常用莫尔法,即用 标准溶液滴定待测试液中的氯离子来确定氯化物的量。已知
标准溶液滴定待测试液中的氯离子来确定氯化物的量。已知 是白色沉淀,
是白色沉淀,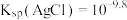 ,
, 是砖红色沉淀,
是砖红色沉淀,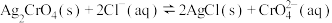 的平衡常数
的平衡常数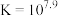 ,下列说法
,下列说法不正确 的是
 标准溶液滴定待测试液中的氯离子来确定氯化物的量。已知
标准溶液滴定待测试液中的氯离子来确定氯化物的量。已知 是白色沉淀,
是白色沉淀,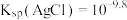 ,
, 是砖红色沉淀,
是砖红色沉淀,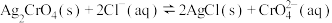 的平衡常数
的平衡常数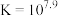 ,下列说法
,下列说法A. |
B.在等浓度的 和 和 混合溶液中,滴加 混合溶液中,滴加 溶液先产生砖红色沉淀 溶液先产生砖红色沉淀 |
C.在 的悬浊液中滴加 的悬浊液中滴加 溶液可能会产生砖红色沉淀 溶液可能会产生砖红色沉淀 |
D.莫尔法选用 作指示剂,滴定终点时出现砖红色沉淀且半分钟不变 作指示剂,滴定终点时出现砖红色沉淀且半分钟不变 |
您最近一年使用:0次
解题方法
2 . 溴化亚铜可用作工业催化剂,是一种白色粉末,微溶于冷水,不溶于乙醇等有机溶剂,在热水中或见光都会分解,在空气中会慢慢氧化成绿色粉末。制备CuBr的实验步骤如下:___________ 。
(2)下列说法不正确的是___________(填字母)。
(3)判断反应已完成的简单方法:___________ 。
(4)欲利用上述装置烧杯中的吸收液(经检测主要含Na2SO3、NaHSO3等)制取较纯净的Na2SO3·7H2O晶体。从下列选项中选择最佳操作并排序:___________ 。
⑨→___________→⑥→___________→___________→③→⑦
①蒸发浓缩至出现大量晶体 ②蒸发浓缩至出现晶膜,冷却结晶 ③乙醇洗涤2~3次 ④热水洗涤2~3次 ⑤过滤 ⑥加入少量维生素C溶液(抗氧化剂) ⑦真空干燥 ⑧烧杯中加入100 g 20%的NaOH溶液 ⑨烧杯中通入SO2至饱和
(5)某荧光材料可测CuBr的纯度。已知荧光强度比值与Cu2+在一定浓度范围内的关系如图。取0.1000 mg CuBr粗产品,经预处理,将其中Cu元素全部转化为Cu2+并定容至1 L。取样1 mL测得荧光强度比值为10.7,则制得CuBr的纯度为___________ 。

(2)下列说法不正确的是___________(填字母)。
| A.实验过程中可加少量还原Fe粉防止CuBr被氧化 |
| B.多孔玻璃泡可以增大气体与溶液的接触面积,起到充分反应目的 |
| C.防止CuBr见光分解,步骤3过滤需避光进行 |
| D.洗涤时,为防止CuBr被氧化需用玻璃棒快速搅拌多次以加快洗涤速度 |
(3)判断反应已完成的简单方法:
(4)欲利用上述装置烧杯中的吸收液(经检测主要含Na2SO3、NaHSO3等)制取较纯净的Na2SO3·7H2O晶体。从下列选项中选择最佳操作并排序:
⑨→___________→⑥→___________→___________→③→⑦
①蒸发浓缩至出现大量晶体 ②蒸发浓缩至出现晶膜,冷却结晶 ③乙醇洗涤2~3次 ④热水洗涤2~3次 ⑤过滤 ⑥加入少量维生素C溶液(抗氧化剂) ⑦真空干燥 ⑧烧杯中加入100 g 20%的NaOH溶液 ⑨烧杯中通入SO2至饱和
(5)某荧光材料可测CuBr的纯度。已知荧光强度比值与Cu2+在一定浓度范围内的关系如图。取0.1000 mg CuBr粗产品,经预处理,将其中Cu元素全部转化为Cu2+并定容至1 L。取样1 mL测得荧光强度比值为10.7,则制得CuBr的纯度为

您最近一年使用:0次
3 . 下表是常温下 的电离常数和
的电离常数和 的溶度积常数,下列推断正确的是
的溶度积常数,下列推断正确的是
 的电离常数和
的电离常数和 的溶度积常数,下列推断正确的是
的溶度积常数,下列推断正确的是 |  |  |  |
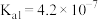 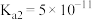 |  |  |  |
A.误饮 的溶液会引起钡中毒,需用一定浓度的 的溶液会引起钡中毒,需用一定浓度的 溶液给钡中毒者洗胃解毒 溶液给钡中毒者洗胃解毒 |
B.由 粉末和水形成的 粉末和水形成的 饱和溶液中, 饱和溶液中, |
C.由 粉末和水形成的 粉末和水形成的 饱和溶液常温下pH约为9.6,则溶液中存在: 饱和溶液常温下pH约为9.6,则溶液中存在: |
D. 的 的 溶液,可将 溶液,可将 完全转化为 完全转化为 |
您最近一年使用:0次
4 . 某小组以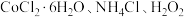 、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为测定其组成,进行如下实验。如图为氨的测定装置(已省略加热和夹持装置)
、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为测定其组成,进行如下实验。如图为氨的测定装置(已省略加热和夹持装置)
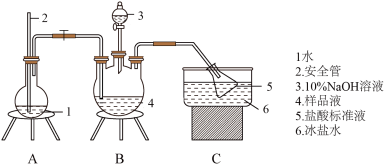
①氨的测定:准确称取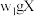 ,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量
,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量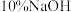 溶液,通入水蒸气,将样品液中的氨全部蒸出,用
溶液,通入水蒸气,将样品液中的氨全部蒸出,用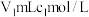 的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,滴加指示剂,用
的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,滴加指示剂,用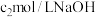 标准溶液滴定过剩的
标准溶液滴定过剩的 ,到终点时消耗
,到终点时消耗 溶液。
溶液。
②氯的测定:准确称取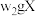 ,配成溶液后移取
,配成溶液后移取 于锥形瓶中,调
于锥形瓶中,调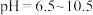 ,滴加指示剂
,滴加指示剂 溶液。在不断摇动下,用
溶液。在不断摇动下,用 标准溶液滴定至终点。(
标准溶液滴定至终点。( 为砖红色)
为砖红色)
回答下列问题:
(1)下列说法不正确 的是___________。
(2)滴定前,有关滴定管的正确操作为___________ (选出正确操作并按序排列)。
检漏→蒸馏水洗涤 开始滴定。
开始滴定。
A.烘干
B.装入滴定液至“0”刻度以上 处
处
C.调整滴定液液面至“0”刻度或“0”刻度以下
D.用洗耳球吹出润洗液
E.排除气泡
F.用滴定液润洗2至3次
G.记录起始读数
(3)氯的测定过程中,滴定终点的现象是___________ 。当溶液中的 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于 )时,溶液中
)时,溶液中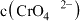 为
为___________  (保留两位有效数字)。已知
(保留两位有效数字)。已知 时,
时, 。
。
(4)测定 过程中,溶液
过程中,溶液 过低会使
过低会使 浓度降低,不能形成沉淀来指示终点。用相关的离子方程式解释
浓度降低,不能形成沉淀来指示终点。用相关的离子方程式解释 过低使
过低使 浓度降低的原因
浓度降低的原因___________ 。
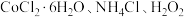 、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为测定其组成,进行如下实验。如图为氨的测定装置(已省略加热和夹持装置)
、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为测定其组成,进行如下实验。如图为氨的测定装置(已省略加热和夹持装置)
①氨的测定:准确称取
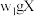 ,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量
,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量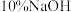 溶液,通入水蒸气,将样品液中的氨全部蒸出,用
溶液,通入水蒸气,将样品液中的氨全部蒸出,用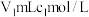 的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,滴加指示剂,用
的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,滴加指示剂,用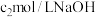 标准溶液滴定过剩的
标准溶液滴定过剩的 ,到终点时消耗
,到终点时消耗 溶液。
溶液。②氯的测定:准确称取
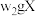 ,配成溶液后移取
,配成溶液后移取 于锥形瓶中,调
于锥形瓶中,调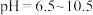 ,滴加指示剂
,滴加指示剂 溶液。在不断摇动下,用
溶液。在不断摇动下,用 标准溶液滴定至终点。(
标准溶液滴定至终点。( 为砖红色)
为砖红色)回答下列问题:
(1)下列说法
| A.安全管的作用是:当A中压力过大时,安全管中液面上升,使A瓶中压力稳定 |
| B.氨的测定过程中,滴定终点时仰视读数,氨的测定含量将偏高 |
| C.氨的测定接近终点时的“半滴操作”是:轻轻挤压玻璃珠下方的橡皮管,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,再用洗瓶以少量蒸馏水吹洗锥形瓶内壁 |
| D.氯的测定过程中,使用棕色滴定管的原因是防止硝酸银见光分解 |
(2)滴定前,有关滴定管的正确操作为
检漏→蒸馏水洗涤
 开始滴定。
开始滴定。A.烘干
B.装入滴定液至“0”刻度以上
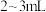 处
处C.调整滴定液液面至“0”刻度或“0”刻度以下
D.用洗耳球吹出润洗液
E.排除气泡
F.用滴定液润洗2至3次
G.记录起始读数
(3)氯的测定过程中,滴定终点的现象是
 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于 )时,溶液中
)时,溶液中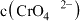 为
为 (保留两位有效数字)。已知
(保留两位有效数字)。已知 时,
时, 。
。(4)测定
 过程中,溶液
过程中,溶液 过低会使
过低会使 浓度降低,不能形成沉淀来指示终点。用相关的离子方程式解释
浓度降低,不能形成沉淀来指示终点。用相关的离子方程式解释 过低使
过低使 浓度降低的原因
浓度降低的原因
您最近一年使用:0次
名校
5 .  是一种有毒的重金属离子,常使用
是一种有毒的重金属离子,常使用 处理以降低其毒性。已知:
处理以降低其毒性。已知:




现向 的
的 溶液中不断滴加入
溶液中不断滴加入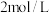 的
的 溶液至溶液体积加倍,下列说法不正确的是
溶液至溶液体积加倍,下列说法不正确的是
 是一种有毒的重金属离子,常使用
是一种有毒的重金属离子,常使用 处理以降低其毒性。已知:
处理以降低其毒性。已知:



现向
 的
的 溶液中不断滴加入
溶液中不断滴加入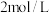 的
的 溶液至溶液体积加倍,下列说法不正确的是
溶液至溶液体积加倍,下列说法不正确的是A.  |
B.将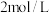 的 的 溶液改为 溶液改为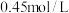 的 的 溶液则现象为生成沉淀并且沉淀不消失 溶液则现象为生成沉淀并且沉淀不消失 |
| C.该实验的现象为先生成沉淀,随后沉淀消失 |
D.随着不断加入 溶液,溶液的 溶液,溶液的 不断升高 不断升高 |
您最近一年使用:0次
解题方法
6 . 下列方案设计、现象和结论不正确的是
方案设计 | 现象 | 结论 | |
A | 向2支盛有2mL相同浓度的银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一支试管中产生黄色沉淀,另一支试管中无明显现象 | 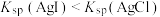 |
B | 验证压强对平衡的影响 | 先将注射器充满 气体,然后将活塞往里推压缩体积,观察到注射器内气体颜色加深 气体,然后将活塞往里推压缩体积,观察到注射器内气体颜色加深 | 增大压强,平衡向生成 的方向移动 的方向移动 |
C | 向沸水中逐滴加5~6滴饱和 溶液,持续煮沸 溶液,持续煮沸 | 溶液先变成红褐色再析出沉淀 |  先水解得 先水解得 胶体,再聚集成 胶体,再聚集成 沉淀。 沉淀。 |
D | 往碘的 溶液中加入等体积浓KI溶液,振荡 溶液中加入等体积浓KI溶液,振荡 | 分层,下层由紫红色变为浅粉红色,上层呈棕黄色 | 碘在浓KI溶液中的溶解能力大于在 中的溶解能力 中的溶解能力 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
7 . 化学与人类生产、生活密切相关,下列说法中正确的是
| A.镀锌的铁板其镀层破损后,铁的腐蚀会比纯铁的腐蚀快 |
| B.牙膏中添加氟化物用于预防龋齿是利用了氧化还原反应的原理 |
| C.燃料电池的反应物不是储存在电池内部,而是由外部供给,两电极材料可以相同 |
| D.工业废水处理过程中,常以Na2S作沉淀剂除去废水中的Cu2+、Hg2+、Fe3+等 |
您最近一年使用:0次
名校
解题方法
8 . 下列实验方案设计、现象和结论都正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 探究Ksp(BaSO4)和Ksp(CaSO4)大小 | 室温下,向浓度均为0.1mol·L−1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液 | 出现白色沉淀,说明Ksp(BaSO4)<Ksp(CaSO4) |
| B | 比较CH3COO−、CN−结合H+能力的大小 | 室温下,用pH试纸分别测量0.1mol·L−1CH3COONa溶液和0.1mol·L−1NaCN溶液的pH | 测得CH3COONa溶液和NaCN溶液的pH分别为9和11,说明CN−结合H+的能力更强 |
| C | 探究浓度对平衡的影响 | 向试管中加入2mL0.1mol·L−1K2Cr2O7溶液(橙色),滴加5~10滴6mol·L−1NaOH溶液 | 溶液由黄色变为橙色,说明加入氢氧化钠溶液后平衡向生成CrO 的方向移动 的方向移动 |
| D | 比较Fe与Cu的金属性强弱 | 形态相同的Fe与Cu放入浓硝酸中 | Cu反应产生气体的速率更快,证明金属性:Cu>Fe |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-13更新
|
142次组卷
|
2卷引用:浙江省台州市三门启超中学2023-2024学年高二上学期期中考试化学试题
名校
9 . 探究铜及其化合物的性质,下列方案设计、现象和结论都正确的是
实验方案 | 现象 | 结论 | |
A | 向 浓度均为 浓度均为 的 的 、 、 混合溶液中加入 混合溶液中加入 溶液 溶液 | 出现蓝色沉淀 | 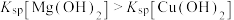 |
B | 取适量硫酸铜粉末溶于水,再向溶液中加入足量浓氨水 | 硫酸铜粉末溶解后显蓝色,加足浓氨水后得到深蓝色溶液 | 氨分子结合铜离子能力强于水分子 |
C | 将铜和浓硫酸反应后的混合物倒入盛有稀盐酸、 混合溶液的烧杯中 混合溶液的烧杯中 | 产生大量白色沉淀 | 说明铜和浓硫酸反应后有硫酸剩余 |
D | 取一段未打磨的铝条,伸入稀 溶液 溶液 | 铝条表面出现紫红色固体 | 铝活泼性比铜强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
10 . 研究海洋中珊瑚礁(主要成分CaCO3)的形成机制及其影响具有重要意义,相关主要反应有:
反应Ⅰ:CO2(aq)+H2O(l)
 (aq)+H+(aq) K1=4.5×10-7
(aq)+H+(aq) K1=4.5×10-7
反应Ⅱ: (aq)
(aq)
 (aq)+H+(aq) K2= 4.7×10-11
(aq)+H+(aq) K2= 4.7×10-11
反应Ⅲ:CaCO3(s) Ca2+(aq)+
Ca2+(aq)+ (aq) K3=3.4×10-9
(aq) K3=3.4×10-9
请回答:
(1)珊瑚礁形成的总反应可表示为Ca2+(aq)+2 (aq)=CaCO3(s)+CO2(aq)+H2O(l)。有利于珊瑚礁形成的环境是
(aq)=CaCO3(s)+CO2(aq)+H2O(l)。有利于珊瑚礁形成的环境是_______ (填“温暖海域”或“冰冷海域”),该反应的平衡常数K=_______ (用K1、K2、K3表示)。
(2)海水的pH为8.0~8.3,下列有关珊瑚礁形成过程的叙述中正确的是_______。
(3)温室气体CO2的浓度上升,会导致海水酸化,促使珊瑚礁的溶解。科学家模拟海洋环境探究不同温度下海水中CO2浓度与 浓度间的关系。已知T1℃下测得c(CO2)与c(
浓度间的关系。已知T1℃下测得c(CO2)与c( )的关系如图,请画出T2℃(T2>T1)时c(
)的关系如图,请画出T2℃(T2>T1)时c( )随c(CO2)的变化趋势
)随c(CO2)的变化趋势_______ 。_______ 0(填“>”“<”或“=”);随温度的升高,容器中CO2的浓度在T3温度下出现最低值的原因是_______ 。
反应Ⅰ:CO2(aq)+H2O(l)

 (aq)+H+(aq) K1=4.5×10-7
(aq)+H+(aq) K1=4.5×10-7反应Ⅱ:
 (aq)
(aq)
 (aq)+H+(aq) K2= 4.7×10-11
(aq)+H+(aq) K2= 4.7×10-11反应Ⅲ:CaCO3(s)
 Ca2+(aq)+
Ca2+(aq)+ (aq) K3=3.4×10-9
(aq) K3=3.4×10-9请回答:
(1)珊瑚礁形成的总反应可表示为Ca2+(aq)+2
 (aq)=CaCO3(s)+CO2(aq)+H2O(l)。有利于珊瑚礁形成的环境是
(aq)=CaCO3(s)+CO2(aq)+H2O(l)。有利于珊瑚礁形成的环境是(2)海水的pH为8.0~8.3,下列有关珊瑚礁形成过程的叙述中正确的是_______。
A.海水中最主要的含碳微粒为 |
B.海水中的c(Ca2+)>c( )+c( )+c( ) ) |
C. 、 、 的水解反应是海水呈弱碱性的主要原因 的水解反应是海水呈弱碱性的主要原因 |
D.珊瑚礁形成的反应阻碍了 的电离 的电离 |
(3)温室气体CO2的浓度上升,会导致海水酸化,促使珊瑚礁的溶解。科学家模拟海洋环境探究不同温度下海水中CO2浓度与
 浓度间的关系。已知T1℃下测得c(CO2)与c(
浓度间的关系。已知T1℃下测得c(CO2)与c( )的关系如图,请画出T2℃(T2>T1)时c(
)的关系如图,请画出T2℃(T2>T1)时c( )随c(CO2)的变化趋势
)随c(CO2)的变化趋势

您最近一年使用:0次



