1 . 已知pAg+=−lgc(Ag+),pX−=−lgc(X−)。某温度下,AgBr、AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是


| A.a和c两点的Kw相同 |
| B.Ksp(AgBr)=1.0×10−14 |
| C.向饱和AgCl溶液中加入NaCl固体,可使a点变到e点 |
D.AgCl(s)+Br−(aq)  AgBr (s)+Cl−(aq)平衡常数K= AgBr (s)+Cl−(aq)平衡常数K= |
您最近一年使用:0次
解题方法
2 . 常温下,CaCO3和CaF2的沉淀溶解平衡曲线如图[ pX=-lgc(Xn-)、pCa=-lgc( Ca2+)],已知Ksp( CaCO3)>Ksp( CaF2),下列说法正确的是
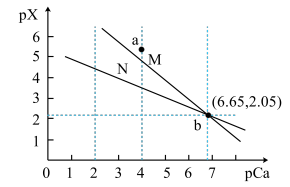

| A.曲线M为CaF2的沉淀溶解平衡曲线 |
B.常温下,CaCO3(s) +2F-(aq)  CaF2(s) + CaF2(s) +  (aq)的化学平衡常数K= 10-2.05 (aq)的化学平衡常数K= 10-2.05 |
C.在CaCl2溶液中加碳酸钠溶液,当溶液中c( )的浓度大于1. 0 ×10-3时,可以确定Ca2+沉淀完全 )的浓度大于1. 0 ×10-3时,可以确定Ca2+沉淀完全 |
| D.a点为悬浊液,过滤可得固体 |
您最近一年使用:0次
3 . 常温下,难溶物Y2X与ZX在水中的沉淀溶解平衡曲线如图所示,若定义其坐标图示:p(A)=--lgc(A),Mn+表示Y+或Z2+。下列说法错误的是
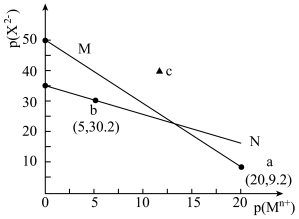

| A.N表示ZX的溶解平衡曲线 |
| B.常温下,Y2X的分散系在c点时为悬浊液 |
| C.向b点溶液中加入Na2X饱和溶液,析出ZX固体 |
D.ZX(s)+2Y+(aq) Y2X(s)+Z2+(aq)的平衡常数K=1014 Y2X(s)+Z2+(aq)的平衡常数K=1014 |
您最近一年使用:0次
4 . 在2 mL物质的量浓度相等的NaCl和NaI溶液中滴入几滴AgNO3溶液,发生的反应为
| A.只有AgCl沉淀生成 | B.只有AgI沉淀生成 |
| C.生成等物质的量的AgCl和AgI沉淀 | D.两种沉淀都有,但以AgI为主 |
您最近一年使用:0次
2023-04-11更新
|
334次组卷
|
4卷引用:新疆生产建设兵团第二师八一中学2022-2023学年高二下学期期末考试化学试题
名校
5 . 过氧化钙是一种比较稳定的金属过氧化物,它的氧化反应缓和,安全无毒,可用于环保、食品及化学工业。利用大理石制过氧化钙的实验步骤如下:
一、制取纯的
①称取5g大理石,溶于 硝酸溶液中,充分反应后,将溶液加热至沸腾;
硝酸溶液中,充分反应后,将溶液加热至沸腾;
②在①溶液中加50mL水稀释,加氨水调节溶液至弱碱性后再煮沸,趁热过滤,弃去沉淀;
③在②滤液中加入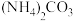 溶液,搅拌后静置,减压过滤,洗涤,干燥得到
溶液,搅拌后静置,减压过滤,洗涤,干燥得到 固体。
固体。
二、制取
④将新制的 置于烧杯中,逐滴加入
置于烧杯中,逐滴加入 盐酸,直到剩余极少量
盐酸,直到剩余极少量 固体为止,将溶液煮沸,趁热过滤,保留滤液;
固体为止,将溶液煮沸,趁热过滤,保留滤液;
⑤另取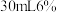
 溶液,与
溶液,与 氨水混合,制得
氨水混合,制得 溶液;
溶液;
⑥将④、⑤中的溶液置于冰水中冷却后,再混合,并将混合液置于冰水中放置30min;
⑦减压过滤,洗涤,干燥,得到 晶体。
晶体。
回答下列问题
(1)①中配置 硝酸溶液,需要用量筒量取
硝酸溶液,需要用量筒量取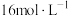 浓硝酸
浓硝酸___________ mL。
(2)下列仪器中,属于②中“趁热过滤”所需的仪器是___________ 。过滤时,“趁热”的目的是___________ ,大理石中常含有Fe、Al等杂质元素,则沉淀的主要成分是___________ (填化学式)。缺少步骤②,对后续实验造成的影响是___________ 。

(3)⑥中发生反应的化学方程式是___________ ,氨水的作用是___________ 。
(4)⑦中“减压过滤”的优点是___________ ,产品可用___________ 洗涤。
(5)对产品 (相对分子质量为216)进行热重分析,得到数据如图。400℃时,得到的产品的化学式是
(相对分子质量为216)进行热重分析,得到数据如图。400℃时,得到的产品的化学式是___________ 。

一、制取纯的

①称取5g大理石,溶于
 硝酸溶液中,充分反应后,将溶液加热至沸腾;
硝酸溶液中,充分反应后,将溶液加热至沸腾;②在①溶液中加50mL水稀释,加氨水调节溶液至弱碱性后再煮沸,趁热过滤,弃去沉淀;
③在②滤液中加入
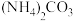 溶液,搅拌后静置,减压过滤,洗涤,干燥得到
溶液,搅拌后静置,减压过滤,洗涤,干燥得到 固体。
固体。二、制取

④将新制的
 置于烧杯中,逐滴加入
置于烧杯中,逐滴加入 盐酸,直到剩余极少量
盐酸,直到剩余极少量 固体为止,将溶液煮沸,趁热过滤,保留滤液;
固体为止,将溶液煮沸,趁热过滤,保留滤液;⑤另取
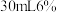
 溶液,与
溶液,与 氨水混合,制得
氨水混合,制得 溶液;
溶液;⑥将④、⑤中的溶液置于冰水中冷却后,再混合,并将混合液置于冰水中放置30min;
⑦减压过滤,洗涤,干燥,得到
 晶体。
晶体。回答下列问题
(1)①中配置
 硝酸溶液,需要用量筒量取
硝酸溶液,需要用量筒量取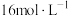 浓硝酸
浓硝酸(2)下列仪器中,属于②中“趁热过滤”所需的仪器是

(3)⑥中发生反应的化学方程式是
(4)⑦中“减压过滤”的优点是
(5)对产品
 (相对分子质量为216)进行热重分析,得到数据如图。400℃时,得到的产品的化学式是
(相对分子质量为216)进行热重分析,得到数据如图。400℃时,得到的产品的化学式是
您最近一年使用:0次
2023-08-15更新
|
265次组卷
|
2卷引用:新疆乌鲁木齐市等3地2022-2023学年高三上学期第一次联考(一模)化学试题
6 . 已知: ,常温下向
,常温下向 溶液中滴加
溶液中滴加 溶液的滴定曲线如图所示。已知:
溶液的滴定曲线如图所示。已知: 。下列说法正确的是
。下列说法正确的是

 ,常温下向
,常温下向 溶液中滴加
溶液中滴加 溶液的滴定曲线如图所示。已知:
溶液的滴定曲线如图所示。已知: 。下列说法正确的是
。下列说法正确的是
A. 、 、 、 、 三点的 三点的 从大到小的顺序为 从大到小的顺序为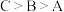 |
B.在 点的溶液中存在 点的溶液中存在 |
C.常温下,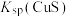 为 为 |
D.其他条件相同,若将 溶液换为同浓度、同体积的 溶液换为同浓度、同体积的 溶液,B点会平行向右移动 溶液,B点会平行向右移动 |
您最近一年使用:0次
2022-12-23更新
|
491次组卷
|
8卷引用:新疆昌吉回族自治州奇台县第一中学2022-2023学年高二上学期期末考试化学试题
新疆昌吉回族自治州奇台县第一中学2022-2023学年高二上学期期末考试化学试题河南省洛阳市2022-2023学年高三上学期期末测试化学试题河南省洛阳市2022-2023学年高三上学期普高联考测评(三)化学试题(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(11-20)湖北省部分重点中学(武汉市,十堰市,襄阳市,恩施土家族苗族自治州)2022-2023学年高二下学期三月智学联合检测化学试题安徽省淮北市第一中学2022-2023学年高二下学期第二次月考化学试题(已下线)选择题11-16云南省曲靖市第一中学2023-2024学年高二上学期11月期中考试化学试题
7 . 化学平衡移动原理,同样也适用于其他平衡
(1)已知在氨水中存在下列平衡:NH3+H2O NH3·H2O
NH3·H2O NH
NH +OH-,向氨水中加入MgCl2固体时,平衡向
+OH-,向氨水中加入MgCl2固体时,平衡向_______ 移动,OH-的浓度_______ ,向浓氨水中加入少量NaOH固体,平衡向_______ 移动,此时发生的现象是_______ 。
(2)氯化铁水解的离子方程式为_______ ,向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其离子方程式为_______ ,同时有红褐色沉淀生成,其原因是_______ 。
(3)向Mg(OH)2的悬浊液中加入NH4Cl溶液,现象_______ ,原因为_______
(1)已知在氨水中存在下列平衡:NH3+H2O
 NH3·H2O
NH3·H2O NH
NH +OH-,向氨水中加入MgCl2固体时,平衡向
+OH-,向氨水中加入MgCl2固体时,平衡向(2)氯化铁水解的离子方程式为
(3)向Mg(OH)2的悬浊液中加入NH4Cl溶液,现象
您最近一年使用:0次
8 . Ⅰ.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005mg/L。处理含镉废水可采用化学沉淀法。试回答下列问题:
(1)磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式为Ksp=_______ 。
(2)向某含镉废水中加入Na2S,当浓度达到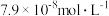 时,废水中
时,废水中 的浓度为
的浓度为_______ mol/L[已知: ,Cd的相对原子质量为112],此时是否符合生活饮用水卫生标准?
,Cd的相对原子质量为112],此时是否符合生活饮用水卫生标准?_______ (填“是”或“否”)。
Ⅱ.根据题目提供的溶度积数据进行计算并回答下列问题:
(3)25℃,向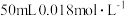 的硝酸银溶液中加入
的硝酸银溶液中加入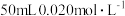 的盐酸,生成沉淀。已知该温度下,AgCl的
的盐酸,生成沉淀。已知该温度下,AgCl的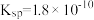 ,忽略溶液的体积变化,请计算:
,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=_______ 。
②完全沉淀后,溶液pH=_______ 。
③如果向完全沉淀后的溶液中继续加入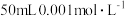 盐酸,
盐酸,_______ (“是”或“否”)有白色沉淀生成?
(1)磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式为Ksp=
(2)向某含镉废水中加入Na2S,当浓度达到
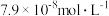 时,废水中
时,废水中 的浓度为
的浓度为 ,Cd的相对原子质量为112],此时是否符合生活饮用水卫生标准?
,Cd的相对原子质量为112],此时是否符合生活饮用水卫生标准?Ⅱ.根据题目提供的溶度积数据进行计算并回答下列问题:
(3)25℃,向
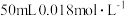 的硝酸银溶液中加入
的硝酸银溶液中加入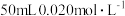 的盐酸,生成沉淀。已知该温度下,AgCl的
的盐酸,生成沉淀。已知该温度下,AgCl的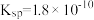 ,忽略溶液的体积变化,请计算:
,忽略溶液的体积变化,请计算:①完全沉淀后,溶液中c(Ag+)=
②完全沉淀后,溶液pH=
③如果向完全沉淀后的溶液中继续加入
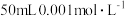 盐酸,
盐酸,
您最近一年使用:0次
2022-09-23更新
|
273次组卷
|
3卷引用:新疆阿克苏市实验中学2022-2023学年高二上学期第二次月考(12月)化学试题
解题方法
9 . 锌是一种应用广泛的金属。一种以闪锌矿(主要成分为ZnS,还含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
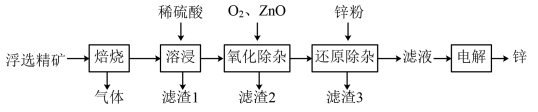
相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如表:
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为____ 。
(2)滤渣1的主要成分除SiO2外还有____ 。
(3)氧化除杂工序中通入氧气的作用是____ ,ZnO的作用是____ 。
(4)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为____ 。为什么不能省去“还原除杂”步骤,直接在“氧化除杂”步骤中除去Cd2+____ 。
(5)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为____ ;沉积锌后的电解液可返回___ 工序继续使用。
(6)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质,“氧压酸浸”中发生的主要反应的离子方程式为____ 。

相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如表:
| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
(1)焙烧过程中主要反应的化学方程式为
(2)滤渣1的主要成分除SiO2外还有
(3)氧化除杂工序中通入氧气的作用是
(4)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为
(5)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为
(6)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质,“氧压酸浸”中发生的主要反应的离子方程式为
您最近一年使用:0次
解题方法
10 . 常温下,某研究小组用数字传感器探究AgSCN的沉淀溶解平衡(AgSCN是白色沉淀)。实验测得悬浊液中溶解的SCN-浓度变化如图所示,其中a点表示AgSCN溶于KNO3溶液形成的悬浊液。下列说法不正确的是


| A.图中b点可能是加少量水稀释了 |
| B.图中c点后有黄色沉淀生成 |
| C.图中d点c(Ag+)<c(SCN-) |
| D.由图可知:Ksp(AgI)<Ksp(AgSCN) |
您最近一年使用:0次



