解题方法
1 . 实现废钨——镍型加氢催化剂(主要成分为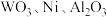 ,还含有
,还含有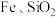 和少量含
和少量含 有机物)中有价值金属回收的工艺流程如下。
有机物)中有价值金属回收的工艺流程如下。 ,纯碱不与
,纯碱不与 反应。
反应。
ⅱ.相关金属离子[c0(Mn+)=0.1mol/L]形成氢氧化物沉淀的 范围如下:
范围如下:
回答下列问题:
(1)28Ni位于元素周期表的第__________ 周期、__________ 族。
(2)“氧化”的目的为__________ 和将金属单质氧化至相应价态。
(3)“钠化焙烧”中生成 的化学方程式为
的化学方程式为__________ 。
(4)“酸化沉钨”后过滤,所得滤饼的主要成分为__________ (填化学式)。
(5)“调 ”除铁和铝,溶液的
”除铁和铝,溶液的 范围应调节为
范围应调节为__________ 。
(6)资料显示,硫酸镍结晶水合物的形态与温度有如表关系。
“一系列操作”依次是__________ 、及时过滤、洗涤、干燥。
(7)强碱溶液中NaClO氧化NiSO4,可沉淀出用作电池正极材料的NiOOH,该反应的离子方程式为__________ 。
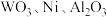 ,还含有
,还含有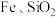 和少量含
和少量含 有机物)中有价值金属回收的工艺流程如下。
有机物)中有价值金属回收的工艺流程如下。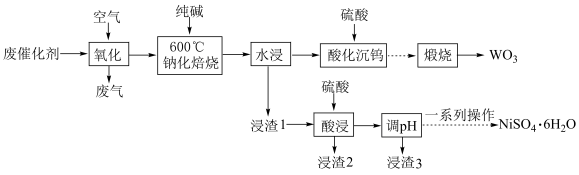
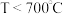 ,纯碱不与
,纯碱不与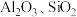 反应。
反应。ⅱ.相关金属离子[c0(Mn+)=0.1mol/L]形成氢氧化物沉淀的
 范围如下:
范围如下:| 金属离子 | Ni2+ | Al3+ | Fe3+ |
| 开始沉淀时的pH | 6.9 | 3.4 | 1.5 |
| 沉淀完全时的pH | 8.9 | 4.7 | 2.8 |
(1)28Ni位于元素周期表的第
(2)“氧化”的目的为
(3)“钠化焙烧”中生成
 的化学方程式为
的化学方程式为(4)“酸化沉钨”后过滤,所得滤饼的主要成分为
(5)“调
 ”除铁和铝,溶液的
”除铁和铝,溶液的 范围应调节为
范围应调节为(6)资料显示,硫酸镍结晶水合物的形态与温度有如表关系。
| 温度 | 低于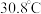 |  | 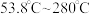 | 高于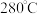 |
| 晶体形态 |  |  | 多种结晶水合物 |  |
(7)强碱溶液中NaClO氧化NiSO4,可沉淀出用作电池正极材料的NiOOH,该反应的离子方程式为
您最近一年使用:0次
2 . 常温下,在含HgI2(s)的溶液中,一定c(I-)范围内,存在平衡关系:HgI2(s)  HgI2(aq);HgI2(aq)
HgI2(aq);HgI2(aq)  Hg2+(aq)+2I-(aq); HgI2(aq)
Hg2+(aq)+2I-(aq); HgI2(aq)  HgI+(aq)+I-(aq);HgI2(aq) +I-(aq)
HgI+(aq)+I-(aq);HgI2(aq) +I-(aq) 
 (aq);HgI2(aq) +2I-(aq)
(aq);HgI2(aq) +2I-(aq) 
 (aq),平衡常数依次为K0、K1、K2、K3、K4。已知
(aq),平衡常数依次为K0、K1、K2、K3、K4。已知 、
、 、
、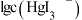 、
、 随
随 的变化关系如图所示,下列说法错误的是
的变化关系如图所示,下列说法错误的是
 HgI2(aq);HgI2(aq)
HgI2(aq);HgI2(aq)  Hg2+(aq)+2I-(aq); HgI2(aq)
Hg2+(aq)+2I-(aq); HgI2(aq)  HgI+(aq)+I-(aq);HgI2(aq) +I-(aq)
HgI+(aq)+I-(aq);HgI2(aq) +I-(aq) 
 (aq);HgI2(aq) +2I-(aq)
(aq);HgI2(aq) +2I-(aq) 
 (aq),平衡常数依次为K0、K1、K2、K3、K4。已知
(aq),平衡常数依次为K0、K1、K2、K3、K4。已知 、
、 、
、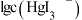 、
、 随
随 的变化关系如图所示,下列说法错误的是
的变化关系如图所示,下列说法错误的是
A. |
B.线 表示 表示 的变化情况 的变化情况 |
C.随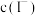 的增大, 的增大, 保持不变 保持不变 |
D.溶液中 元素和 元素和 元素的物质的量之比始终为 元素的物质的量之比始终为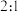 |
您最近一年使用:0次
解题方法
3 . I.污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)~CCl4,分离污水中的Cu2+时,先发生络合反应:Cu2++2H2Dz Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
(1)污水显蓝色是因为四水合铜离子,其空间结构为___________ 。
(2)写出双硫腙和Fe3+络合的离子方程式:___________ 。萃取过程中要控制适宜的酸度。如果溶液的pH过大,其后果是___________ 。
Ⅱ.下图是用双硫腙(H2Dz)~CC14络合萃取某些金属离子的酸度曲线。它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式被萃取分离的百分率。
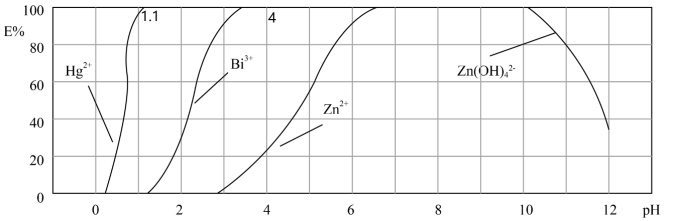
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)~CC14络合萃取法处理废水。请根据上图回答问题:
(3)欲完全将废水中的Hg2+分离出来,须控制溶液pH为___________ 。
(4)当调节pH=2时,铋(Bi)的存在形式有:___________ ,其物质的量之比为___________ 。
(5)萃取到CCl4中的Zn(HDz)2分液后,加入足量的NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式:___________ 。
 Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。(1)污水显蓝色是因为四水合铜离子,其空间结构为
(2)写出双硫腙和Fe3+络合的离子方程式:
Ⅱ.下图是用双硫腙(H2Dz)~CC14络合萃取某些金属离子的酸度曲线。它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式被萃取分离的百分率。

某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)~CC14络合萃取法处理废水。请根据上图回答问题:
(3)欲完全将废水中的Hg2+分离出来,须控制溶液pH为
(4)当调节pH=2时,铋(Bi)的存在形式有:
(5)萃取到CCl4中的Zn(HDz)2分液后,加入足量的NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式:
您最近一年使用:0次
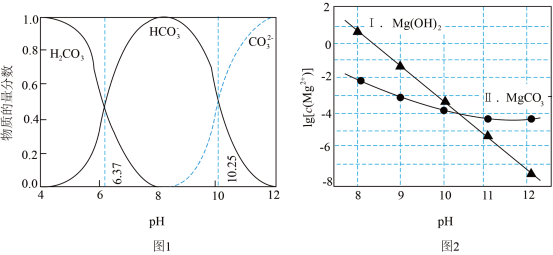
4 . 常温下, 在Na2CO3溶液中发生反应,可能生成
在Na2CO3溶液中发生反应,可能生成 或MgCO3。图1表示Na2CO3溶液中各含碳物种的物质的量分数与溶液pH的关系;图2中曲线Ⅰ的离子浓度关系符合
或MgCO3。图1表示Na2CO3溶液中各含碳物种的物质的量分数与溶液pH的关系;图2中曲线Ⅰ的离子浓度关系符合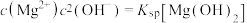 ;曲线Ⅱ的离子浓度关系符合
;曲线Ⅱ的离子浓度关系符合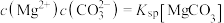 。利用平衡原理分析,下列说法正确的是
。利用平衡原理分析,下列说法正确的是
 在Na2CO3溶液中发生反应,可能生成
在Na2CO3溶液中发生反应,可能生成 或MgCO3。图1表示Na2CO3溶液中各含碳物种的物质的量分数与溶液pH的关系;图2中曲线Ⅰ的离子浓度关系符合
或MgCO3。图1表示Na2CO3溶液中各含碳物种的物质的量分数与溶液pH的关系;图2中曲线Ⅰ的离子浓度关系符合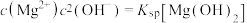 ;曲线Ⅱ的离子浓度关系符合
;曲线Ⅱ的离子浓度关系符合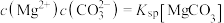 。利用平衡原理分析,下列说法正确的是
。利用平衡原理分析,下列说法正确的是
A.常温时, 的水解常数 的水解常数 |
B.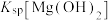 的数量级为 的数量级为 |
C.由图2,当pH=11, 时,有沉淀生成 时,有沉淀生成 |
D.由图1和图2,在pH=8,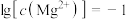 时,溶液中发生反应: 时,溶液中发生反应: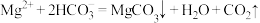 |
您最近一年使用:0次
名校
解题方法
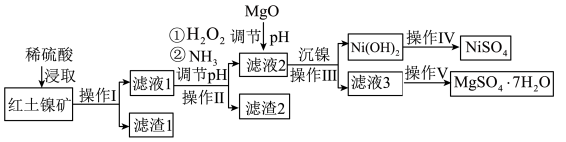
5 . 镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下, 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;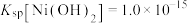 。
。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
回答下列问题:
(1)“滤液1”中加入 的作用是
的作用是___________ (用离子反应方程式表示)。
(2)操作Ⅱ为达到实验目的,由表中的数据判断通入 调节溶液pH的范围是
调节溶液pH的范围是___________ 。
(3)“滤液1”中是否存在 ,可用
,可用___________ 检验。
(4)“沉镍”中pH调为8.5,则滤液中 的浓度为
的浓度为___________  。
。
(5)操作V是___________ 、过滤、洗涤。
(6) 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为___________ 。
 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下,
 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;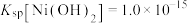 。
。②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
| 沉淀物 |  |  |  |  |  |
| 开始沉淀时的pH | 7.1 | 7.6 | 2.7 | 3.4 | 9.2 |
沉淀完全(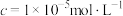 )时的pH )时的pH | 9.0 | 9.6 | 3.2 | 4.7 | 11.1 |
(1)“滤液1”中加入
 的作用是
的作用是(2)操作Ⅱ为达到实验目的,由表中的数据判断通入
 调节溶液pH的范围是
调节溶液pH的范围是(3)“滤液1”中是否存在
 ,可用
,可用(4)“沉镍”中pH调为8.5,则滤液中
 的浓度为
的浓度为 。
。(5)操作V是
(6)
 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
您最近一年使用:0次
6 . 活性氧化锌能对太阳光线和其他大气物质形成防护,常用于敏感皮肤的面霜和化妆品。工业上用菱锌矿(主要成分为 ,还含有Ni、Cd、Fe、Cu等元素及少量不溶于成的杂质)制备
,还含有Ni、Cd、Fe、Cu等元素及少量不溶于成的杂质)制备 ,工艺流程图所示:
,工艺流程图所示:

(1)为了提高“溶浸”效果,可采取的措施有___________ 。(任写两条)
(2)“除铁”时,先加入 溶液发生的离子方程式为
溶液发生的离子方程式为___________ ,如果用 代替
代替 ,恰好完全反应时,理论上消耗
,恰好完全反应时,理论上消耗
___________ 。
(3)常温下,“调 ”时,
”时, 的浓度降到了
的浓度降到了 ,此时
,此时 的溶度积常数的数值为
的溶度积常数的数值为___________ 。
(4)“沉锌”时,在近中性条件下加入 ,可得碱式碳酸锌[
,可得碱式碳酸锌[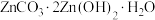 ]固体,同时产生大量的
]固体,同时产生大量的 气体。该反应的离子方程式为
气体。该反应的离子方程式为___________ 。
(5)用锌与铜制得的高纯铜锌合金滤料被广泛应用于各种水处理设备。一种铜锌合金的晶胞结构如图,已知:晶胞参数为anm。

①基态Zn原子价电子排布式为___________ 。
②与Cu原子等距离且最近的Cu原子有___________ 个。
③该铜锌合金晶体密度为___________  (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 ,还含有Ni、Cd、Fe、Cu等元素及少量不溶于成的杂质)制备
,还含有Ni、Cd、Fe、Cu等元素及少量不溶于成的杂质)制备 ,工艺流程图所示:
,工艺流程图所示:
(1)为了提高“溶浸”效果,可采取的措施有
(2)“除铁”时,先加入
 溶液发生的离子方程式为
溶液发生的离子方程式为 代替
代替 ,恰好完全反应时,理论上消耗
,恰好完全反应时,理论上消耗
(3)常温下,“调
 ”时,
”时, 的浓度降到了
的浓度降到了 ,此时
,此时 的溶度积常数的数值为
的溶度积常数的数值为(4)“沉锌”时,在近中性条件下加入
 ,可得碱式碳酸锌[
,可得碱式碳酸锌[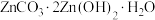 ]固体,同时产生大量的
]固体,同时产生大量的 气体。该反应的离子方程式为
气体。该反应的离子方程式为(5)用锌与铜制得的高纯铜锌合金滤料被广泛应用于各种水处理设备。一种铜锌合金的晶胞结构如图,已知:晶胞参数为anm。

①基态Zn原子价电子排布式为
②与Cu原子等距离且最近的Cu原子有
③该铜锌合金晶体密度为
 (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解题方法
7 . 草酸钴主要用作制氧化钴的原料,也可用于制取其他钴化合物。利用废料铝钴膜(含有LiCoO2、Al、Fe)制备草酸钴的工艺如下:
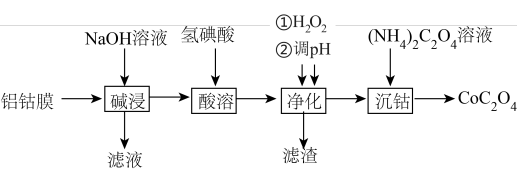
已知:①钴酸锂LiCoO2难溶于水,具有强氧化性。
②氢碘酸是强酸,酸溶后的溶液含有Li+、Fe2+、Co2+。
③金属离子沉淀开始和沉淀完全的pH:
(1)钴酸锂LiCoO2中钴元素的化合价为__________ 。
(2)“碱浸”的目的是溶解Al,写出“碱浸”过程发生反应的离子方程式__________ 。
(3)“酸溶”过程LiCoO2发生反应的离子方程式为__________ 。
(4)“净化”过程加入H2O2的目的是__________ 。
(5)调节pH的范围是__________ ,滤渣的成分是__________ (填化学式)。
(6)“沉钴”后过滤、洗涤,简述洗涤沉淀的方法__________ 。

已知:①钴酸锂LiCoO2难溶于水,具有强氧化性。
②氢碘酸是强酸,酸溶后的溶液含有Li+、Fe2+、Co2+。
③金属离子沉淀开始和沉淀完全的pH:
| Fe2+ | Fe3+ | Al3+ | Co2+ | |
| 沉淀开始的pH | 6.5 | 1.5 | 3.3 | 6.6 |
| 沉淀完全的pH | 9.7 | 3.2 | 4.7 | 9.2 |
(1)钴酸锂LiCoO2中钴元素的化合价为
(2)“碱浸”的目的是溶解Al,写出“碱浸”过程发生反应的离子方程式
(3)“酸溶”过程LiCoO2发生反应的离子方程式为
(4)“净化”过程加入H2O2的目的是
(5)调节pH的范围是
(6)“沉钴”后过滤、洗涤,简述洗涤沉淀的方法
您最近一年使用:0次
名校
8 . 依据水溶液中的离子平衡规律,回答下列问题:
(1)除去酸性 溶液中的
溶液中的 ,可加入
,可加入___________ 物质(至少回答两种),可以使 转化为
转化为 而除去。
而除去。
(2) 时,若体积为
时,若体积为 的某一元强酸与体积为
的某一元强酸与体积为 的某一元强碱混合,恰好中和,且已知
的某一元强碱混合,恰好中和,且已知 和
和 ,则a的取值范围是
,则a的取值范围是___________ 。
(3)工业上用化学法除锅炉的水垢时,先向锅炉中注入饱和 溶液浸泡,将水垢中的
溶液浸泡,将水垢中的 转化为
转化为 ,再用盐酸除去[已知:
,再用盐酸除去[已知: ]。
]。
①沉淀转化的离子方程式为___________ 。
②该温度下,根据 ,计算
,计算 在水中的溶解度的为
在水中的溶解度的为___________ g。
(4)在化学分析中,以 标准溶液滴定溶液中的
标准溶液滴定溶液中的 时,采用
时,采用 为指示剂,利用
为指示剂,利用 与
与 反应生成砖红色沉淀指示滴定终点。当溶液中
反应生成砖红色沉淀指示滴定终点。当溶液中 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于 )时,溶液中:
)时,溶液中: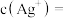
___________  ,
,
___________  。(已知
。(已知 时
时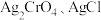 的
的 分别为
分别为 和
和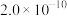 )
)
(1)除去酸性
 溶液中的
溶液中的 ,可加入
,可加入 转化为
转化为 而除去。
而除去。(2)
 时,若体积为
时,若体积为 的某一元强酸与体积为
的某一元强酸与体积为 的某一元强碱混合,恰好中和,且已知
的某一元强碱混合,恰好中和,且已知 和
和 ,则a的取值范围是
,则a的取值范围是(3)工业上用化学法除锅炉的水垢时,先向锅炉中注入饱和
 溶液浸泡,将水垢中的
溶液浸泡,将水垢中的 转化为
转化为 ,再用盐酸除去[已知:
,再用盐酸除去[已知: ]。
]。①沉淀转化的离子方程式为
②该温度下,根据
 ,计算
,计算 在水中的溶解度的为
在水中的溶解度的为(4)在化学分析中,以
 标准溶液滴定溶液中的
标准溶液滴定溶液中的 时,采用
时,采用 为指示剂,利用
为指示剂,利用 与
与 反应生成砖红色沉淀指示滴定终点。当溶液中
反应生成砖红色沉淀指示滴定终点。当溶液中 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于 )时,溶液中:
)时,溶液中: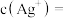
 ,
,
 。(已知
。(已知 时
时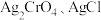 的
的 分别为
分别为 和
和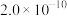 )
)
您最近一年使用:0次
名校
9 . 一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如图,下列说法错误的是

| A.“滤渣1”的主要成分有SiO2、Fe2O3、Al2O3 |
| B.在“过滤2”前将溶液pH调节至3.5,目的是抑制H3BO3电离,促进其析出 |
| C.“母液”加热后可返回溶浸工序循环使用 |
| D.“沉镁”后的沉淀需用蒸馏水洗涤,检验沉淀洗涤干净的试剂是盐酸 |
您最近一年使用:0次
2023-12-31更新
|
116次组卷
|
4卷引用:湖北省荆荆襄宜七校考试联盟2023-2024学年高二上学期期中联考化学试题
名校
解题方法
10 . 湿法炼锌工业废水中主要阳离子有 ,废水除铊的工艺流程如下。
,废水除铊的工艺流程如下。 能够在
能够在 为
为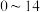 的范围内以离子态稳定存在,不易与
的范围内以离子态稳定存在,不易与 形成沉淀
形成沉淀
②常温下,部分物质的 如下:
如下:
③排放标准: 的含量低于
的含量低于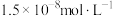
(1)已知“氧化”步骤中 被还原为
被还原为 且
且 氧化不彻底,请写出该反应的离子方程式:
氧化不彻底,请写出该反应的离子方程式:___________ 。
(2)“预中和”步骤,加 至溶液的
至溶液的 约为7,可减少“硫化”步骤中
约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少___________ (填化学式)污染物的生成。
(3)“硫化”步骤的主要目的是除去___________ (填离子符号)。
(4)根据 计算,若使溶液中
计算,若使溶液中 的含量低于排放标准,溶液的
的含量低于排放标准,溶液的 应大于
应大于___________ ,但是实际工艺流程需在“中和”步骤加 至溶液的
至溶液的 约为9,此时仍只有
约为9,此时仍只有 左右的铊能得到去除,其可能原因是
左右的铊能得到去除,其可能原因是___________ 。
(5)控制条件可实现如下沉淀转换: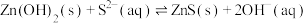 ,该反应的平衡常数
,该反应的平衡常数 为
为___________ 。
 ,废水除铊的工艺流程如下。
,废水除铊的工艺流程如下。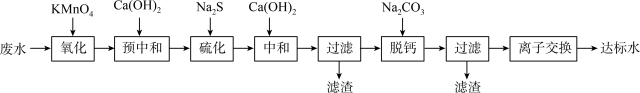
 能够在
能够在 为
为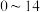 的范围内以离子态稳定存在,不易与
的范围内以离子态稳定存在,不易与 形成沉淀
形成沉淀②常温下,部分物质的
 如下:
如下:| 物质 |  |  |  |  |
 | 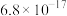 |  |  |  |
 的含量低于
的含量低于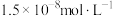
(1)已知“氧化”步骤中
 被还原为
被还原为 且
且 氧化不彻底,请写出该反应的离子方程式:
氧化不彻底,请写出该反应的离子方程式:(2)“预中和”步骤,加
 至溶液的
至溶液的 约为7,可减少“硫化”步骤中
约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少(3)“硫化”步骤的主要目的是除去
(4)根据
 计算,若使溶液中
计算,若使溶液中 的含量低于排放标准,溶液的
的含量低于排放标准,溶液的 应大于
应大于 至溶液的
至溶液的 约为9,此时仍只有
约为9,此时仍只有 左右的铊能得到去除,其可能原因是
左右的铊能得到去除,其可能原因是(5)控制条件可实现如下沉淀转换:
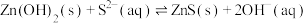 ,该反应的平衡常数
,该反应的平衡常数 为
为
您最近一年使用:0次



