解题方法
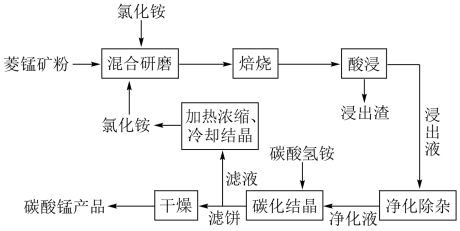
1 . 工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示: 其余为
其余为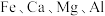 等元素。
等元素。
②部分阳离子沉淀时溶液的 :
:
③“焙烧”过程中主要反应为 。
。
(1)结合图1、2、3,分析“焙烧”过程中最佳的焙烧温度、焙烧时间、 分别为
分别为___________ 、___________ 、___________ 。 ,作用是
,作用是___________ ,再调节溶液 的范围为
的范围为___________ ,将 和
和 变为沉淀而除去,然后加入
变为沉淀而除去,然后加入 将
将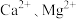 变为氟化物沉淀除去。
变为氟化物沉淀除去。
(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为___________ 。
(4)上述流程中可循环使用的物质是___________ (填化学式)。
(5)现用滴定法测定产品中锰的含量。实验步骤:称取 试样,向其中加入稍过量的磷酸和硝酸,加热使产品中
试样,向其中加入稍过量的磷酸和硝酸,加热使产品中 完全转化为
完全转化为 (其中
(其中 转化为
转化为 );加入稍过量的硫酸铵,发生反应
);加入稍过量的硫酸铵,发生反应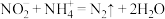 以除去
以除去 ;加入稀硫酸酸化,用
;加入稀硫酸酸化,用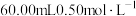 硫酸亚铁铵标准溶液进行滴定,发生的反应为
硫酸亚铁铵标准溶液进行滴定,发生的反应为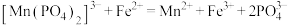 ;用
;用 酸性
酸性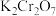 溶液恰好除去过量的
溶液恰好除去过量的 。
。
①酸性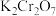 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为___________ 。
②试样中锰的质量分数为___________ 。
 其余为
其余为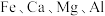 等元素。
等元素。②部分阳离子沉淀时溶液的
 :
:| 离子 |  |  |  |  |  |
开始沉淀的 | 4.1 | 2.2 | 10.6 | 8.1 | 9.1 |
沉淀完全的 | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
 。
。(1)结合图1、2、3,分析“焙烧”过程中最佳的焙烧温度、焙烧时间、
 分别为
分别为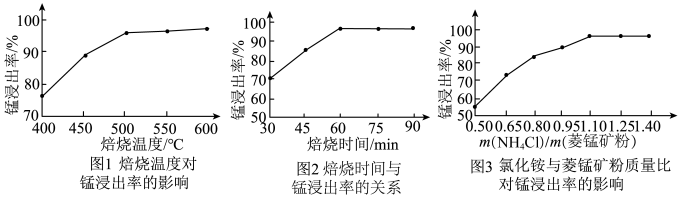
 ,作用是
,作用是 的范围为
的范围为 和
和 变为沉淀而除去,然后加入
变为沉淀而除去,然后加入 将
将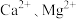 变为氟化物沉淀除去。
变为氟化物沉淀除去。(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为
(4)上述流程中可循环使用的物质是
(5)现用滴定法测定产品中锰的含量。实验步骤:称取
 试样,向其中加入稍过量的磷酸和硝酸,加热使产品中
试样,向其中加入稍过量的磷酸和硝酸,加热使产品中 完全转化为
完全转化为 (其中
(其中 转化为
转化为 );加入稍过量的硫酸铵,发生反应
);加入稍过量的硫酸铵,发生反应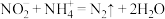 以除去
以除去 ;加入稀硫酸酸化,用
;加入稀硫酸酸化,用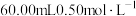 硫酸亚铁铵标准溶液进行滴定,发生的反应为
硫酸亚铁铵标准溶液进行滴定,发生的反应为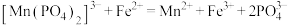 ;用
;用 酸性
酸性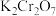 溶液恰好除去过量的
溶液恰好除去过量的 。
。①酸性
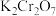 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为②试样中锰的质量分数为
您最近一年使用:0次
2024-04-15更新
|
85次组卷
|
2卷引用:2024届青海省百所名校高三下学期二模理科综合试题-高中化学
2 . 下列实验操作能达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 除去HC1中混有的 | 将混合气体通过硫酸铜溶液 |
| B | 检验溴化钠溶液中是否混有氯化钠 | 向混合溶液中加入足量硝酸银溶液,观察沉淀颜色 |
| C | 除去乙烷中混有的乙烯 | 通入适量 ,在适当温度和催化剂作用下将混合物中的乙烯转化为乙烷 ,在适当温度和催化剂作用下将混合物中的乙烯转化为乙烷 |
| D | 检验某混合溶液中是否含 有  | 用洁净的铂丝蘸取少量溶液于火焰上灼烧,观察焰色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 自2021年美国央行的大量放水,大宗原材料价格猛涨,企业十分重视提高原材料的利用率。某大型企业以工业烧渣(主要含ZnO,还含少量Fe3O4、Al2O3、CuO及SiO2等)为原料制取有机高分子材料的阻燃剂一磷酸锌[Zn3(PO4)2]的工艺流程如图所示。
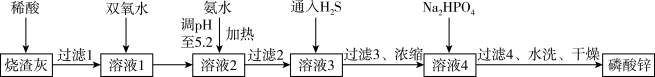
已知:室温下,几种金属离子开始沉淀与沉淀完全的pH如下表所示。
(1)在180 °C对“烧渣灰”进行酸溶最适合的酸是_______ (填“盐酸”、“硫酸”或“硝酸”)。
(2)加入双氧水的作用是作氧化剂,则发生反应的化学方程式为_______ ;可用NaClO代替双氧水,两者相比,_______ (填化学式)的氧化效率更高。(氧化效率以单位质量的氧化剂得到的电子数表示)
(3)加氨水过程中加热的目的是_______ ;“过滤2”得到的滤渣的主要成分为_______ (填化学式)。
(4)通入H2S的目的是_______ ;加入Na2 HPO4发生反应的离子方程式为_______ 。
(5)确认磷酸锌洗涤干净的操作是_______ 。
(6)在通入H2S之前,“溶液3”中A13+的浓度为_______ mol·L-1。

已知:室温下,几种金属离子开始沉淀与沉淀完全的pH如下表所示。
| 金属离子 | Al3+ | Fe3+ | Cu2+ | Zn2+ |
| 开始沉淀的pH | 3.7 | 2.2 | 5.2 | 6.5 |
| 沉淀完全(c=1.0×10-5mol· L-1)的pH | 4.7 | 3.2 | 6.7 | 8.0 |
(2)加入双氧水的作用是作氧化剂,则发生反应的化学方程式为
(3)加氨水过程中加热的目的是
(4)通入H2S的目的是
(5)确认磷酸锌洗涤干净的操作是
(6)在通入H2S之前,“溶液3”中A13+的浓度为
您最近一年使用:0次
名校
解题方法
4 . 工业上制备氯化铜时,是将浓盐酸用水蒸气加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:CuO+2HCl=CuCl2+H2O,FeO+2HCl=FeCl2+H2O.
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;
pH≥4.4时,Cu2+以Cu(OH)2的形式开始沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3∼4时,Fe3+以Fe(OH)3的形式完全沉淀。
(1)为除去溶液中Fe2+,可采用的方法是__ 。
(2)工业上为除去溶液中的Fe2+,常使用NaClO,当向溶液中加入NaClO后,可能发生反应的离子方程式为__ ;溶液的pH变化是__ 。
(3)已知25℃时,Ksp[Cu(OH)2]=2×10-20。
①某CuSO4溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于__ 。
②要使0.2mol•L-1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为__ 。
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;
pH≥4.4时,Cu2+以Cu(OH)2的形式开始沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3∼4时,Fe3+以Fe(OH)3的形式完全沉淀。
(1)为除去溶液中Fe2+,可采用的方法是
(2)工业上为除去溶液中的Fe2+,常使用NaClO,当向溶液中加入NaClO后,可能发生反应的离子方程式为
(3)已知25℃时,Ksp[Cu(OH)2]=2×10-20。
①某CuSO4溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于
②要使0.2mol•L-1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为
您最近一年使用:0次
5 . 已知p(A)=-lgc平(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是
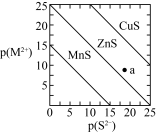

| A.a点没有ZnS沉淀生成 |
| B.可用MnS除去MnCl2溶液中混有的少量ZnCl2 |
| C.向CuS悬浊液中加入少量水,平衡向溶解的方向移动,c平(S2-)增大 |
D.CuS和MnS共存的悬浊液中,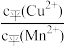 =10-20 =10-20 |
您最近一年使用:0次
2021-04-29更新
|
849次组卷
|
19卷引用:青海省湟川中学2020-2021学年高二上学期期中考试化学试题
青海省湟川中学2020-2021学年高二上学期期中考试化学试题河北省沧州市普通高中高三上学期教学质量监测(联考)化学试题(已下线)黄金30题系列 高二化学(选修4) 小题好拿分【提升版】湖北省浠水县实验高级中学2018-2019学年高二上学期12月月考化学试题.湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题12 溶度积的应用复习题(已下线)考点13 沉淀溶解平衡-2020年高考化学命题预测与模拟试题分类精编山东省临朐县实验中学2020-2021学年高二上学期12月月结学情检测化学试题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)四川省成都市蒲江县蒲江中学2020-2021学年高二3月月考化学试题(已下线)专题27 难溶电解质的溶解平衡(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练吉林省长春市第二中学2021-2022学年高二上学期期中考试化学试题(已下线)2022年山东省高考真题变式题(不定项选择题)甘肃省张掖市高台县第一中学2022-2023学年高三上学期第四次检测化学试题河南省潢川第一中学2022-2023学年高二上学期期末考试化学试题浙江省杭州市长河高级中学2022-2023学年高二上学期期中考试化学试题黑龙江省哈尔滨市第九中学2022-2023学年高二上学期期末化学试题宁夏石嘴山市平罗中学2022-2023学年高二下学期3月月考化学试题 上海市上海中学2023-2024学年高二上学期期中考试化学试题黑龙江省哈尔滨市第四中学校2023-2024学年高二上学期11月月考化学试题
6 . 已知,一些铅盐的溶度积如下:
由上述数据可知,要除去工业废水中的Pb2+,沉淀剂最好选用( )
| 化合物 | PbSO4 | PbCO3 | PbS | PbCl2 |
| 溶度积Ksp | 1.82×10-8 | 1.46×10-13 | 9.04×10-29 | 1.17×10-5 |
| A.硫酸盐 | B.硫化物 | C.碳酸盐 | D.盐酸盐 |
您最近一年使用:0次
2020-02-08更新
|
1018次组卷
|
4卷引用:青海省西宁市第十四中学2019-2020学年高二上学期期末考试化学试题
7 . 下列有关电解质溶液的说法正确的是
| A.SO3溶于水后能导电,故SO3为电解质 |
| B.一切钾盐、钠盐、硝酸盐都不发生水解 |
| C.硫酸酸性强于醋酸,但CaCO3难溶于硫酸,可溶于醋酸 |
| D.pH=5的盐酸和氯化铵溶液,水的电离程度相同 |
您最近一年使用:0次
2019-03-25更新
|
250次组卷
|
5卷引用:青海省西宁市六校联考2022-2023学年高二上学期期末考试化学试题
8 . 要使工业废水中的重金属Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
由上述数据可知,选用的沉淀剂最好为( )
化合物 | PbSO4 | PbCO3 | PbS |
溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
| A.硫化物 | B.硫酸盐 | C.碳酸盐 | D.以上沉淀剂均可 |
您最近一年使用:0次
2020-02-05更新
|
1023次组卷
|
35卷引用:青海省西宁市第四高级中学2017-2018学年高二上学期第二次月考化学试题
青海省西宁市第四高级中学2017-2018学年高二上学期第二次月考化学试题(已下线)2011-2012学年云南省会泽县第一中学高二6月月考化学试卷2014-2015学年内蒙古巴彦淖尔市一中高二上学期期中化学试卷2014-2015河北省唐山市一中高二下学期开学调研化学试卷2015-2016学年福建省八县一中高二上学期期末考试化学试卷内蒙古包头市铁路第一中学2016-2017学年高二下学期第二次月考化学试题内蒙古北京八中乌兰察布分校2016-2017学年高二下学期期末考试化学试题湖南省岳阳市第一中学2017-2018学年高二下学期开学考试化学试题吉林省白城市第一中学2018-2019学年高二上学期第一次月考化学试题云南省广南二中2018-2019学年高二6月考试化学试题福建省长乐高级中学2018-2019学年高二下学期期末考试化学试题云南省普洱市江城县第一中学2019—2020学年高二上学期期末考试化学试题安徽省合肥市2019-2020学年高二上学期期末考试化学试题安徽省安庆市怀宁县第二中学2021届高三上学期第一次月考化学试题(已下线)3.4+难溶电解质的溶解平衡-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡(已下线)第28讲 难溶电解质的溶解平衡 (精讲)——2021年高考化学一轮复习讲练测(已下线)3.4 难溶电解质的溶解平衡(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)湖北省恩施土家族苗族自治州巴东县第一高级中学2020-2021学年高二上学期第一次月考化学试题湖南省广益实验中学2020-2021学年高二上学期期中考试化学试题河北省邯郸市大名一中、磁县一中,邯山区一中,永年一中等六校2020-2021学年高二下学期期中考试化学试题选择性必修1(SJ)专题3第四单元 沉淀溶解平衡(已下线)考向27 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点微专题广东省清远市第一中学2021-2022学年高二上学期期中调研考试化学试题山西省晋中市平遥县第二中学2021-2022学年高二上学期12月考试化学试题贵州省毕节市赫章县2021-2022学年高二上学期期末考试化学试题内蒙古赤峰二中2021-2022学年高二上学期期末考试化学试题广东省揭阳华侨高级中学2021-2022学年高二上学期期中考试化学试题(已下线)第24讲 沉淀溶解平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)吉林油田第十一中学2021-2022学年高二上学期期中考试化学试题山东省淄博市桓台第二中学2021-2022学年高一9月月考化学试题云南省玉龙纳西族自治县田家炳民族中学2021-2022学年高二上学期期中考试化学试题3.4.1沉淀溶解平衡原理 课后(已下线)寒假作业07 沉淀溶解平衡-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)
9 . 常温下,以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是
| A.过滤后的溶液中一定没有S2- |
| B.MnS难溶于水,可溶于MnCl2溶液中 |
| C.常温时,CuS、PbS、CdS比MnS更难溶 |
| D.加入MnS后生成CuS的离子方程式是Cu2+ + S2- = CuS↓ |
您最近一年使用:0次
2016-12-09更新
|
506次组卷
|
14卷引用:青海省西宁市第四高级中学2017-2018学年高二上学期期末考试化学试题
青海省西宁市第四高级中学2017-2018学年高二上学期期末考试化学试题【全国百强校】青海省西宁市第四高级中学2018-2019学年高二上学期期末考试化学试题2015-2016学年黑龙江省实验中学高二上期末考试化学试卷(已下线)北京市第四中学2016-2017学年高二上学期期末考试化学试题北京师范大学附属中学2017-2018学年高二上学期期末考试化学试题上海市徐汇区2019年高考化学一模试题步步为赢 高二化学寒假作业:综合检测(二)夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——沉淀溶解平衡的影响因素北京市中国人民大学附属中学 2019-2020 学年度高二下学期期末练习化学试题重庆市第二十九中学2020-2021学年高二上学期半期测试化学试题重庆实验中学2020-2021学年高二上学期第二阶段考试化学试题云南省瑞丽市第一民族中学2021-2022学年高二下学期2月份开学测试化学试题云南省玉溪市江川区第二中学2021-2022学年高二上学期12月考试化学试题云南衡水实验中学2021-2022学年高二上学期期末考试化学试题
11-12高二上·湖南张家界·期末
名校
10 . 要除去MgCl2 酸性溶液里少量的 FeCl3 , 不宜选用的试剂是
| A.MgO | B.MgCO3 | C.NaOH | D.Mg(OH)2 |
您最近一年使用:0次
2016-07-15更新
|
362次组卷
|
14卷引用:【全国百强校】青海省西宁市第四高级中学2018-2019学年高二上学期期末考试化学试题
【全国百强校】青海省西宁市第四高级中学2018-2019学年高二上学期期末考试化学试题(已下线)2010—2011学年湖南省慈利一中高二上学期期末考试化学试卷(已下线)2011-2012学年陕西省西安市第一中学高二上学期期末考试化学(理)试卷(已下线)2011-2012学年天津市天津一中高二上学期期末考试化学试卷(已下线)2012-2013学年陕西省西安市第一中学高二上学期期末考试理科化学卷(已下线)2014届甘肃省天水市秦安县高三上学期期末检测化学试卷2015-2016学年河北省武邑中学高二下期末化学试卷2016-2017学年甘肃省武威二中高二上10月月考化学试卷辽宁省抚顺市第十九中学2016-2017学年高二上学期期中考试化学试题黑龙江省牡丹江市第三高级中学2018-2019学年高二上学期期中考试化学试题四川省成都市郫都区川科外国语学校2020-2021学年高二11月月考化学试题吉林长春市榆树高级中学2019-2020学年高二下学期期末考试化学试题黑龙江省牡丹江市海林市朝鲜族中学2021-2022学年高二上学期第三次月考化学试题新疆兵团第三师图木舒克市鸿德实验学校2023-2024学年高二上学期第二次月考化学试题



