1 . 常温下,PdCO3和Pd(OH)2的沉淀溶解平衡曲线如图所示。下列说法正确的是
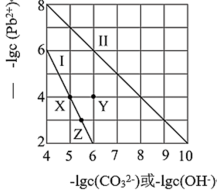
| A.向Z点对应溶液中加入适量的NaOH溶液,有可能得到X点对应溶液 |
| B.Y点对应的PdCO3分散系中,v(溶解)>v(沉淀),固体仍在溶解 |
C.PbCO3(s)+2OH-(aq) Pb(OH)2(s)+ Pb(OH)2(s)+ K=0.01 K=0.01 |
| D.由两者的Ksp可知,Pd(OH)2的溶解度更小 |
您最近一年使用:0次
名校
解题方法
2 . 碳酸锌在工业上用途广泛。利用某种浸锌渣(主要含有 )制备
)制备 的一种流程如下:
的一种流程如下: ;
;
②室温下,部分离子浓度的对数 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体 中主要成分是
中主要成分是______ (填化学式)。
(2)“碱浸”后,浸出液中含有金属元素的离子主要是 和
和______ (填离子符号);欲使浸出液中的含锌微粒完全沉淀,应调节 的范围是
的范围是______ 。
(3)浸渣回收银的过程中有配合物 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)“除杂”时滤渣的主要成分是______ (填化学式)。
(5)“沉锌”时发生反应的离子方程式为______ ;此过程不宜用碳酸钠代替碳酸氢铵,原因是______ 。
 )制备
)制备 的一种流程如下:
的一种流程如下: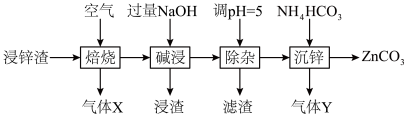
 ;
;②室温下,部分离子浓度的对数
 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):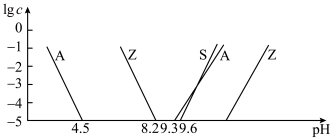
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体
 中主要成分是
中主要成分是(2)“碱浸”后,浸出液中含有金属元素的离子主要是
 和
和 的范围是
的范围是(3)浸渣回收银的过程中有配合物
 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为(4)“除杂”时滤渣的主要成分是
(5)“沉锌”时发生反应的离子方程式为
您最近一年使用:0次
2024-04-21更新
|
215次组卷
|
2卷引用:2024届四川省射洪中学校高三下学期二模理综试题-高中化学
解题方法
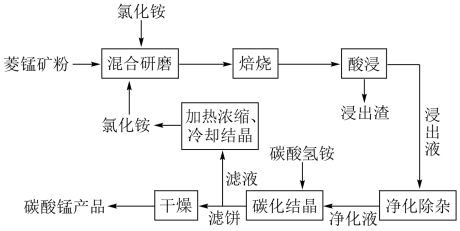
3 . 工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示: 其余为
其余为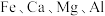 等元素。
等元素。
②部分阳离子沉淀时溶液的 :
:
③“焙烧”过程中主要反应为 。
。
(1)结合图1、2、3,分析“焙烧”过程中最佳的焙烧温度、焙烧时间、 分别为
分别为___________ 、___________ 、___________ 。 ,作用是
,作用是___________ ,再调节溶液 的范围为
的范围为___________ ,将 和
和 变为沉淀而除去,然后加入
变为沉淀而除去,然后加入 将
将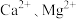 变为氟化物沉淀除去。
变为氟化物沉淀除去。
(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为___________ 。
(4)上述流程中可循环使用的物质是___________ (填化学式)。
(5)现用滴定法测定产品中锰的含量。实验步骤:称取 试样,向其中加入稍过量的磷酸和硝酸,加热使产品中
试样,向其中加入稍过量的磷酸和硝酸,加热使产品中 完全转化为
完全转化为 (其中
(其中 转化为
转化为 );加入稍过量的硫酸铵,发生反应
);加入稍过量的硫酸铵,发生反应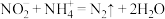 以除去
以除去 ;加入稀硫酸酸化,用
;加入稀硫酸酸化,用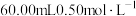 硫酸亚铁铵标准溶液进行滴定,发生的反应为
硫酸亚铁铵标准溶液进行滴定,发生的反应为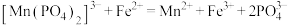 ;用
;用 酸性
酸性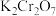 溶液恰好除去过量的
溶液恰好除去过量的 。
。
①酸性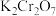 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为___________ 。
②试样中锰的质量分数为___________ 。
 其余为
其余为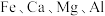 等元素。
等元素。②部分阳离子沉淀时溶液的
 :
:| 离子 |  |  |  |  |  |
开始沉淀的 | 4.1 | 2.2 | 10.6 | 8.1 | 9.1 |
沉淀完全的 | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
 。
。(1)结合图1、2、3,分析“焙烧”过程中最佳的焙烧温度、焙烧时间、
 分别为
分别为
 ,作用是
,作用是 的范围为
的范围为 和
和 变为沉淀而除去,然后加入
变为沉淀而除去,然后加入 将
将 变为氟化物沉淀除去。
变为氟化物沉淀除去。(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为
(4)上述流程中可循环使用的物质是
(5)现用滴定法测定产品中锰的含量。实验步骤:称取
 试样,向其中加入稍过量的磷酸和硝酸,加热使产品中
试样,向其中加入稍过量的磷酸和硝酸,加热使产品中 完全转化为
完全转化为 (其中
(其中 转化为
转化为 );加入稍过量的硫酸铵,发生反应
);加入稍过量的硫酸铵,发生反应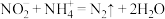 以除去
以除去 ;加入稀硫酸酸化,用
;加入稀硫酸酸化,用 硫酸亚铁铵标准溶液进行滴定,发生的反应为
硫酸亚铁铵标准溶液进行滴定,发生的反应为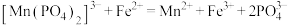 ;用
;用 酸性
酸性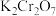 溶液恰好除去过量的
溶液恰好除去过量的 。
。①酸性
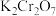 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为②试样中锰的质量分数为
您最近一年使用:0次
2024-04-15更新
|
85次组卷
|
2卷引用:2024届四川省雅安市天全中学高三下学期模拟预测化学试题
4 . 某温度时, 在水溶液中的沉淀溶解平衡曲线如图所示。下列说法正确的是
在水溶液中的沉淀溶解平衡曲线如图所示。下列说法正确的是

 在水溶液中的沉淀溶解平衡曲线如图所示。下列说法正确的是
在水溶液中的沉淀溶解平衡曲线如图所示。下列说法正确的是
A.向 溶液中滴加 溶液中滴加 溶液不一定会生成沉淀 溶液不一定会生成沉淀 |
B.该温度下, 的溶度积常数 的溶度积常数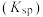 的数量级是 的数量级是 |
| C.可以通过改变温度或加入硫酸银固体使a点移动到b点 |
D.含有大量 的溶液中肯定不存在 的溶液中肯定不存在 |
您最近一年使用:0次
5 . 下列反应的离子方程式错误的是
A.用惰性电极电解氯化镁溶液:2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
B.硫酸铵溶液显酸性: +H2O +H2O NH3•H2O+H+ NH3•H2O+H+ |
C.二元弱酸亚磷酸(H3PO3)溶液中滴加足量的NaOH溶液:H3PO3+2OH-=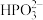 +2H2O +2H2O |
D.硫酸铜溶液遇到难溶的PbS转变为更难溶的CuS:Cu2+(aq)+ (aq)+PbS(s)=CuS(s)+PbSO4(s) (aq)+PbS(s)=CuS(s)+PbSO4(s) |
您最近一年使用:0次
2024-03-10更新
|
32次组卷
|
2卷引用:四川省绵阳中学2023-2024学年高二下学期开学化学试题
解题方法
6 . 下列说法中,正确的是
| A.难溶电解质达到沉淀溶解平衡时,保持温度不变增加难溶电解质的量,平衡向溶解方向移动 |
| B.难溶电解质都是弱电解质 |
C.室温下, 在水中的溶解度大于在饱和 在水中的溶解度大于在饱和 溶液中的溶解度 溶液中的溶解度 |
D.在白色 沉淀上滴加 沉淀上滴加 溶液,沉淀变黑,说明 溶液,沉淀变黑,说明 比 比 更难溶于水 更难溶于水 |
您最近一年使用:0次
7 . 物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡,请回答:
(1)泡沫灭火剂包括Al2(SO4)3 溶液(约1mol/L ), NaHCO3溶液(约1mol/L )及起泡剂,使用时发生反应的离子方程式为_______ 。
(2)t℃时,某稀硫酸溶液中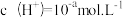 ,
,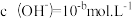 ,已知:
,已知: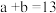 ,该温度下水的离子积常数 KW 的数值为
,该温度下水的离子积常数 KW 的数值为_______ 。
(3)含等物质的量的 NaHC2O4 和 Na 2C2O4 的溶液物料守恒式为_______ 。
(4)已知25℃时部分弱电解质的电离平衡常数数据如下表:
pH 相同的①CH3COONa 溶液、② NaClO溶液、③ NaHCO3溶液、④ NaOH 溶液,其物质的量浓度由大到小的顺序为_______ 。
(5)某溶液只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH 如下表所示:
为制备CuCl2·3H2O,除去Cu2+、Fe2+、Fe3+离子应该先加入_______ ,然后再加入_______ ,调节pH 范围为_______ 。
(1)泡沫灭火剂包括Al2(SO4)3 溶液(约1mol/L ), NaHCO3溶液(约1mol/L )及起泡剂,使用时发生反应的离子方程式为
(2)t℃时,某稀硫酸溶液中
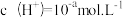 ,
,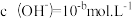 ,已知:
,已知: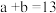 ,该温度下水的离子积常数 KW 的数值为
,该温度下水的离子积常数 KW 的数值为(3)含等物质的量的 NaHC2O4 和 Na 2C2O4 的溶液物料守恒式为
(4)已知25℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 平衡常数 |  | 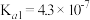 | 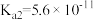 | 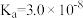 |
(5)某溶液只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH 如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
您最近一年使用:0次
解题方法
8 . 火法炼铜中产生的白烟尘常含ZnO、 、CuO、CdO、
、CuO、CdO、 、PdO等,其中Cu、Zn、Pb、Cd等是潜在的金属资源,As有潜在环境威胁,可综合利用变废为宝,流程如下:
、PdO等,其中Cu、Zn、Pb、Cd等是潜在的金属资源,As有潜在环境威胁,可综合利用变废为宝,流程如下:

(1)溶解度:

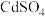 (填“>”“<”或“=”)。在浸出液中,砷元素主要以
(填“>”“<”或“=”)。在浸出液中,砷元素主要以 的形式存在,写出“酸浸”生成
的形式存在,写出“酸浸”生成 的化学方程式
的化学方程式(2)表1和表2是在其他条件一定时,铁铜摩尔置换比[
 ]、温度分别对铜的置换率和品位(矿石中所含某种金属或有用成分的多少)的影响,浸出液置换铜的最佳
]、温度分别对铜的置换率和品位(矿石中所含某种金属或有用成分的多少)的影响,浸出液置换铜的最佳 比值是
比值是表1  对铜置换率和品味的影响
对铜置换率和品味的影响
| 置换率/% | Cu品位/% |
1.2 | 74.87 | 51.22 |
1.4 | 92.17 | 72.82 |
1.6 | 99.92 | 72.08 |
表2温度对铜置换率和品味的影响
温度/℃ | 置换率/% | Cu品位/% |
30 | 99.92 | 72.08 |
60 | 99.93 | 70.34 |
80 | 99.86 | 69.98 |
(3)随着pH增大,沉砷率将
(4)金属活动性顺序为Zn>Cd>Cu,“电解”主要回收到的金属中,首先析出的是
您最近一年使用:0次
名校
解题方法
9 . 纳米铁酸锰(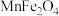 ,具有磁性)在光、电子、催化等领域应用广泛。实验室可采用共沉淀法制备纳米铁酸锰,步骤如下:
,具有磁性)在光、电子、催化等领域应用广泛。实验室可采用共沉淀法制备纳米铁酸锰,步骤如下:
步骤1:按 ,称取
,称取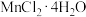 和
和 于烧杯中,加入200mL的蒸馏水,搅拌,形成混合溶液;
于烧杯中,加入200mL的蒸馏水,搅拌,形成混合溶液;
步骤2:配制浓度为 的NaOH溶液,并加热至沸腾;
的NaOH溶液,并加热至沸腾;
步骤3:将步骤1的混合液加热至80℃,剧烈搅拌下于10s内加入沸腾的130mL的NaOH溶液中,然后将该溶液倒入仪器X中回流,于90℃恒温晶化1h;
步骤4:反应结束后,将铁酸锰晶体粒子分离出来,依次用蒸馏水、乙醇洗涤干燥后,即得到黑色具有磁性的铁锰酸。
回答下列问题:
(1)步骤2所配NaOH溶液的物质的量浓度为___________  。配制过程中,下列仪器不需要用到的是
。配制过程中,下列仪器不需要用到的是___________ (填字母)。___________ 。
②回流时的加热方式为___________ 。
③写出形成铁酸锰反应的离子方程式:___________ 。
(3)步骤4分离出铁酸锰的简单方法是___________ ,检验蒸馏水将铁酸锰洗涤干净的操作是___________ ,乙醇洗涤的目的是___________ 。
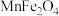 ,具有磁性)在光、电子、催化等领域应用广泛。实验室可采用共沉淀法制备纳米铁酸锰,步骤如下:
,具有磁性)在光、电子、催化等领域应用广泛。实验室可采用共沉淀法制备纳米铁酸锰,步骤如下:步骤1:按
 ,称取
,称取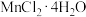 和
和 于烧杯中,加入200mL的蒸馏水,搅拌,形成混合溶液;
于烧杯中,加入200mL的蒸馏水,搅拌,形成混合溶液;步骤2:配制浓度为
 的NaOH溶液,并加热至沸腾;
的NaOH溶液,并加热至沸腾;步骤3:将步骤1的混合液加热至80℃,剧烈搅拌下于10s内加入沸腾的130mL的NaOH溶液中,然后将该溶液倒入仪器X中回流,于90℃恒温晶化1h;
步骤4:反应结束后,将铁酸锰晶体粒子分离出来,依次用蒸馏水、乙醇洗涤干燥后,即得到黑色具有磁性的铁锰酸。
回答下列问题:
(1)步骤2所配NaOH溶液的物质的量浓度为
 。配制过程中,下列仪器不需要用到的是
。配制过程中,下列仪器不需要用到的是

②回流时的加热方式为
③写出形成铁酸锰反应的离子方程式:
(3)步骤4分离出铁酸锰的简单方法是
您最近一年使用:0次
2024-01-22更新
|
110次组卷
|
4卷引用:四川省内江市第三中学2023-2024学年高三1月月考理综试卷-高中化学
10 . 常温下,向 和
和 的混合液中滴加
的混合液中滴加 溶液,
溶液, 与
与 的关系如图所示。知:
的关系如图所示。知: 代表
代表 或
或 ;
; ;当被沉淀的离子的物质的量浓度小于
;当被沉淀的离子的物质的量浓度小于 时,认为该离子已沉淀完全。下列叙述错误的是
时,认为该离子已沉淀完全。下列叙述错误的是
 和
和 的混合液中滴加
的混合液中滴加 溶液,
溶液, 与
与 的关系如图所示。知:
的关系如图所示。知: 代表
代表 或
或 ;
; ;当被沉淀的离子的物质的量浓度小于
;当被沉淀的离子的物质的量浓度小于 时,认为该离子已沉淀完全。下列叙述错误的是
时,认为该离子已沉淀完全。下列叙述错误的是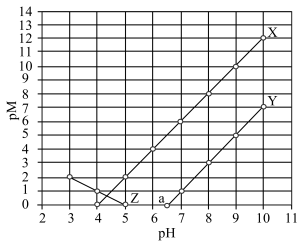
A.X、Z分别代表 与 与 的关系 的关系 |
B.常温下,弱酸 的电离常数 的电离常数 |
C.图中 点对应溶液的 点对应溶液的 为6.5,此时溶液中 为6.5,此时溶液中 |
D.向浓度均为 的 的 和 和 的混合溶液中逐滴加入 的混合溶液中逐滴加入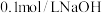 溶液,能通过沉淀的方式将两种离子分离 溶液,能通过沉淀的方式将两种离子分离 |
您最近一年使用:0次



