1 . 为减少对环境的损害,必须对废弃物进行严格管理。关于废弃物的处理,下列说法错误的是
| A.含重金属离子的废液,可利用沉淀法进行处理 |
| B.实验室未用完的钠、钾、白磷等不能放回原试剂瓶 |
| C.对于不需要回收利用的有机废液,可用焚烧法处理 |
| D.强氧化物如高锰酸钾固体,可配成溶液,再进行常规处理 |
您最近一年使用:0次
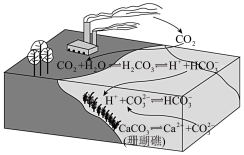
2 . 二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如下图所示。下列叙述错误的是
CO2+H2O H2CO3
H2CO3 H++
H++
H++


CaCO3 Ca2++
Ca2++ (珊瑚礁)
(珊瑚礁)

CO2+H2O
 H2CO3
H2CO3 H++
H++
H++



CaCO3
 Ca2++
Ca2++ (珊瑚礁)
(珊瑚礁)A.海水酸化能引起 浓度增大、 浓度增大、 浓度减小 浓度减小 |
| B.海水酸化能促进CaCO3的溶解,导致珊瑚礁减少 |
C.CO2能引起海水酸化,其原理为  H++ H++ |
| D.使用太阳能、氢能等新能源可改善珊瑚的生存环境 |
您最近一年使用:0次
3 . 25℃时, 和
和 的沉淀溶解平衡曲线如图(
的沉淀溶解平衡曲线如图( 代表
代表 或
或 )所示。下列说法不正确的是
)所示。下列说法不正确的是
 和
和 的沉淀溶解平衡曲线如图(
的沉淀溶解平衡曲线如图( 代表
代表 或
或 )所示。下列说法不正确的是
)所示。下列说法不正确的是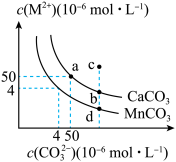
A.a点可表示 的饱和溶液 的饱和溶液 |
B.c点可表示 的过饱和溶液,达新平衡时可到达b点 的过饱和溶液,达新平衡时可到达b点 |
C.d点时溶液中存在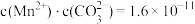 (忽略单位) (忽略单位) |
D.用 溶液浸泡足量 溶液浸泡足量 ,会有部分 ,会有部分 转化为 转化为 |
您最近一年使用:0次
2022-07-04更新
|
2206次组卷
|
14卷引用:山西省朔州市怀仁县阳高一中2023-2024学年高二上学期11月化学试卷
山西省朔州市怀仁县阳高一中2023-2024学年高二上学期11月化学试卷安徽省阜阳市2021-2022学年高二下学期期末统测化学试题(已下线)江苏省如皋市2021-2022学年高二下学期期初调研化学试题(已下线)3.4.2 沉淀溶解平衡的应用-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)(已下线)第三章 水溶液中的离子反应与平衡(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)(已下线)T13-溶液中的离子平衡(已下线)2023年北京卷高考真题变式题(选择题11-14)(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)T12-难溶电解质的沉淀溶解平衡安徽省滁州市实验中学等2校2022-2023学年高二上学期1月期末考试化学试题(已下线)选择题11-16四川省绵阳中学2023-2024学年高二下学期开学化学试题四川省达州外国语学校2023-2024学年高二下学期3月月考化学试题
名校
解题方法
4 . 某小组用硫铜矿煅烧废渣(主要含Fe2O3、CuO、FeO)为原料制取Cu2O,流程如图:
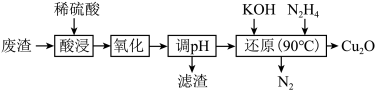
下列说法不正确的是
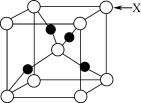

下列说法不正确的是

| A.“调节pH”主要目的是为了除去Fe3+ |
B.“还原”过程中主要发生的反应为4CuSO4+N2H4+8KOH 2Cu2O+N2↑+4K2SO4+6H2O 2Cu2O+N2↑+4K2SO4+6H2O |
| C.用N2H4还原制取Cu2O的优点是产生N2氛围,可防止产品被氧化 |
| D.Cu2O的晶胞结构如图所示,其中X代表的是Cu+ |
您最近一年使用:0次
2022-02-15更新
|
817次组卷
|
7卷引用:山西省运城市康杰中学2023-2024学年高二下学期开学考试化学试题
山西省运城市康杰中学2023-2024学年高二下学期开学考试化学试题江苏省南通市通州区2021-2022学年高三上学期期末质量监测化学试题江苏省高邮市2021-2022学年高三下学期期初学情调研化学试题(已下线)黄金卷5-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)江苏省响水中学2021-2022学年高三下学期学情分析(二)化学试题(已下线)押江苏卷第9题 化学工艺流程选择题 -备战2022年高考化学临考题号押题(江苏卷)江苏省南京市宁海中学2021-2022学年高二下学期期末考试化学试题
5 . 为研究沉淀的生成及转化,某小组进行如下实验。关于该实验的分析不正确的是
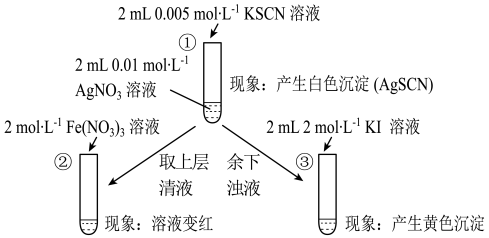

A.①浊液中存在平衡:AgSCN(s)  Ag+ (aq)+ SCN-(aq) Ag+ (aq)+ SCN-(aq) |
| B.②中颜色变化说明上层清液中含有SCN- |
| C.③中颜色变化说明有AgI生成 |
| D.该实验可以证明:Ksp(AgI)<Ksp(AgSCN) |
您最近一年使用:0次
名校
6 . 常温下,实验测得0.1mol·L-1下列物质的溶液pH如表所示:
(1)Na2CO3溶液显碱性的主要原因为____ (用离子方程式表示)。
(2)上述CH3COONH4溶液中c(NH )
)____ NH4Cl溶液中c(NH )(填“大于”“小于”或“等于”)。
)(填“大于”“小于”或“等于”)。
(3)有同学认为根据前几组实验结果,无需再实验就可以预测a的值,则a=____ 。
(4)推测上述CH3COONa溶液的pH大于NaHCO3溶液pH的可能原因:____ 。
(5)锅炉水垢的主要成分里含有CaSO4,去除水垢时经常先用饱和Na2CO3溶液浸泡,后用盐酸溶解。请应用化学平衡移动原理解释清洗CaSO4的过程:___ 。
物质 | Na2CO3 | CH3COONa | NaHCO3 | CH3COONH4 | NH4Cl |
溶液pH | 11 | 8.9 | 8.3 | 7.0 | a |
(2)上述CH3COONH4溶液中c(NH
 )
) )(填“大于”“小于”或“等于”)。
)(填“大于”“小于”或“等于”)。(3)有同学认为根据前几组实验结果,无需再实验就可以预测a的值,则a=
(4)推测上述CH3COONa溶液的pH大于NaHCO3溶液pH的可能原因:
(5)锅炉水垢的主要成分里含有CaSO4,去除水垢时经常先用饱和Na2CO3溶液浸泡,后用盐酸溶解。请应用化学平衡移动原理解释清洗CaSO4的过程:
您最近一年使用:0次
2022-01-18更新
|
121次组卷
|
2卷引用:山西省大同市2021-2022学年高二上学期期末质量检测化学试题
解题方法
7 . 下列三组实验进行一段时间后,溶液中均有白色沉淀生成,下列结论正确的是
| 实验① | 实验② | 实验③ |
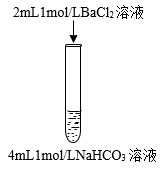 | 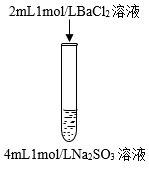 | 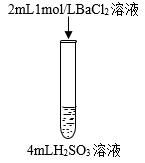 |
A.实验①中生成的沉淀是 |
B.实验①生成沉淀的离子方程式是: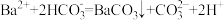 |
C.实验②沉淀中不可能含有 |
D.实验③生成沉淀的离子方程式是: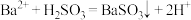 |
您最近一年使用:0次
8 . Ca(OH)2是微溶物,且在水中溶解度随温度升高而减小,一定温度下,把一定量的Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)⇌Ca2+(aq)+2OH﹣(aq)。有关该悬浊液的说法中正确的是
| A.向该悬浊液中再加入一定量的CaO,恢复原温度,溶液的总质量不变 |
| B.该溶液中:2c(Ca2+)=c(OH﹣) |
| C.向该悬浊液中加少量水稀释,n(Ca2+)×n2(OH﹣)保持不变 |
| D.Ca(OH)2固体溶解是放热过程 |
您最近一年使用:0次
名校
解题方法
9 . 结合水溶液中离子平衡的相关知识回答下列问题:
Ⅰ.温度为 t℃时,某 NaOH 稀溶液中 c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知:a+b=12,请回答下列问题:
(1)该温度下水的离子积常数 Kw=___________ 。
(2)该 NaOH 溶液中由水电离出的 c(OH-)为___________ 。
Ⅱ.(1)某温度时,Ag2SO4 在水溶液中的沉淀溶解平衡曲线如图所示,计算此温度下 Ag2SO4 的溶度积常数 Ksp(Ag2SO4) =___________ 。

(2)某工业废水中含有 Fe2+、Cu2+、Mg2+等金属离子,且三者浓度相同。此条件下,各金属离子开始沉淀时的 pH 如下:
若采用向该溶液中滴加NaOH溶液的方法除去其中的金属离子,则先沉淀的是___________ 。
Ⅰ.温度为 t℃时,某 NaOH 稀溶液中 c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知:a+b=12,请回答下列问题:
(1)该温度下水的离子积常数 Kw=
(2)该 NaOH 溶液中由水电离出的 c(OH-)为
Ⅱ.(1)某温度时,Ag2SO4 在水溶液中的沉淀溶解平衡曲线如图所示,计算此温度下 Ag2SO4 的溶度积常数 Ksp(Ag2SO4) =

(2)某工业废水中含有 Fe2+、Cu2+、Mg2+等金属离子,且三者浓度相同。此条件下,各金属离子开始沉淀时的 pH 如下:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
您最近一年使用:0次
名校
10 . 化学与生活生产密切相关。下列说法中不正确的是
| A.施肥时,铵态氮肥不能与草木灰(含K2CO3)混合使用 |
| B.夏天冰箱保鲜食品的原理是降低温度,减小化学反应速率 |
| C.施用适量石膏(CaSO4·2H2O)可降低盐碱地(含较多NaCl、Na2CO3)的碱性 |
| D.将海水直接电解可获得 Mg及Cl2等单质 |
您最近一年使用:0次
2019-02-02更新
|
414次组卷
|
4卷引用:山西省原平市范亭中学2018-2019学年高二下学期期末考试化学试题



