名校
解题方法
1 . 用Cl2生产含氯有机物时会产生HCl。
利用反应__HCl(g)+__O2(g)⇌__Cl2(g)+__H2O(g)可实现氯的循环利用。
完成下列填空:
(1)配平该化学方程式,并标出电子转移的方向和数目。_____
(2)若将该反应设计成一原电池,则Cl2应在_____ (填“正极”或“负极”)附近逸出。
(3)上述反应中所有元素原子半径由大到小的顺序为_____ ;与氯元素同族的短周期元素原子最外层电子排布式为____ 。
(4)判断氯、溴非金属性强弱的依据是____ (选填序号)。
a.熔点:Cl2<Br2 b.氧化性:Cl2>Br2 c.热稳定性:HCl>HBr d.酸性:HCl<HBr
(5)上述反应若在固定体积的密闭容器中发生,能说明反应已达平衡的是__ (选填序号)。
a.2v(HCl)正=v(Cl2)逆 b.体系压强不再改变
c.混合气体密度不变 d.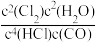 =K
=K
(6)若反应容器容积为2L,4molHCl与1molO2混合气体反应至8min时,测得容器内气体压强减小了10%,则用HCl表示的该反应的化学反应速率为___ 。
(7)图是在4种不同投料比下,温度对HCl平衡转化率影响的曲线( =1,2,4,6)
=1,2,4,6)
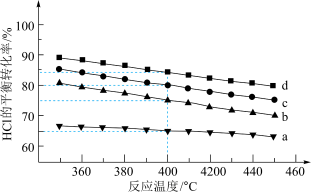
①曲线a对应的投料比
____ 。
②不改变投料比,使曲线b达到曲线d相同的HCl平衡转化率,可采取的措施有____ ;____ 。
利用反应__HCl(g)+__O2(g)⇌__Cl2(g)+__H2O(g)可实现氯的循环利用。
完成下列填空:
(1)配平该化学方程式,并标出电子转移的方向和数目。
(2)若将该反应设计成一原电池,则Cl2应在
(3)上述反应中所有元素原子半径由大到小的顺序为
(4)判断氯、溴非金属性强弱的依据是
a.熔点:Cl2<Br2 b.氧化性:Cl2>Br2 c.热稳定性:HCl>HBr d.酸性:HCl<HBr
(5)上述反应若在固定体积的密闭容器中发生,能说明反应已达平衡的是
a.2v(HCl)正=v(Cl2)逆 b.体系压强不再改变
c.混合气体密度不变 d.
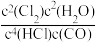 =K
=K(6)若反应容器容积为2L,4molHCl与1molO2混合气体反应至8min时,测得容器内气体压强减小了10%,则用HCl表示的该反应的化学反应速率为
(7)图是在4种不同投料比下,温度对HCl平衡转化率影响的曲线(
 =1,2,4,6)
=1,2,4,6)
①曲线a对应的投料比

②不改变投料比,使曲线b达到曲线d相同的HCl平衡转化率,可采取的措施有
您最近一年使用:0次
9-10高一下·黑龙江鹤岗·期末
名校
解题方法
2 . X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有H2放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为( )
| A.X>Z>Y>M | B.X>Y>Z>M |
| C.M>Z>X>Y | D.X>Z>M>Y |
您最近一年使用:0次
2020-03-19更新
|
262次组卷
|
26卷引用:2015届上海理工大学附中高三上学期月考化学试卷
2015届上海理工大学附中高三上学期月考化学试卷(已下线)09~10年鹤岗一中高一下学期期末考试化学卷(已下线)2010年福建省厦门六中高二上学期期中考试化学试卷(已下线)2010—2011学年河北省保北十二县市高一下学期期中联考化学试卷(已下线)2011-2012学年福建省罗源县第一中学高二上学期期中考试化学(理)试卷(已下线)2012-2013学年山东东营一中高二上学期第一次模块考试化学试卷(已下线)2012-2013学年内蒙古巴市中学高二12月月考化学试卷(已下线)2012-2013学年四川省雅安中学高二下学期期中考试化学试卷(已下线)2012-2013学年浙江省杭州市西湖高级中学高二5月月考化学试卷(已下线)2013-2014学年江苏省响水中学高二上学期期中考试化学试卷(选修)(已下线)2013-2014吉林省吉林一中高二下学期期末考试化学试卷(已下线)2014-2015学年浙江省杭州市西湖高级中学高二10月月考化学试卷2014-2015陕西省西安市一中高二上学期期末化学试卷2014-2015学年四川省雅安中学高二下期末模拟化学试卷2014-2015学年重庆市主城区六校高二上期末联考化学试卷2016届辽宁省五校协作体高三上学期期初考试化学试卷2015-2016学年湖北省黄石市有色一中高二上学期10月月考化学试卷2015-2016学年福建省龙海市程溪中学高二上学期期中测试化学试卷2015-2016学年辽宁庄河高中高二下期末化学试卷2017届北京市中央民族大学附中高三上9.12周练化学卷福建省三明市第一中学2017-2018学年高二上学期第一次月考化学试题甘肃省武威市第六中学2018-2019学年高一下学期第二次学段考试化学试题山西省太原市太原师范学院附属中学2019-2020学年高二上学期12月月考理科化学试题课时3 电能转化为化学能——A学习区 夯实基础(苏教版必修2)云南省云天化中学2019-2020学年高二下学期开学考试化学试题河北省衡水市武强中学2021-2022学年高二下学期期中考试化学试题
2013·上海崇明·二模
解题方法
3 . 在构成宇宙万物的一百多种元素中,金属约占了80%,它们在现代工业和新材料、新技术研究中具有至关重要的意义。现有a、b、c、d四种金属元素,a是人体内含量最多的金属元素,b是地壳中含量最多的金属元素,c是海水中含量最多的金属元素,d是人类冶炼最多的金属元素。
(1)元素a在元素周期表中的位置为______ ;a原子的核外能量不同的电子有____ 种。
(2)下列可以证明b、c金属性强弱的是_____ 。
A.最高价氧化物对应水化物的溶解性:b<c
B.单质与水反应的剧烈程度:b<c
C.相同条件下,氯化物水溶液的pH值:b<c
D.c可以从b的氯化物水溶液中置换出b
(3)人类冶炼d的时候一般得到的是d的合金,潮湿环境中其表面会产生一层水膜,从而发生腐蚀。下列关于该腐蚀的说法正确的是_____ 。
A.腐蚀过程中,一定会有气体放出
B.腐蚀过程中,水膜的碱性会增强
C.在酸性条件下,负极的电极反应式为:2H++2e-=H2↑
D.与电源的负极相连,可以防止发生这种腐蚀
(4)d单质在高温下会与水蒸气反应生成一种黑色固体和一种易燃性气体,且每生成1 mol该易燃气体放出37.68 kJ热量,请写出此反应的热化学方程式:_____________ 。
(1)元素a在元素周期表中的位置为
(2)下列可以证明b、c金属性强弱的是
A.最高价氧化物对应水化物的溶解性:b<c
B.单质与水反应的剧烈程度:b<c
C.相同条件下,氯化物水溶液的pH值:b<c
D.c可以从b的氯化物水溶液中置换出b
(3)人类冶炼d的时候一般得到的是d的合金,潮湿环境中其表面会产生一层水膜,从而发生腐蚀。下列关于该腐蚀的说法正确的是
A.腐蚀过程中,一定会有气体放出
B.腐蚀过程中,水膜的碱性会增强
C.在酸性条件下,负极的电极反应式为:2H++2e-=H2↑
D.与电源的负极相连,可以防止发生这种腐蚀
(4)d单质在高温下会与水蒸气反应生成一种黑色固体和一种易燃性气体,且每生成1 mol该易燃气体放出37.68 kJ热量,请写出此反应的热化学方程式:
您最近一年使用:0次



