名校
解题方法
1 . 某小组同学利用原电池装置探究物质的性质。
(1)同学们利用下表中装置进行实验并记录。
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是______________ 。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是______________ ;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________________ 。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是__________ 。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究________ 对O2氧化性的影响。
③实验Ⅳ中加入Na2SO4溶液的目的是_____________ 。
④为达到丁同学的目的,经讨论,同学们认为应改用下图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是________ ;重复实验时,记录电压表读数依次为c′、d′,且c′>d′,由此得出的结论是______________________________ 。
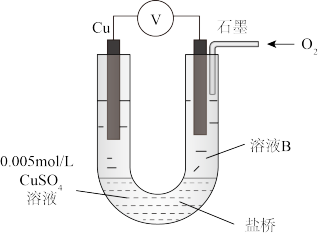
| 资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。 |
| 装置 | 编号 | 电极A | 溶液B | 操作及现象 |
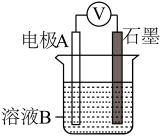 | Ⅰ | Fe | pH=2的H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
| Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
| 编号 | 溶液B | 操作及现象 |
| Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
| Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
| Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究
③实验Ⅳ中加入Na2SO4溶液的目的是
④为达到丁同学的目的,经讨论,同学们认为应改用下图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是

您最近一年使用:0次
2018-06-04更新
|
266次组卷
|
7卷引用:【校级联考】浙江省温州市“十五校联合体”2018-2019学年高二上学期期中联考化学试题
名校
2 . 几种离子在水溶液中有如下转化关系。下列说法正确的是


A.该条件下的氧化性: |
B.反应(1)中,每生成 ,转移3mol电子 ,转移3mol电子 |
C.将反应(2)设计成原电池, 向负极迁移 向负极迁移 |
D. 与 与 反应生成 反应生成 和 和 时,氧化剂与还原剂的物质的量之比为1∶2 时,氧化剂与还原剂的物质的量之比为1∶2 |
您最近一年使用:0次
2022-03-06更新
|
1069次组卷
|
8卷引用:【2023】【高一下】【其他】【余高2】【高中化学】【刘尼尼收集】
(已下线)【2023】【高一下】【其他】【余高2】【高中化学】【刘尼尼收集】河北省秦皇岛市青龙满族自治县 2021-2022学年高三下学期月考化学试题(已下线)秘籍12 原电池原理及应用-备战2022年高考化学抢分秘籍(全国通用)广东省广州市第十六中学2021-2022学年高一下学期期中检测 化学试题(已下线)专题04 氧化还原反应-三年(2020-2022)高考真题分项汇编(已下线)专题04 氧化还原反应-2022年高考真题模拟题分项汇编(已下线)微专题08 氧化性和还原性强弱的实验探究及应用-备战2023年高考化学一轮复习考点微专题广东省江门市新会第一中学2022-2023学年高一下学期3月月考化学试题
3 . 已知:①将0.1 mol/LKI溶液加入到0.1 mol/LFeCl3溶液中时,可以看到溶液颜色加深,滴加淀粉后溶液变为蓝色;②当离子浓度相同时,氧化性:Ag+>Fe3+;③若浓度减小时,离子的氧化性也会随之减弱。
(1)甲同学猜测,0.1 mol/L KI溶液(事先加入几滴淀粉溶液)加入到0.1 mol/LAgNO3溶液中时,溶液变蓝色。请写出该猜测对应的离子方程式______ 。实验结果未见到蓝色。
(2)乙同学认为甲同学的实验方案有问题,理由是_______ 。请你用设计实验证明Ag+也能氧化I-,要求画出实验装置图,并标明电极材料及电解质溶液_______ 。
(1)甲同学猜测,0.1 mol/L KI溶液(事先加入几滴淀粉溶液)加入到0.1 mol/LAgNO3溶液中时,溶液变蓝色。请写出该猜测对应的离子方程式
(2)乙同学认为甲同学的实验方案有问题,理由是
您最近一年使用:0次
11-12高二下·内蒙古包头·期中
名校
4 . 有关X、Y、Z、W四种金属进行如下实验:
根据以上事实,下列判断或推测错误的是
| ① | 将X和Y用导线连接,浸入电解质溶液中,Y不易腐蚀 |
| ② | 将片状的X、W分别投入等浓度盐酸中都有气体产生,W比X反应剧烈 |
| ③ | 用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出单质Z |
| A.Z的阳离子氧化性最强 |
| B.W的还原性强于Y的还原性 |
| C.Z放入CuSO4溶液中一定有Cu析出 |
| D.用X、Z和稀硫酸可构成原电池,且X做负极 |
您最近一年使用:0次
2013-01-15更新
|
482次组卷
|
7卷引用:2014届浙江省杭州十四中高二上学期期末化学试卷
(已下线)2014届浙江省杭州十四中高二上学期期末化学试卷 2015-2016学年浙江省海宁市三校高二下学期期中化学试卷(已下线)2011-2012学年内蒙古包头三十三中高二下学期期中考试化学试卷(已下线)2012-2013学年内蒙古巴市中学高二12月月考化学试卷模拟卷05(必考+选考)——2020年秋高三化学开学摸底考试卷(全国通用)河北省保定市唐县第一中学2020-2021学年高二9月月考化学试题甘肃省张掖市第二中学2021届高三上学期10月月考化学试题
解题方法
5 . 某同学将反应2Fe3++2I-=2Fe2++I2设计成下图所示的原电池:
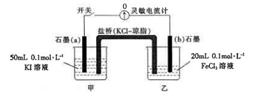
实验步骤及现象如下:
①闭合开关,指针发生偏转,随后电流计读数逐渐变小,当读数变为零时,打开开关;
②取少许甲烧杯中溶液,滴入3~4滴淀粉溶液,溶液显蓝色;
③取少许乙烧杯中溶液,滴入3~4滴KSCN溶液,溶液显血红色;
④向乙烧杯中加入少量FeCl2固体,再次闭合开关,指针向左偏转(最后读数变为零)。
【查阅资料】灵敏电流计指针总是偏向电源正极;原电池中存在内阻,会影响反应进程。
请回答:
(1)步骤①中,开始时指针向_____ (填“左"或“右”)偏转,甲烧杯中发生的电极反应式____________________ 。
(2)经步骤①后,乙烧杯溶液中新增金属阳离子____________ (填离子符号)。
(3)步骤④中指针向左偏转,乙烧杯中发生的电极反应式______________________ 。
(4)要证明2Fe3++2I- 2Fe2++I2 为可逆反应,你认为上述实验步骤不必做的是
2Fe2++I2 为可逆反应,你认为上述实验步骤不必做的是______________ (填序号)。

实验步骤及现象如下:
①闭合开关,指针发生偏转,随后电流计读数逐渐变小,当读数变为零时,打开开关;
②取少许甲烧杯中溶液,滴入3~4滴淀粉溶液,溶液显蓝色;
③取少许乙烧杯中溶液,滴入3~4滴KSCN溶液,溶液显血红色;
④向乙烧杯中加入少量FeCl2固体,再次闭合开关,指针向左偏转(最后读数变为零)。
【查阅资料】灵敏电流计指针总是偏向电源正极;原电池中存在内阻,会影响反应进程。
请回答:
(1)步骤①中,开始时指针向
(2)经步骤①后,乙烧杯溶液中新增金属阳离子
(3)步骤④中指针向左偏转,乙烧杯中发生的电极反应式
(4)要证明2Fe3++2I-
 2Fe2++I2 为可逆反应,你认为上述实验步骤不必做的是
2Fe2++I2 为可逆反应,你认为上述实验步骤不必做的是
您最近一年使用:0次
2018-03-06更新
|
332次组卷
|
2卷引用:浙江省金华十校2017-2018学年高二上学期期末调研考试化学试题
名校
解题方法
6 . 下列各实验操作、现象及所得结论都正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 用玻璃棒蘸取某无色溶液进行焰色试验 | 焰色呈黄色 | 溶液中含有钠元素 |
| B | 向黄色的 溶液中滴加氢碘酸( 溶液中滴加氢碘酸( 水溶液),再滴入几滴淀粉溶液 水溶液),再滴入几滴淀粉溶液 | 溶液变为蓝色 | 氧化性: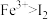 |
| C | 向 溶液中加入稀硫酸,将产生的气体直接通入硅酸钠溶液中 溶液中加入稀硫酸,将产生的气体直接通入硅酸钠溶液中 | 产生白色浑浊 | 非金属性: |
| D | 纯锌与稀硫酸反应时,向溶液中滴入几滴 溶液 溶液 | 产生气泡的速度加快 |  是锌与稀硫酸反应的催化剂 是锌与稀硫酸反应的催化剂 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
7 . 已知负极的电极反应式为:Ag+Cl--e-=AgCl。下列说法不正确 的是


| A.正极的电极反应式是Ag++e-=Ag |
| B.电池总反应可表示为Ag+ +Cl-=AgCl |
C.反应时,盐桥中的NO 移向KCl溶液 移向KCl溶液 |
| D.该电池证明:Ag+浓度越大,氧化性越弱 |
您最近一年使用:0次
名校
8 . 下列说法正确的是
| A.用含有少量硫酸铜的稀硫酸跟锌粒反应,能加快产生氢气,说明Cu2+具有催化能力 |
| B.增大浓度会加快化学反应速率,是因为增加了反应物单位体积内活化分子的百分数 |
| C.等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA<HB |
| D.碱性锌锰电池是一种常见的二次电池 |
您最近一年使用:0次
2021-09-23更新
|
141次组卷
|
2卷引用:浙江省天台县育才中学2021-2022学年高二上学期第一次月考试卷化学试题
9-10高一下·黑龙江鹤岗·期末
名校
解题方法
9 . X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有H2放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为( )
| A.X>Z>Y>M | B.X>Y>Z>M |
| C.M>Z>X>Y | D.X>Z>M>Y |
您最近一年使用:0次
2020-03-19更新
|
262次组卷
|
26卷引用:2012-2013学年浙江省杭州市西湖高级中学高二5月月考化学试卷
(已下线)2012-2013学年浙江省杭州市西湖高级中学高二5月月考化学试卷(已下线)2014-2015学年浙江省杭州市西湖高级中学高二10月月考化学试卷(已下线)09~10年鹤岗一中高一下学期期末考试化学卷(已下线)2010年福建省厦门六中高二上学期期中考试化学试卷(已下线)2010—2011学年河北省保北十二县市高一下学期期中联考化学试卷(已下线)2011-2012学年福建省罗源县第一中学高二上学期期中考试化学(理)试卷(已下线)2012-2013学年山东东营一中高二上学期第一次模块考试化学试卷(已下线)2012-2013学年内蒙古巴市中学高二12月月考化学试卷(已下线)2012-2013学年四川省雅安中学高二下学期期中考试化学试卷(已下线)2013-2014学年江苏省响水中学高二上学期期中考试化学试卷(选修)(已下线)2013-2014吉林省吉林一中高二下学期期末考试化学试卷2015届上海理工大学附中高三上学期月考化学试卷2014-2015陕西省西安市一中高二上学期期末化学试卷2014-2015学年四川省雅安中学高二下期末模拟化学试卷2014-2015学年重庆市主城区六校高二上期末联考化学试卷2016届辽宁省五校协作体高三上学期期初考试化学试卷2015-2016学年湖北省黄石市有色一中高二上学期10月月考化学试卷2015-2016学年福建省龙海市程溪中学高二上学期期中测试化学试卷2015-2016学年辽宁庄河高中高二下期末化学试卷2017届北京市中央民族大学附中高三上9.12周练化学卷福建省三明市第一中学2017-2018学年高二上学期第一次月考化学试题甘肃省武威市第六中学2018-2019学年高一下学期第二次学段考试化学试题山西省太原市太原师范学院附属中学2019-2020学年高二上学期12月月考理科化学试题课时3 电能转化为化学能——A学习区 夯实基础(苏教版必修2)云南省云天化中学2019-2020学年高二下学期开学考试化学试题河北省衡水市武强中学2021-2022学年高二下学期期中考试化学试题



