1 . FeSO4溶液放置在空气中容易变质,因此为了方便使用Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)2•6H2O],它比绿矾或绿矾溶液更稳定。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作_______ 、冷却结晶、过滤、洗涤和干燥后得到一种浅蓝绿色的晶体。
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
【资料1】
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___________________ 。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:__________________________________________________ 。
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
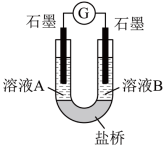
【资料2】原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
【资料3】常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式_________________ 。
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为______ 。
③对比实验_____ 和_____ 还可得出在一定 pH范围内,溶液酸碱性变化是对O2氧化性强弱的影响因素。
④对【资料3】实验事实的解释为____________________ 。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
【资料1】
| 沉淀 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀 pH | 7.6 | 2.7 |
| 完全沉淀 pH | 9.6 | 3.7 |
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
| 序号 | A 0.2mol/LNaCl | B 0.1mol/LFeSO4 | 电流计读数 |
| 实验1 | pH=1 | pH=5 | 8.4 |
| 实验2 | pH=1 | pH=1 | 6.5 |
| 实验3 | pH=6 | pH=5 | 7.8 |
| 实验4 | pH=6 | pH=1 | 5.5 |

【资料2】原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
【资料3】常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为
③对比实验
④对【资料3】实验事实的解释为
您最近一年使用:0次
2020-04-02更新
|
344次组卷
|
4卷引用:山东省2020届高三模拟考试化学试题
山东省2020届高三模拟考试化学试题北京市门头沟区2020届高三3月综合练习化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编:科学探究江苏省昆山中学2022-2023学年高一下学期期中考试化学试题
名校
解题方法
2 . 下列实验方案的设计能达到相应实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 验证Cl2的氧化性强于Br2 | 向FeBr2溶液中通入少量Cl2 |
| B | 比较HF与HClO的酸性强弱 | 常温下,用pH计分别测定浓度为0.1 mol/L的NaF溶液和NaClO溶液的pH |
| C | 验证FeCl3与KI的反应是可逆反应 | 向1 mL0.1 mol/L FeCl3的溶液中滴加5 mL0.1mol/LKI溶液,充分反应后,取少量混合液滴加淀粉溶液 |
| D | 比较Fe与Cu的金属活动性 | 常温下,将Fe、Cu与浓硝酸组成原电池 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 下列实验装置能达到实验目的的是
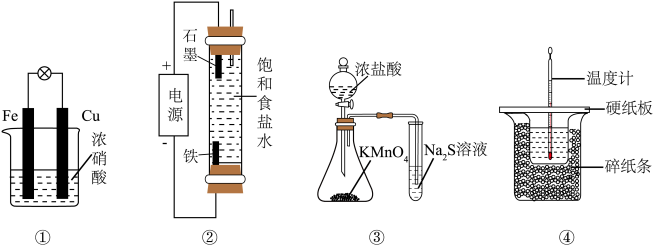
| A.装置①验证Fe和Cu的还原性强弱 | B.装置②制备少量NaClO |
C.装置③比较 、 、 和S的氧化性 和S的氧化性 | D.装置④测定中和反应的反应热 |
您最近一年使用:0次
名校
解题方法
4 . 实验室探究 溶液与
溶液与 的反应。
的反应。
I.如图所示制备(经检验装置气密性良好)。

(1)仪器a的名称是_______ 。
(2)写出C中制备 的离子方程式
的离子方程式_______ 。
II.探究 溶液与
溶液与 的反应,过程如图所示:
的反应,过程如图所示:

已知:硫酸亚铜易溶于水。
回答下列问题:
(3)加入 固体后产生的无色气体和白色沉淀经检验分别是
固体后产生的无色气体和白色沉淀经检验分别是 和
和 ,说明发生了氧化还原反应。加入
,说明发生了氧化还原反应。加入 固体发生反应的原因。
固体发生反应的原因。
a. 改变了
改变了 的还原性 b.
的还原性 b. 改变了
改变了 的氧化性
的氧化性
用原电池原理进行试验,探究上述现象可能的原因。
①由实验1、2可知原因a不合理,依据是_______ 。
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。

i.补全电化学装置示意图_______ 。
ii.写出B中的电极反应方程式中_______ 。
iii.请从反应原理的角度解释原因: 与
与 的还原产物
的还原产物 形成沉淀,
形成沉淀,_______ ,使 与
与 的反应能够反应完全。
的反应能够反应完全。
 溶液与
溶液与 的反应。
的反应。I.如图所示制备(经检验装置气密性良好)。

(1)仪器a的名称是
(2)写出C中制备
 的离子方程式
的离子方程式II.探究
 溶液与
溶液与 的反应,过程如图所示:
的反应,过程如图所示:
已知:硫酸亚铜易溶于水。
回答下列问题:
(3)加入
 固体后产生的无色气体和白色沉淀经检验分别是
固体后产生的无色气体和白色沉淀经检验分别是 和
和 ,说明发生了氧化还原反应。加入
,说明发生了氧化还原反应。加入 固体发生反应的原因。
固体发生反应的原因。a.
 改变了
改变了 的还原性 b.
的还原性 b. 改变了
改变了 的氧化性
的氧化性用原电池原理进行试验,探究上述现象可能的原因。
| 编号 | 实验1 | 实验2 |
| 实验 |  |  |
| 现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 |
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。

i.补全电化学装置示意图
ii.写出B中的电极反应方程式中
iii.请从反应原理的角度解释原因:
 与
与 的还原产物
的还原产物 形成沉淀,
形成沉淀, 与
与 的反应能够反应完全。
的反应能够反应完全。
您最近一年使用:0次
名校
解题方法
5 . 某实验小组依据反应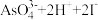 ⇌
⇌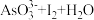 设计如图1电池,探究pH对
设计如图1电池,探究pH对 氧化性的影响,测得输出电压与pH的关系如图2。下列有关叙述错误的是( )
氧化性的影响,测得输出电压与pH的关系如图2。下列有关叙述错误的是( )
图1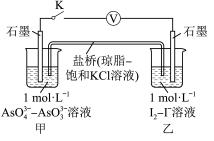 图2
图2
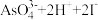 ⇌
⇌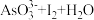 设计如图1电池,探究pH对
设计如图1电池,探究pH对 氧化性的影响,测得输出电压与pH的关系如图2。下列有关叙述错误的是( )
氧化性的影响,测得输出电压与pH的关系如图2。下列有关叙述错误的是( )图1
 图2
图2
A.c点时,正极的电极反应为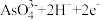 = =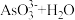 |
| B.b点时,反应处于化学平衡状态 |
| C.a点时,盐桥中K+向左移动 |
D.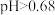 时,氧化性 时,氧化性 |
您最近一年使用:0次
2020-05-01更新
|
361次组卷
|
6卷引用:2016届山东省烟台市高三上学期期末统考化学试卷
6 . 根据实验操作和现象,对应结论正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 将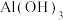 固体粉末加入过量NaOH溶液,搅拌 固体粉末加入过量NaOH溶液,搅拌 | 固体完全溶解,形成无色溶液 | 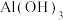 既体现酸性又体现碱性 既体现酸性又体现碱性 |
B | 用洁净的铂丝蘸取某溶液在酒精灯火焰灼烧 | 火焰呈黄色 | 该溶液是钠的盐溶液 |
C | 将银和硝酸银溶液与铜和硫酸铜稀溶液组成原电池,连通后一段时间 | 银表面有金属沉积,铜附近溶液蓝色变深 | 铜的金属性比银强 |
D | 向两支均盛有5mL 10%  溶液的试管中,分别加入0.1 溶液的试管中,分别加入0.1 的 的 溶液和0.1 溶液和0.1  溶液 溶液 | 产生气泡,加入 溶液的试管中产生气泡快 溶液的试管中产生气泡快 |  比 比 的催化效果更好 的催化效果更好 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 下列选项中叙述Ⅰ和Ⅱ均正确并有因果关系的是
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 酸性:  | 非金属性: |
| B | 铁表面镀锌可以增强其抗腐蚀性 | 铁、锌可构成原电池且铁作负极 |
| C |  在 在 中燃烧的生成物中含离子键 中燃烧的生成物中含离子键 |  固体可导电 固体可导电 |
| D | 向 溶液中滴入少量氯水,振荡,充分反应,再滴加淀粉,溶液变蓝色 溶液中滴入少量氯水,振荡,充分反应,再滴加淀粉,溶液变蓝色 |  的还原性强于 的还原性强于 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-05-20更新
|
168次组卷
|
2卷引用: 山东省济南市章丘区、历城区、长清区2021-2022学年高一下学期期中考试化学试题
9-10高一下·黑龙江鹤岗·期末
名校
解题方法
8 . X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有H2放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为( )
| A.X>Z>Y>M | B.X>Y>Z>M |
| C.M>Z>X>Y | D.X>Z>M>Y |
您最近一年使用:0次
2020-03-19更新
|
262次组卷
|
26卷引用:2012-2013学年山东东营一中高二上学期第一次模块考试化学试卷
(已下线)2012-2013学年山东东营一中高二上学期第一次模块考试化学试卷(已下线)09~10年鹤岗一中高一下学期期末考试化学卷(已下线)2010年福建省厦门六中高二上学期期中考试化学试卷(已下线)2010—2011学年河北省保北十二县市高一下学期期中联考化学试卷(已下线)2011-2012学年福建省罗源县第一中学高二上学期期中考试化学(理)试卷(已下线)2012-2013学年内蒙古巴市中学高二12月月考化学试卷(已下线)2012-2013学年四川省雅安中学高二下学期期中考试化学试卷(已下线)2012-2013学年浙江省杭州市西湖高级中学高二5月月考化学试卷(已下线)2013-2014学年江苏省响水中学高二上学期期中考试化学试卷(选修)(已下线)2013-2014吉林省吉林一中高二下学期期末考试化学试卷(已下线)2014-2015学年浙江省杭州市西湖高级中学高二10月月考化学试卷2015届上海理工大学附中高三上学期月考化学试卷2014-2015陕西省西安市一中高二上学期期末化学试卷2014-2015学年四川省雅安中学高二下期末模拟化学试卷2014-2015学年重庆市主城区六校高二上期末联考化学试卷2016届辽宁省五校协作体高三上学期期初考试化学试卷2015-2016学年湖北省黄石市有色一中高二上学期10月月考化学试卷2015-2016学年福建省龙海市程溪中学高二上学期期中测试化学试卷2015-2016学年辽宁庄河高中高二下期末化学试卷2017届北京市中央民族大学附中高三上9.12周练化学卷福建省三明市第一中学2017-2018学年高二上学期第一次月考化学试题甘肃省武威市第六中学2018-2019学年高一下学期第二次学段考试化学试题山西省太原市太原师范学院附属中学2019-2020学年高二上学期12月月考理科化学试题课时3 电能转化为化学能——A学习区 夯实基础(苏教版必修2)云南省云天化中学2019-2020学年高二下学期开学考试化学试题河北省衡水市武强中学2021-2022学年高二下学期期中考试化学试题
9-10高二下·江西·期中
名校
解题方法
9 . 根据下列事实,判断离子的氧化性顺序为①A+B2+=A2++B;②D+2H2O=D(OH)2+H2↑;③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E,B-2e-=B2+ ( )
| A.D2+>A2+>B2+>E2+ | B.D2+>E2+>A2+>B2+ |
| C.E2+>B2+>A2+>D2+ | D.A2+>B2+>D2+>E2+ |
您最近一年使用:0次
2019-12-25更新
|
399次组卷
|
20卷引用:山东省济南市2019-2020年高三10月月考化学试题
(已下线)山东省济南市2019-2020年高三10月月考化学试题(已下线)09~10年江西四校高二下学期期中联考化学卷(已下线)2010年江西省吉安市高一下学期期末考试化学试题(已下线)2010年海南省嘉积中学高二上学期教学质量检测(三)化学试卷(已下线)2010年长春外国语学校高二第一学期期末考试化学试卷(已下线)2011-2012学年福建省厦门一中高二上学期期中考试化学试卷(已下线)2011-2012学年陕西省宝鸡中学高二下学期期末考试化学试卷(已下线)2014年高一下学期化学必修2 2-2-1 化学能转化为电能练习卷2014-2015辽宁省实验中学分校高一下学期期中考试化学试卷2015-2016学年河北省石家庄市辛集中学高一下期中理科化学试卷云南省曲靖市第一中学2016-2017学年高一下学期期中考试化学试题甘肃省陇东中学2016-2017学年高一下学期期末考试化学试题黑龙江省鸡西市第十九中学2019届高三上学期期中考试化学试题西藏自治区拉萨市那曲第二高级中学2018-2019学年高二下学期第一次月考化学试题北京市海淀区首都师范大学附属中学2019-2020学年高一下学期第二次月考化学试题第二章 化学反应与能量学 综合拓展——B 拓展区 夯实基础(人教版必修2)湖北省武汉市钢城第四中学2019-2020高一下学期期中考试化学试题四川省达州市大竹中学2020-2021学年高一下学期期中考试化学试题(苏教版2019)必修第二册专题6 化学反应与能量变化 B 素养拓展区河北省保定市唐县第一中学2022-2023学年高一下学期5月月考化学试题
名校
解题方法
10 . 根据下列事实:①A+B2+=A2++B;②D+2H2O=D(OH)2↓+H2↑;③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E,B﹣2e-=B2+.由此可知A2+、B2+、D2+、E2+的氧化性强弱关系是
| A.D2+>A2+>B2+>E2+ | B.B2+>A2+>D2+>E2+ |
| C.D2+>E2+>A2+>B2+ | D.E2+>B2+>A2+>D2+ |
您最近一年使用:0次
2016-05-23更新
|
202次组卷
|
9卷引用:山东省济南外国语学校三箭分校2016-2017学年高二下学期期末考试化学试题



