1 . FeSO4溶液放置在空气中容易变质,因此为了方便使用Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)2•6H2O],它比绿矾或绿矾溶液更稳定。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作_______ 、冷却结晶、过滤、洗涤和干燥后得到一种浅蓝绿色的晶体。
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
【资料1】
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___________________ 。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:__________________________________________________ 。
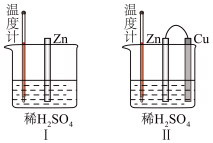
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
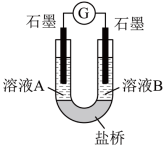
【资料2】原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
【资料3】常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式_________________ 。
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为______ 。
③对比实验_____ 和_____ 还可得出在一定 pH范围内,溶液酸碱性变化是对O2氧化性强弱的影响因素。
④对【资料3】实验事实的解释为____________________ 。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
【资料1】
| 沉淀 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀 pH | 7.6 | 2.7 |
| 完全沉淀 pH | 9.6 | 3.7 |
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
| 序号 | A 0.2mol/LNaCl | B 0.1mol/LFeSO4 | 电流计读数 |
| 实验1 | pH=1 | pH=5 | 8.4 |
| 实验2 | pH=1 | pH=1 | 6.5 |
| 实验3 | pH=6 | pH=5 | 7.8 |
| 实验4 | pH=6 | pH=1 | 5.5 |

【资料2】原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
【资料3】常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为
③对比实验
④对【资料3】实验事实的解释为
您最近一年使用:0次
2020-04-02更新
|
344次组卷
|
4卷引用:江苏省昆山中学2022-2023学年高一下学期期中考试化学试题
江苏省昆山中学2022-2023学年高一下学期期中考试化学试题北京市门头沟区2020届高三3月综合练习化学试题山东省2020届高三模拟考试化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编:科学探究
2 . 用化学方法降解水中有机物已成为污水处理领域的重要研究方向。硝基苯是一种具有稳定化学性质、高毒性、难生物降解的污染物。工业上采用吸附、还原、氧化等方法可有效降解废水中的硝基苯。
(1)活性炭因为有较大的比表面积、多孔结构而具有较强的吸附能力,其物理吸附平衡建立如图所示。活性炭处理低浓度的硝基苯废水时,当温度超过50℃,活性炭对硝基苯的吸附量显著下降,原因是:______________________ (请从平衡移动角度解释)。

(2)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图所示。铁炭混合物中极小颗粒的炭分散在铁屑内,具有吸附作用,同时作正极材料构成原电池加快反应速率,还能防止铁屑结块。

①该物质转化示意图可以描述为:___________ 。
②酸性环境中,铁炭混合物处理硝基苯废水,难生物降解的硝基苯首先被还原为亚硝基苯( ),然后进一步被还原成可生物降解的苯胺,写出生成亚硝基苯的电极反应式:
),然后进一步被还原成可生物降解的苯胺,写出生成亚硝基苯的电极反应式:___________ 。
③其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图所示。pH越大,硝基苯的去除率越低的原因是:___________ 。

(3)研究发现, 在
在 作用下能够生成羟基自由基(HO·)。HO·具有很强的氧化作用,是氧化硝基苯的有效因子。向含
作用下能够生成羟基自由基(HO·)。HO·具有很强的氧化作用,是氧化硝基苯的有效因子。向含 和苯胺(
和苯胺( )的酸性溶液中加入双氧水,写出生成HO·的离子反应方程式:
)的酸性溶液中加入双氧水,写出生成HO·的离子反应方程式:___________ 。
(4)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图所示。反应相同时间,初始溶液 时苯胺浓度大于
时苯胺浓度大于 时的原因是
时的原因是___________ 。[已知氧化性: ]
]

(1)活性炭因为有较大的比表面积、多孔结构而具有较强的吸附能力,其物理吸附平衡建立如图所示。活性炭处理低浓度的硝基苯废水时,当温度超过50℃,活性炭对硝基苯的吸附量显著下降,原因是:

(2)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图所示。铁炭混合物中极小颗粒的炭分散在铁屑内,具有吸附作用,同时作正极材料构成原电池加快反应速率,还能防止铁屑结块。

①该物质转化示意图可以描述为:
②酸性环境中,铁炭混合物处理硝基苯废水,难生物降解的硝基苯首先被还原为亚硝基苯(
 ),然后进一步被还原成可生物降解的苯胺,写出生成亚硝基苯的电极反应式:
),然后进一步被还原成可生物降解的苯胺,写出生成亚硝基苯的电极反应式:③其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图所示。pH越大,硝基苯的去除率越低的原因是:

(3)研究发现,
 在
在 作用下能够生成羟基自由基(HO·)。HO·具有很强的氧化作用,是氧化硝基苯的有效因子。向含
作用下能够生成羟基自由基(HO·)。HO·具有很强的氧化作用,是氧化硝基苯的有效因子。向含 和苯胺(
和苯胺( )的酸性溶液中加入双氧水,写出生成HO·的离子反应方程式:
)的酸性溶液中加入双氧水,写出生成HO·的离子反应方程式:(4)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图所示。反应相同时间,初始溶液
 时苯胺浓度大于
时苯胺浓度大于 时的原因是
时的原因是 ]
]
您最近一年使用:0次
名校
解题方法
3 . 饮用水中的2-溴乙酰胺MBAcAm的常见的去除方法有:活性炭吸附法、铁铜还原法和高铁酸盐氧化法
(1)活性炭吸附法:
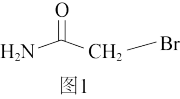
①2-溴乙酰胺的结构简式如图1所示,1mol该分子中含有的σ键数目为_______ 。
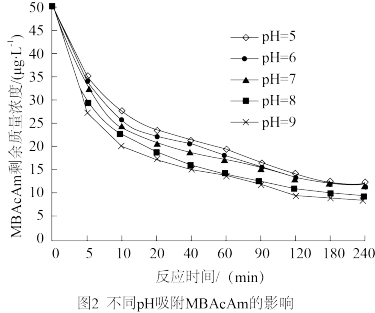
②研究发现,溶液的pH对2-溴乙酸胺的去除率影响如图2所示,分析pH增大去除率增大的原因_______ 。
(2)铁铜还原法:
研究发现不同的铁铜质量比对2-溴乙酰胺的去除效果如图3,相同时间内,铁铜混合物较单纯的铁去除速率快的原因是_______ 。

(3)高铁酸盐氧化法:
已知:高铁酸钾易溶于水,具有强氧化性,酸性越强,氧化性越强;
高铁酸钾在酸性环境下不稳定;
高铁酸钾在一定pH的水溶液中易生成Fe(OH)3胶体。
①写出高铁酸钾在pH=8条件下与水反应生成Fe(OH)3胶体和O2的离子反应方程式_______ 。
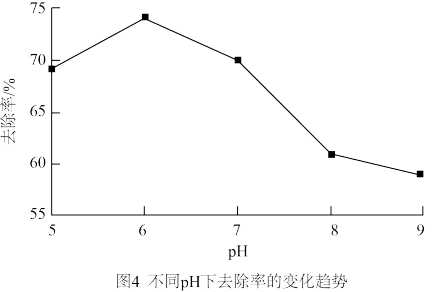
②研究发现不同pH下对二溴乙酸胺的去除效果如图4,请分析选择pH=6的原因_______ 。 (从pH小于6和大于6两个方面作答)
(1)活性炭吸附法:
①2-溴乙酰胺的结构简式如图1所示,1mol该分子中含有的σ键数目为

②研究发现,溶液的pH对2-溴乙酸胺的去除率影响如图2所示,分析pH增大去除率增大的原因

(2)铁铜还原法:
研究发现不同的铁铜质量比对2-溴乙酰胺的去除效果如图3,相同时间内,铁铜混合物较单纯的铁去除速率快的原因是

(3)高铁酸盐氧化法:
已知:高铁酸钾易溶于水,具有强氧化性,酸性越强,氧化性越强;
高铁酸钾在酸性环境下不稳定;
高铁酸钾在一定pH的水溶液中易生成Fe(OH)3胶体。
①写出高铁酸钾在pH=8条件下与水反应生成Fe(OH)3胶体和O2的离子反应方程式
②研究发现不同pH下对二溴乙酸胺的去除效果如图4,请分析选择pH=6的原因

您最近一年使用:0次
9-10高二下·江苏·期末
解题方法
4 . 不同的金属在化学反应中表现出来的活泼程度不同,俄国化学家贝开托夫在大量实验和系统研究之后,于1865年发表了金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 。
(1)金属活动性顺序是学习“金属及其化合物”的重要工具,许多“金属及其化合物”的知识规律可以通过金属活动性顺序来掌握。例如,工业上冶炼金属,根据金属活动性顺序可以采用不同的冶炼方法。其中可以用“热分解法”冶炼的金属是__________ 、________ 。
工业上又常用下列反应进行金属钾的冶炼: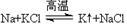 ,似乎“违背”了金属活动性顺序,试解释钠能将更活泼的钾置换出来的原因
,似乎“违背”了金属活动性顺序,试解释钠能将更活泼的钾置换出来的原因__________________________ 。
(2)在实践中发现还有许多化学事实 “违背”金属活动性顺序,但这些“反常”现象都可以通过化学原理得到合理解释。某学生在做探究实验时,把锌粒投入1mol·L-1氯化铁溶液中,观察到如下实验现象:锌粒表面有一定量气泡产生,溶液颜色逐渐变浅,一段时间后溶液逐渐浑浊,试用相关反应方程式进行解释___________________ 、________________ 。
(3)研究金属活动性顺序还可以指导对金属阳离子氧化性强弱的认识,工业上用氯化铁溶液腐蚀铜制电路板。
①请根据金属活动性顺序结合该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性强弱_______ 。
②请运用原电池原理设计实验验证Cu2+、Fe3+氧化性强弱的结论。方案___________ 。
(1)金属活动性顺序是学习“金属及其化合物”的重要工具,许多“金属及其化合物”的知识规律可以通过金属活动性顺序来掌握。例如,工业上冶炼金属,根据金属活动性顺序可以采用不同的冶炼方法。其中可以用“热分解法”冶炼的金属是
工业上又常用下列反应进行金属钾的冶炼:
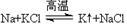 ,似乎“违背”了金属活动性顺序,试解释钠能将更活泼的钾置换出来的原因
,似乎“违背”了金属活动性顺序,试解释钠能将更活泼的钾置换出来的原因(2)在实践中发现还有许多化学事实 “违背”金属活动性顺序,但这些“反常”现象都可以通过化学原理得到合理解释。某学生在做探究实验时,把锌粒投入1mol·L-1氯化铁溶液中,观察到如下实验现象:锌粒表面有一定量气泡产生,溶液颜色逐渐变浅,一段时间后溶液逐渐浑浊,试用相关反应方程式进行解释
(3)研究金属活动性顺序还可以指导对金属阳离子氧化性强弱的认识,工业上用氯化铁溶液腐蚀铜制电路板。
①请根据金属活动性顺序结合该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性强弱
②请运用原电池原理设计实验验证Cu2+、Fe3+氧化性强弱的结论。方案
您最近一年使用:0次
名校
解题方法
5 . 化学电源在生产生活中有着广泛的应用,同学们常常通过设计实验和查阅资料的方式学习化学电源的相关知识。
(1)甲同学为了解化学反应中的能量转化,设计了一组对比实验(实验装置如图Ⅰ和图Ⅱ)。预计产生气体的速率Ⅰ___________ Ⅱ(>、<或=),温度计的示数Ⅰ___________ II(>、<或=);___________ ,当量筒中收集到336mL(标准状况下)气体时,通过导线的电子的物质的量为___________ 。___________ 极(填“正”或“负”),若原料气H2中混有CO,单位体积原料气合成氨气的物质的量不变,只是在电极b附近需增设排气口,排出气体主要含有___________ 。
(1)甲同学为了解化学反应中的能量转化,设计了一组对比实验(实验装置如图Ⅰ和图Ⅱ)。预计产生气体的速率Ⅰ
您最近一年使用:0次
2023-10-04更新
|
320次组卷
|
3卷引用:江苏省扬州中学2022-2023学年高一下学期3月月考化学试题
名校
6 . 根据下列有关实验得出的结论一定正确的是
| 选项 | 实验 | 结论 |
| A | 在容积可变的密闭容器中发生反应:2NH3(g) N2(g)+3H2(g),向其中通入氩气 N2(g)+3H2(g),向其中通入氩气 | 反应速率减慢 |
| B | 向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液,溶液变黄 | 氧化性:H2O2>Fe3+ |
| C | 相同温度下,将等质量的大理石块和大理石粉分别加入等体积的盐酸中 | 反应速率:粉状大理石>块状大理石 |
| D | 相同温度下,向盛有足量稀硫酸的甲、乙两支试管中分别加入等质量的锌粒,并向甲中加入少量胆矾固体 | 产生氢气的速率和体积:甲>乙 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022·安徽蚌埠·三模
名校
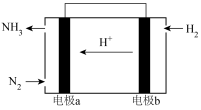
7 . 一种铁铬液流电池的工作原理如图所示 已知氧化性Fe3+>Cr3+,下列说法不正确的是
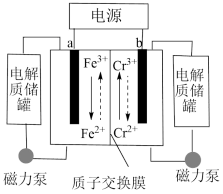

| A.放电时,a电极的电势高于b电极 |
| B.放电时,电池的总反应为:Cr2++Fe3+=Cr3++Fe2+ |
| C.充电时,b极与电源负极相连,电极反应式为:Cr3++e-=Cr2+ |
| D.充电时,电路中通过0.1mol电子时,0.1NA个H+由右侧电极室经交换膜移向左侧 |
您最近一年使用:0次
2022-04-02更新
|
535次组卷
|
3卷引用:化学-2022年高考考前押题密卷(江苏卷)
9-10高一下·黑龙江鹤岗·期末
名校
解题方法
8 . X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有H2放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为( )
| A.X>Z>Y>M | B.X>Y>Z>M |
| C.M>Z>X>Y | D.X>Z>M>Y |
您最近一年使用:0次
2020-03-19更新
|
256次组卷
|
26卷引用:2013-2014学年江苏省响水中学高二上学期期中考试化学试卷(选修)
(已下线)2013-2014学年江苏省响水中学高二上学期期中考试化学试卷(选修)(已下线)09~10年鹤岗一中高一下学期期末考试化学卷(已下线)2010年福建省厦门六中高二上学期期中考试化学试卷(已下线)2010—2011学年河北省保北十二县市高一下学期期中联考化学试卷(已下线)2011-2012学年福建省罗源县第一中学高二上学期期中考试化学(理)试卷(已下线)2012-2013学年山东东营一中高二上学期第一次模块考试化学试卷(已下线)2012-2013学年内蒙古巴市中学高二12月月考化学试卷(已下线)2012-2013学年四川省雅安中学高二下学期期中考试化学试卷(已下线)2012-2013学年浙江省杭州市西湖高级中学高二5月月考化学试卷(已下线)2013-2014吉林省吉林一中高二下学期期末考试化学试卷(已下线)2014-2015学年浙江省杭州市西湖高级中学高二10月月考化学试卷2015届上海理工大学附中高三上学期月考化学试卷2014-2015陕西省西安市一中高二上学期期末化学试卷2014-2015学年四川省雅安中学高二下期末模拟化学试卷2014-2015学年重庆市主城区六校高二上期末联考化学试卷2016届辽宁省五校协作体高三上学期期初考试化学试卷2015-2016学年湖北省黄石市有色一中高二上学期10月月考化学试卷2015-2016学年福建省龙海市程溪中学高二上学期期中测试化学试卷2015-2016学年辽宁庄河高中高二下期末化学试卷2017届北京市中央民族大学附中高三上9.12周练化学卷福建省三明市第一中学2017-2018学年高二上学期第一次月考化学试题甘肃省武威市第六中学2018-2019学年高一下学期第二次学段考试化学试题山西省太原市太原师范学院附属中学2019-2020学年高二上学期12月月考理科化学试题课时3 电能转化为化学能——A学习区 夯实基础(苏教版必修2)云南省云天化中学2019-2020学年高二下学期开学考试化学试题河北省衡水市武强中学2021-2022学年高二下学期期中考试化学试题
名校
9 . 铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O 的酸性废水通过铁炭混合物,在微电池正极上Cr2O
的酸性废水通过铁炭混合物,在微电池正极上Cr2O 转化成Cr3+,其电极反应式为
转化成Cr3+,其电极反应式为___________ 。
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示。
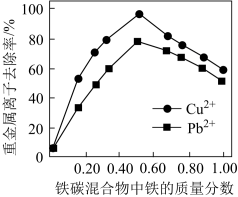
①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+其原因是___________ 。
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加Cu2+和Pb2+的去除率不升反降,其主要原因是___________ 。
(3)纳米铁粉可用于处理地下水中的污染物。
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH (B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)
(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH) ,其离子方程式为
,其离子方程式为___________ 。
②纳米铁粉与水中NO 反应的离子方程式为4Fe+NO
反应的离子方程式为4Fe+NO +10H+=4Fe2++NH
+10H+=4Fe2++NH +3H2O,研究发现,若pH偏低将会导致NO
+3H2O,研究发现,若pH偏低将会导致NO 的去除率下降,其原因是
的去除率下降,其原因是___________ 。
③相同条件下,纳米铁粉去除不同水样中NO 的速率有较大差异(见图),产生该差异的可能原因是
的速率有较大差异(见图),产生该差异的可能原因是___________ 。

(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O
 的酸性废水通过铁炭混合物,在微电池正极上Cr2O
的酸性废水通过铁炭混合物,在微电池正极上Cr2O 转化成Cr3+,其电极反应式为
转化成Cr3+,其电极反应式为(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示。

①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+其原因是
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加Cu2+和Pb2+的去除率不升反降,其主要原因是
(3)纳米铁粉可用于处理地下水中的污染物。
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH
 (B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)
(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH) ,其离子方程式为
,其离子方程式为②纳米铁粉与水中NO
 反应的离子方程式为4Fe+NO
反应的离子方程式为4Fe+NO +10H+=4Fe2++NH
+10H+=4Fe2++NH +3H2O,研究发现,若pH偏低将会导致NO
+3H2O,研究发现,若pH偏低将会导致NO 的去除率下降,其原因是
的去除率下降,其原因是③相同条件下,纳米铁粉去除不同水样中NO
 的速率有较大差异(见图),产生该差异的可能原因是
的速率有较大差异(见图),产生该差异的可能原因是
您最近一年使用:0次
2021-04-17更新
|
186次组卷
|
2卷引用:江苏省苏州市姑苏区第十中学2020-2021学年高一下学期期初化学考试
解题方法
10 . 四个兴趣小组以“如何将铜溶于硫酸”为主题,分别设计了如下实验方案:
小组1:用铜片和石墨作电极,电解稀硫酸;
小组2:将铜片放入试管中,加入浓硫酸,并加热;
小组3:向铜粉中加入稀硫酸和双氧水,并加热;
小组4:向铜粉中加入稀硫酸,水浴加热,并持续通入空气。
下列有关说法正确的是
小组1:用铜片和石墨作电极,电解稀硫酸;
小组2:将铜片放入试管中,加入浓硫酸,并加热;
小组3:向铜粉中加入稀硫酸和双氧水,并加热;
小组4:向铜粉中加入稀硫酸,水浴加热,并持续通入空气。
下列有关说法正确的是
| A.小组1的实验铜片与电源负极相连,石墨与电源正极相连 |
| B.小组2的实验有黑色固体生成,说明可能生成了CuS等固体 |
C.小组3的实验说明在酸性条件下双氧水能溶解铜,产生氧化产物 |
| D.小组4的实验为了加快铜粉的溶解,可加入少量锌粉以构成原电池 |
您最近一年使用:0次



