1 . 某小组研究FeCl3与Na2S的反应,设计了如下实验:
I.探究黑色沉淀的成分
查阅资料:Fe2S3(黑色)在空气中能够稳定存在,FeS(黑色)在空气中易变质为Fe(OH)3。
设计实验:分别取实验a、b、c中沉淀放置于空气中12小时,a中沉淀无明显变化。b、c 中黑色沉淀部分变为红褐色。
(1)①同学甲认为实验a 中黑色沉淀为Fe2S3,实验b、c的黑色沉淀物中既有Fe2S3又有FeS,依据的实验现象是_____ 。
②同学乙认为实验b的黑色沉淀物中有FeS,则一定混有S,理由是_____ 。
③设计实验检验b的黑色沉淀物中混有硫。
已知:硫在酒精溶液中的溶解度随乙醇质量分数的增大而增大。

实验证明了b中黑色沉淀混有S,试剂a是_____ ,观察到的现象为________ 。
II.探究实验a中Fe3+与S2-没有发生氧化还原反应的原因经查阅资料,可能的原因有两种:
原因1:pH影响了Fe3+与S2-的性质,二者不能发生氧化还原反应。
原因2:沉淀反应先于氧化还原反应发生,导致反应物浓度下降,二者不能发生氧化还原反应。
设计实验:电极材料为石墨
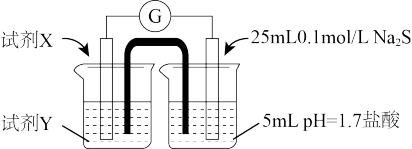
(2)①试剂X和Y分别是__________ 、_______ 。
②甲认为若右侧溶液变浑浊,说明Fe3+与S2-发生了氧化还原反应。是否合理?说明理由_____ 。
③乙进一步实验证明该装置中Fe3+与S2-没有发生氧化还原反应,实验操作及现象是_____ 。
④由此得出的实验结论是_____ 。
III.探究实验c随着FeCl3溶液的增加,黑色沉淀溶解的原因
(3)①用离子方程式解释实验1中的现象_____ 、_____ (写离子方程式)。
②结合化学平衡等反应原理及规律解释实验2中现象相同与不同的原因_____ 。
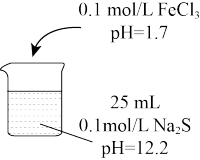 | 实验 a | 实验 b | 实验 c | |
| FeCl3体积 | 5 mL | 10 mL | 30 mL | |
| 实验现象 | 产生黑色浑浊,混合液pH=11.7 | 黑色浑浊度增大,混合液 pH=6.8 | 黑色浑浊比实验b明显减少,观察到大量黄色浑浊物,混合液 pH=3.7 |
查阅资料:Fe2S3(黑色)在空气中能够稳定存在,FeS(黑色)在空气中易变质为Fe(OH)3。
设计实验:分别取实验a、b、c中沉淀放置于空气中12小时,a中沉淀无明显变化。b、c 中黑色沉淀部分变为红褐色。
(1)①同学甲认为实验a 中黑色沉淀为Fe2S3,实验b、c的黑色沉淀物中既有Fe2S3又有FeS,依据的实验现象是
②同学乙认为实验b的黑色沉淀物中有FeS,则一定混有S,理由是
③设计实验检验b的黑色沉淀物中混有硫。
已知:硫在酒精溶液中的溶解度随乙醇质量分数的增大而增大。

实验证明了b中黑色沉淀混有S,试剂a是
II.探究实验a中Fe3+与S2-没有发生氧化还原反应的原因经查阅资料,可能的原因有两种:
原因1:pH影响了Fe3+与S2-的性质,二者不能发生氧化还原反应。
原因2:沉淀反应先于氧化还原反应发生,导致反应物浓度下降,二者不能发生氧化还原反应。
设计实验:电极材料为石墨

(2)①试剂X和Y分别是
②甲认为若右侧溶液变浑浊,说明Fe3+与S2-发生了氧化还原反应。是否合理?说明理由
③乙进一步实验证明该装置中Fe3+与S2-没有发生氧化还原反应,实验操作及现象是
④由此得出的实验结论是
III.探究实验c随着FeCl3溶液的增加,黑色沉淀溶解的原因
| 实验 1 | 实验 2 |
 固体溶解,闻到微量臭鸡蛋气味,溶液出现淡黄色浑浊。 |  |
②结合化学平衡等反应原理及规律解释实验2中现象相同与不同的原因
您最近一年使用:0次
2020-12-26更新
|
502次组卷
|
3卷引用:湖南大学附属中学2021-2022学年高二上学期期中考试化学试题
名校
2 . 下列实验操作与现象及相关结论都正确的是
选项 | 实验操作及现象 | 结论 |
A | 常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者产生红棕色气体 | 浓硝酸的氧化性比稀硝酸强 |
B | 向溶有 的 的 溶液中通入气体X,出现白色沉淀 溶液中通入气体X,出现白色沉淀 | X一定具有强氧化性 |
C | 向溴水中加入苯,振荡后静置,水层颜色变浅 | 溴与苯发生了加成反应 |
D | 将银和 溶液与铜和 溶液与铜和 溶液组成原电池,连通后银表面有银白色金属沉积,铜电极附近溶液逐渐变蓝 溶液组成原电池,连通后银表面有银白色金属沉积,铜电极附近溶液逐渐变蓝 | Cu的金属性比Ag强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 下列各项实验操作得出的现象及结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向2支均盛有2 mL相同浓度的AgNO3溶液的试管中,分别滴入2滴相同浓度的KCl、KI溶液 | 前者无明显现象,后者有黄色沉淀 | Ksp(AgI) <Ksp(AgCl) |
| B | 将铁粉加入过量浓硝酸中,加热充分反应,冷却后滴加KSCN溶液 | 有气体生成, 溶液最终呈无色 | 浓硝酸具有氧化性,将铁氧化成Fe2+ |
| C | 向蔗糖溶液中加入适量稀硫酸,水浴加热,冷却后向溶液中滴加新制Cu(OH)2悬浊液,加热 | 未出现砖红色沉淀 | 蔗糖未发生水解 |
| D | 向锌和稀硫酸反应的试管中滴加几滴CuSO4溶液 | 气泡生成速率加快 | CuSO4是该反应的催化剂 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 用下列仪器或装置(图中夹持装置略)进行相应实验,不能达到实验目的的是
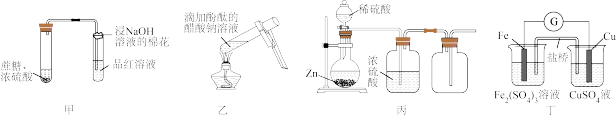

| A.装置甲探究浓硫酸的脱水性和氧化性 | B.装置乙探究温度对水解程度的影响 |
| C.装置丙制备干燥的氢气 | D.装置丁验证Cu与Fe3+反应产生电流 |
您最近一年使用:0次
名校
5 . 一种铁铬液流电池的工作原理如图所示 已知氧化性Fe3+>Cr3+,下列说法不正确的是
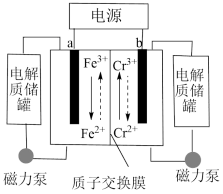

| A.放电时,a电极的电势高于b电极 |
| B.放电时,电池的总反应为:Cr2++Fe3+=Cr3++Fe2+ |
| C.充电时,b极与电源负极相连,电极反应式为:Cr3++e-=Cr2+ |
| D.充电时,电路中通过0.1mol电子时,0.1NA个H+由右侧电极室经交换膜移向左侧 |
您最近一年使用:0次
2022-04-02更新
|
539次组卷
|
3卷引用:湖南省株洲市第二中学2023届高三第六次月考化学试题
名校
解题方法
6 . 电化学原理在探究物质性质和实际生产中应用广泛,据此回答下列问题。
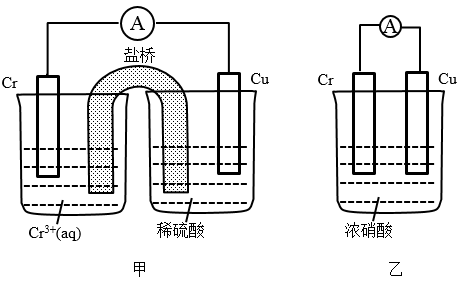
(1)在如图装置中,观察到装置甲铜电极上产生大量的无色气体;而装置乙中铜电极上无气体产生,铬电极上产生大量红棕色气体。由装置甲知铬的金属活动性比铜__ (填“强”或“弱”);由装置乙知常温下铬在浓硝酸中出现__ 现象。
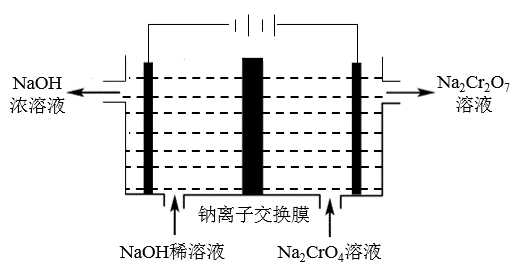
(2)工业上使用如图装置,以石墨作电极电解Na2CrO4溶液,使Na2CrO4转化为Na2Cr2O7,其转化原理为__ 。
(3)CrO3和K2Cr2O7均易溶于水,它们是工业废水造成铬污染的主要原因。要将Cr(Ⅵ)转化为Cr(Ⅲ)常见的处理方法是电解法和铁氧磁体法。
①电解法:将含Cr2O 的废水通入电解槽内,用铁作阳极,在酸性环境中,加入适量的NaCl进行电解,使阳极产物和Cr2O
的废水通入电解槽内,用铁作阳极,在酸性环境中,加入适量的NaCl进行电解,使阳极产物和Cr2O 发生反应,则阳极的电极反应式为
发生反应,则阳极的电极反应式为__ 。阴极上Cr2O 、H+、Fe3+都可能放电。若Cr2O
、H+、Fe3+都可能放电。若Cr2O 放电,则阴极的电极反应式为
放电,则阴极的电极反应式为__ ;若H+放电,则阴极区形成Fe(OH)3和Cr(OH)3沉淀。
②铁氧磁体法:在含Cr(Ⅵ)的废水中加入绿矾,在pH<4时发生反应使Cr(Ⅵ)转化为Cr(Ⅲ),调节溶液pH为6~8,使溶液中的Fe(Ⅱ)、Fe(Ⅲ)、Cr(Ⅲ)析出组成相当于Fe(Ⅱ)[Fe(Ⅲ)x•Cr(Ⅲ)2-x]O4(铁氧磁体)的沉淀,则铁氧磁体中x=___ 。
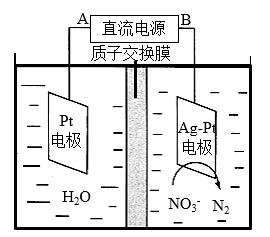
(4)电解法还可用于处理酸性硝酸盐污水,设计如图电解池。若电解过程中转移了0.1mol电子,则质子交换膜两侧电解液的质量变化差(△m左−△m右)为___ g。

(1)在如图装置中,观察到装置甲铜电极上产生大量的无色气体;而装置乙中铜电极上无气体产生,铬电极上产生大量红棕色气体。由装置甲知铬的金属活动性比铜
(2)工业上使用如图装置,以石墨作电极电解Na2CrO4溶液,使Na2CrO4转化为Na2Cr2O7,其转化原理为

(3)CrO3和K2Cr2O7均易溶于水,它们是工业废水造成铬污染的主要原因。要将Cr(Ⅵ)转化为Cr(Ⅲ)常见的处理方法是电解法和铁氧磁体法。
①电解法:将含Cr2O
 的废水通入电解槽内,用铁作阳极,在酸性环境中,加入适量的NaCl进行电解,使阳极产物和Cr2O
的废水通入电解槽内,用铁作阳极,在酸性环境中,加入适量的NaCl进行电解,使阳极产物和Cr2O 发生反应,则阳极的电极反应式为
发生反应,则阳极的电极反应式为 、H+、Fe3+都可能放电。若Cr2O
、H+、Fe3+都可能放电。若Cr2O 放电,则阴极的电极反应式为
放电,则阴极的电极反应式为②铁氧磁体法:在含Cr(Ⅵ)的废水中加入绿矾,在pH<4时发生反应使Cr(Ⅵ)转化为Cr(Ⅲ),调节溶液pH为6~8,使溶液中的Fe(Ⅱ)、Fe(Ⅲ)、Cr(Ⅲ)析出组成相当于Fe(Ⅱ)[Fe(Ⅲ)x•Cr(Ⅲ)2-x]O4(铁氧磁体)的沉淀,则铁氧磁体中x=
(4)电解法还可用于处理酸性硝酸盐污水,设计如图电解池。若电解过程中转移了0.1mol电子,则质子交换膜两侧电解液的质量变化差(△m左−△m右)为

您最近一年使用:0次



