解题方法
1 . 海洋是人类未来赖以生存和发展的资源宝库,合理开发和有效利用应得到重视。如从海藻灰中可得到NaI溶液。
(1)以NaI溶液为原料,经过一系列变化和操作,可得到粗碘,进一步提纯粗碘时,不需要的仪器有___________ 。
(2)某学习小组以空气氧化NaI溶液为研究对象,探究溶液的酸碱性对反应的影响。
①用CCl4萃取反应后I、II、III、IV 的溶液,萃取后下层CCl4均为无色,取萃取后的上层溶液,用淀粉检验:I、Ⅱ的溶液变蓝色;III的溶液蓝色不明显、Ⅳ的溶液未变蓝。
i.写出实验Ⅰ中反应的离子方程式___________ 。
ii.查阅资料;I2易溶于NaI溶液。下列实验证实了该结论并解释Ⅰ、II的萃取现象:
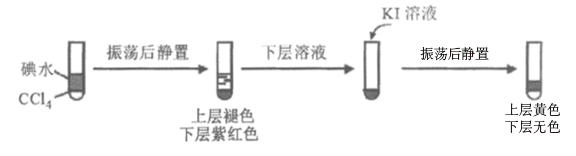
用CCl4萃取Ⅰ、II反应后的溶液,萃取后下层CCl4颜色均无色的原因是___________ 。
②查阅资料:pH <11.7时,I—能被O2氧化为I2;pH≥9.28时,I2发生歧化反应:3I2+6OH—=IO3—+5I—+3H2O,pH越大,歧化速率越快。某同学利用原电池原理设计实验证实:PH = 10的条件下实验Ⅳ确实可以发生I—能被O2氧化为I2的反应,如图所示:
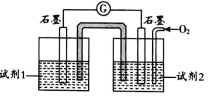
据此分析,试剂1是___________ ;试剂2是 ___________ 。
实验现象:电流表指针偏转,左侧电极附近溶液变蓝(±<30 min )。
③综合实验现象。说明I—被空气氧化的影响因素及对应关系为___________ 。
(3)测定NaI溶液中I—含量。
量取25.00 mL,NaI溶液于250mL锥形瓶中,分别加入少量稀H2SO4和稍过量的NH4Fe(SO4)2·12H2O溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,用c mol· L-1酸性标准KMnO4溶液进行滴定至终点,重复3次。平均每次消耗KMnO4溶液VmL(已知反应:2Fe3+ +2I—=2Fe2++ I2 、5Fe2++ +8H+=5Fe3++Mn2+ +4H2O)。
+8H+=5Fe3++Mn2+ +4H2O)。
①该实验达到滴定终点时,现象为___________ 。
②根据滴定有关数据,该NaI溶液中I—含量是___________ g·L-1。
(1)以NaI溶液为原料,经过一系列变化和操作,可得到粗碘,进一步提纯粗碘时,不需要的仪器有

(2)某学习小组以空气氧化NaI溶液为研究对象,探究溶液的酸碱性对反应的影响。
| 实验 | 编号 | pH = a | 现象 |
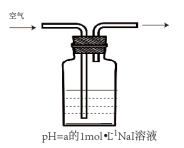 | I | 3 | 4分钟左右,溶液呈黄色 |
| Ⅱ | 7 | 60分钟左右,溶液呈浅黄色 | |
| Ⅲ | 8 | 10小时后,溶液呈很浅的黄色 | |
| Ⅳ | 10 | 10小时后,溶液颜色无明显变化 |
i.写出实验Ⅰ中反应的离子方程式
ii.查阅资料;I2易溶于NaI溶液。下列实验证实了该结论并解释Ⅰ、II的萃取现象:

用CCl4萃取Ⅰ、II反应后的溶液,萃取后下层CCl4颜色均无色的原因是
②查阅资料:pH <11.7时,I—能被O2氧化为I2;pH≥9.28时,I2发生歧化反应:3I2+6OH—=IO3—+5I—+3H2O,pH越大,歧化速率越快。某同学利用原电池原理设计实验证实:PH = 10的条件下实验Ⅳ确实可以发生I—能被O2氧化为I2的反应,如图所示:

据此分析,试剂1是
实验现象:电流表指针偏转,左侧电极附近溶液变蓝(±<30 min )。
③综合实验现象。说明I—被空气氧化的影响因素及对应关系为
(3)测定NaI溶液中I—含量。
量取25.00 mL,NaI溶液于250mL锥形瓶中,分别加入少量稀H2SO4和稍过量的NH4Fe(SO4)2·12H2O溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,用c mol· L-1酸性标准KMnO4溶液进行滴定至终点,重复3次。平均每次消耗KMnO4溶液VmL(已知反应:2Fe3+ +2I—=2Fe2++ I2 、5Fe2++
 +8H+=5Fe3++Mn2+ +4H2O)。
+8H+=5Fe3++Mn2+ +4H2O)。①该实验达到滴定终点时,现象为
②根据滴定有关数据,该NaI溶液中I—含量是
您最近一年使用:0次
名校
2 . 1841年美国学者Fremy首次合成了 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。
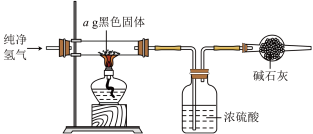
实验(一)制备 ,装置如图所示:
,装置如图所示:___________ 。
(2)甲装置中副产物为氯化钾,写出生成 的离子方程式:
的离子方程式:___________ ,实验完毕后,对甲装置中混合液进行___________ 过滤、洗涤、低温干燥。
实验(二)探究 性质及应用。
性质及应用。
取10g草酸溶于40mL水中,加入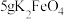 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体。将所得气体通入足量澄清石灰水中,溶液变浑浊。根据上述实验现象,可以判断产生的气体中含有
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体。将所得气体通入足量澄清石灰水中,溶液变浑浊。根据上述实验现象,可以判断产生的气体中含有 ,经测定所得气体中还含有
,经测定所得气体中还含有 。
。
(3)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分,当黑色固体完全反应后,测得浓硫酸质量净增bg,当 等于
等于___________ (用最简分数比表示)时,黑色固体为 。
。 稳定性(用
稳定性(用 浓度表示)与pH关系如图,其消毒效率与温度关系如图所示:
浓度表示)与pH关系如图,其消毒效率与温度关系如图所示:___________ 。
②在相同条件下, 作消毒剂最佳温度是
作消毒剂最佳温度是___________ 。
(5)查阅资料可知, 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“ ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应2条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应2条件下氧化剂的氧化性越强。)
方案1:在 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。
方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。___________ (填“1”或“2”)能证明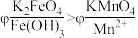 ,石墨极的电极反应式为
,石墨极的电极反应式为___________ 。
 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。实验(一)制备
 ,装置如图所示:
,装置如图所示: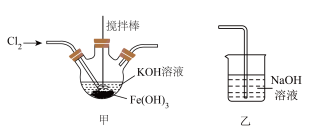
(2)甲装置中副产物为氯化钾,写出生成
 的离子方程式:
的离子方程式:实验(二)探究
 性质及应用。
性质及应用。取10g草酸溶于40mL水中,加入
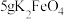 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体。将所得气体通入足量澄清石灰水中,溶液变浑浊。根据上述实验现象,可以判断产生的气体中含有
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体。将所得气体通入足量澄清石灰水中,溶液变浑浊。根据上述实验现象,可以判断产生的气体中含有 ,经测定所得气体中还含有
,经测定所得气体中还含有 。
。(3)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分,当黑色固体完全反应后,测得浓硫酸质量净增bg,当
 等于
等于 。
。
 稳定性(用
稳定性(用 浓度表示)与pH关系如图,其消毒效率与温度关系如图所示:
浓度表示)与pH关系如图,其消毒效率与温度关系如图所示: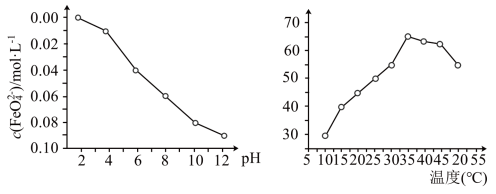
②在相同条件下,
 作消毒剂最佳温度是
作消毒剂最佳温度是(5)查阅资料可知,
 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“ ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应2条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应2条件下氧化剂的氧化性越强。)方案1:在
 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。
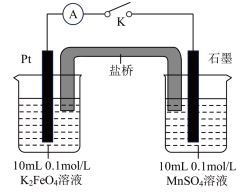
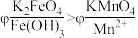 ,石墨极的电极反应式为
,石墨极的电极反应式为
您最近一年使用:0次
3 . 电化学是当今化学研究的热点之一,回答下列问题:
(1)碱性电池具有耐用、电流量大、储存寿命长、外壳不易腐蚀等优点。铝-铜碱性原电池的工作原理如装置甲所示:
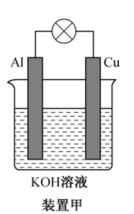
①在_______ (“Al”或“Cu”)极有H2生成,Al极电极反应式为_______ 。
②若有33.6 L(标准状况下)H2生成,则理论上电解质溶液增重_______ g。
(2)某兴趣小组设计以甲烷、氧气酸性燃料电池为电源电解NaCl溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
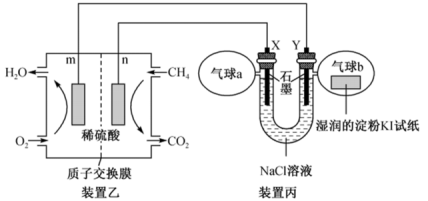
①m极为_______ 极,装置乙发生反应的化学方程式为_______ 。
②Y极电极反应式为_______ 。
③气球b中的现象为_______ 。
(1)碱性电池具有耐用、电流量大、储存寿命长、外壳不易腐蚀等优点。铝-铜碱性原电池的工作原理如装置甲所示:

①在
②若有33.6 L(标准状况下)H2生成,则理论上电解质溶液增重
(2)某兴趣小组设计以甲烷、氧气酸性燃料电池为电源电解NaCl溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。

①m极为
②Y极电极反应式为
③气球b中的现象为
您最近一年使用:0次
名校
解题方法
4 . 下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 酸性: | 电负性: |
B | 碳酸氢钠用作面团膨松剂 | 碳酸氢钠可以与碱反应 |
C | 马口铁(镀锡铁)出现刮痕后浸泡在饱和食盐水中,一段时间后,滴入几滴 | 锡做原电池的负极 |
D | 将在空气中灼烧呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝会变红色 | 乙醇具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-24更新
|
331次组卷
|
4卷引用:安徽省安庆市怀宁县高河中学2023-2024学年高二下学期第一次月考化学试题
名校
5 . 由下列实验操作和现象,得出的相应结论正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将炽热的木炭投入浓硝酸中 | 产生红棕色气体 | 木炭与浓硝酸反应生成NO2 |
| B | 向溴化钠溶液中滴加少量氯水,再加入淀粉碘化钾溶液 | 溶液先变橙色,后变蓝色 | 氧化性: |
| C | 向乙醇中加入一小粒金属钠 | 产生无色气体 | 乙醇中含有水 |
| D | 在锌与稀硫酸反应体系中加入少量硫酸铜 | 产生气泡速率加快 |  是反应的催化剂 是反应的催化剂 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-07-14更新
|
129次组卷
|
2卷引用:安徽省宣城市2021-2022学年高一下学期期末调研测试化学试题
名校
6 . 一种铁铬液流电池的工作原理如图所示 已知氧化性Fe3+>Cr3+,下列说法不正确的是
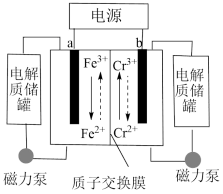

| A.放电时,a电极的电势高于b电极 |
| B.放电时,电池的总反应为:Cr2++Fe3+=Cr3++Fe2+ |
| C.充电时,b极与电源负极相连,电极反应式为:Cr3++e-=Cr2+ |
| D.充电时,电路中通过0.1mol电子时,0.1NA个H+由右侧电极室经交换膜移向左侧 |
您最近一年使用:0次
2022-04-02更新
|
539次组卷
|
3卷引用:安徽省蚌埠市2022届高三第三次教学质量检查(三模)理综化学试题
名校
解题方法
7 . 化学与科学、技术、社会和环境密切相关。下列说法不正确的是
| A.奋斗者潜水器主体采用的钛合金材料具有耐低温、耐高压和抗腐蚀性好的特性 |
| B.微生物降解高分子(如聚乳酸)可用作手术缝合线、药物缓释材料等 |
| C.能消杀病毒的过氧乙酸,具有强氧化性、弱酸性等性质,是强电解质 |
| D.在海轮外壳上镶入活泼金属,可减缓船体的腐蚀速率 |
您最近一年使用:0次
8 . 根据下列实验内容与现象能达到实验目的是
| 选项 | 实验内容与现象 | 实验目的 |
| A | CaO与浓氨水混合有刺激性气体放出 |  碱性大于 碱性大于 |
| B | 向稀硫酸中加入Zn和少量碳粉产生大量气泡 | 制取 并加快反应速率 并加快反应速率 |
| C | 铜分别与浓硝酸、稀硝酸反应,前者立即产生红棕色气体 | 探究浓度对化学反应速率的影响 |
| D |  通入酸性 通入酸性 溶液,紫红色褪去 溶液,紫红色褪去 | 探究 的漂白性 的漂白性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . 某实验小组为探究 和
和 的氧化能力设计如下实验.
的氧化能力设计如下实验.
Ⅰ.探究 和
和 氧化
氧化 的速率向体积均为
的速率向体积均为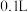 、浓度均为
、浓度均为 的
的 溶液和
溶液和 溶液中加入表面积相同、质量相等的铜片,反应一段时间后,经检验,
溶液中加入表面积相同、质量相等的铜片,反应一段时间后,经检验, 已完全消耗,
已完全消耗, 还有剩余.该小组同学猜测
还有剩余.该小组同学猜测 和
和 的氧化能力:
的氧化能力: .
.
(1)检验溶液中还有 剩余的试剂为
剩余的试剂为___________ 。
(2)相较于 溶液,
溶液, 溶液和铜反应速率较快的原因为
溶液和铜反应速率较快的原因为______________________________ 。
Ⅱ.探究反应 为可逆反应 将浓度均为
为可逆反应 将浓度均为 的
的 溶液和
溶液和 溶液等体积混合,一段时间后,溶液变为黄色,且有灰黑色沉淀生成.
溶液等体积混合,一段时间后,溶液变为黄色,且有灰黑色沉淀生成.
(3)若要证明该反应为可逆反应,只需用 溶液检测出有
溶液检测出有 的存在即可,写出该检测反应的离子方程式
的存在即可,写出该检测反应的离子方程式_________________________ 。
Ⅲ.测定反应 的平衡常数
的平衡常数
取 中上层清液,用
中上层清液,用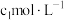 酸性
酸性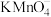 溶液滴定上层清液中剩余的
溶液滴定上层清液中剩余的 ,并记录滴定终点所消耗的酸性
,并记录滴定终点所消耗的酸性 溶液的体积;重复滴定3次,平均消耗酸性
溶液的体积;重复滴定3次,平均消耗酸性 溶液的体积为
溶液的体积为 .
.
(4)滴定至接近终点时,控制标准溶液半滴滴入,其操作是用锥形瓶口内壁轻靠滴定管尖嘴悬挂的液滴.要使这半滴液体流入锥形瓶内的操作是___________ ;滴定终点时的现象为___________ 。
(5)平衡时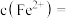
___________ (用含V、 、
、 的代数式表示),由此可计算出反应的平衡常数K.若盛装酸性
的代数式表示),由此可计算出反应的平衡常数K.若盛装酸性 溶液的滴定管未润洗,则计算得到的K值
溶液的滴定管未润洗,则计算得到的K值___________ (填“偏大”“偏小”或“不影响”)。
 和
和 的氧化能力设计如下实验.
的氧化能力设计如下实验.Ⅰ.探究
 和
和 氧化
氧化 的速率向体积均为
的速率向体积均为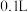 、浓度均为
、浓度均为 的
的 溶液和
溶液和 溶液中加入表面积相同、质量相等的铜片,反应一段时间后,经检验,
溶液中加入表面积相同、质量相等的铜片,反应一段时间后,经检验, 已完全消耗,
已完全消耗, 还有剩余.该小组同学猜测
还有剩余.该小组同学猜测 和
和 的氧化能力:
的氧化能力: .
.(1)检验溶液中还有
 剩余的试剂为
剩余的试剂为(2)相较于
 溶液,
溶液, 溶液和铜反应速率较快的原因为
溶液和铜反应速率较快的原因为Ⅱ.探究反应
 为可逆反应 将浓度均为
为可逆反应 将浓度均为 的
的 溶液和
溶液和 溶液等体积混合,一段时间后,溶液变为黄色,且有灰黑色沉淀生成.
溶液等体积混合,一段时间后,溶液变为黄色,且有灰黑色沉淀生成.(3)若要证明该反应为可逆反应,只需用
 溶液检测出有
溶液检测出有 的存在即可,写出该检测反应的离子方程式
的存在即可,写出该检测反应的离子方程式Ⅲ.测定反应
 的平衡常数
的平衡常数 取
 中上层清液,用
中上层清液,用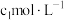 酸性
酸性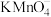 溶液滴定上层清液中剩余的
溶液滴定上层清液中剩余的 ,并记录滴定终点所消耗的酸性
,并记录滴定终点所消耗的酸性 溶液的体积;重复滴定3次,平均消耗酸性
溶液的体积;重复滴定3次,平均消耗酸性 溶液的体积为
溶液的体积为 .
.(4)滴定至接近终点时,控制标准溶液半滴滴入,其操作是用锥形瓶口内壁轻靠滴定管尖嘴悬挂的液滴.要使这半滴液体流入锥形瓶内的操作是
(5)平衡时
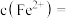
 、
、 的代数式表示),由此可计算出反应的平衡常数K.若盛装酸性
的代数式表示),由此可计算出反应的平衡常数K.若盛装酸性 溶液的滴定管未润洗,则计算得到的K值
溶液的滴定管未润洗,则计算得到的K值
您最近一年使用:0次
13-14高一下·四川成都·期末
名校
解题方法
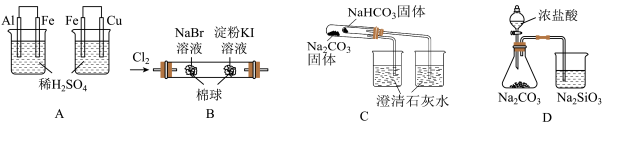
10 . 根据下列实验现象,所得结论正确的是

| 实验 | 实验现象 | 结论 |
| A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
| B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-01-09更新
|
839次组卷
|
20卷引用:安徽省肥东县高级中学2019届高三上学期12月调研化学试题
安徽省肥东县高级中学2019届高三上学期12月调研化学试题安徽省定远重点中学2019届高三上学期第三次月考化学试题【校级联考】安徽省定远重点中学2019届高三下学期第一次模拟考试化学试题安徽省滁州市定远县民族中学2020届高三上学期期中考试化学试题安徽省肥东县高级中学2020届高三1月调研考试化学试题(已下线)2013-2014学年四川成都外国语学校高一下期末化学试卷河北省正定中学2017届高三上学期第三次月考化学试题【全国百强校】河北省武邑中学2019届高三下学期第一次质检化学试题云南省峨山彝族自治县第一中学2018-2019学年高一6月月考化学试题江西省吉安市2018-2019学年高一下学期期末教学质量检测化学试题河北省张家口市宣化区第一中学2020届高三下学期3月月考化学试题吉林省洮南市第一中学2021届高三上学期期中考试化学试题吉林油田高级中学2019-2020学年高二下学期期末考试化学试题河北省石家庄一中东校区2020-2021学年高一第二学期教学质量检测(二)化学试题陕西省西安高级中学2021-2022学年高三第一次适应性考试化学试题陕西省西安高级中学2021-2022学年高三第一次适应性考试化学试题内蒙古自治区霍林郭勒市第一中学2022-203学年高三上学期9月月考化学试题宁夏固原市第一中学2023届高三上学期第二次月考化学试题宁夏青铜峡市宁朔中学2022-2023学年高三上学期期中考试化学试题陕西师范大学附属中学2024届高三上学期第一次月考化学试题



 溶液,出现蓝色沉淀
溶液,出现蓝色沉淀

