名校
1 . 符号为M的能层所含的能级有几种
| A.2 | B.3 | C.8 | D.18 |
您最近一年使用:0次
2016-12-09更新
|
118次组卷
|
4卷引用:云南省石屏县第一中学2021-2022学年高二下学期3月份考试化学试题
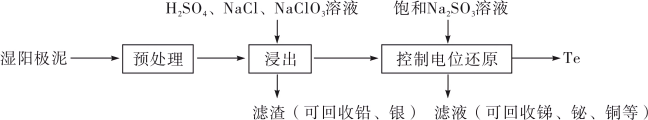
2 . 碲(Te)是一种重要的稀有分散元素,广泛应用于冶金、石油、化工、航空、电子等领域。以某冶炼厂的湿阳极泥(含水26%,主要含锑、砷、铅、铋、银和少量铜、碲等)为原料回收碲的流程如下:
请回答下列问题:
(1)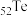 的基态原子的电子排布式为
的基态原子的电子排布式为___________ 。
(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是___________ ;氧化后的原料还需粉碎、过筛,目的是___________ 。
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为___________ 、___________ ;添加 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、 而被浸出的离子方程式
而被浸出的离子方程式___________ 。
(4)电解时为防止除Te以外的单质生成,需控制电位的范围为___________ ;加入饱和 溶液还原
溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成___________ (填化学式)。
(5)碲可用于制备半导体材料碲化锌,其立方晶胞结构如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。A点碲原子坐标为 ,C点锌原子坐标为
,C点锌原子坐标为 ,则B点锌原子坐标为
,则B点锌原子坐标为___________ 。若Te的原子半径为rpm,碲化锌晶胞中面心与顶点的碲原子相切,晶体的密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
___________  (列出计算式)。
(列出计算式)。
| 物质 | 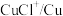 | 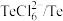 | 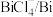 | 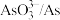 | 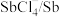 |
| 氧化还原电位(E)/V | 0.342 | 0.568 | 0.16 | 小于0.16 | 小于0.16 |
(1)
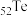 的基态原子的电子排布式为
的基态原子的电子排布式为(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为
 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、 而被浸出的离子方程式
而被浸出的离子方程式(4)电解时为防止除Te以外的单质生成,需控制电位的范围为
 溶液还原
溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成(5)碲可用于制备半导体材料碲化锌,其立方晶胞结构如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。A点碲原子坐标为
 ,C点锌原子坐标为
,C点锌原子坐标为 ,则B点锌原子坐标为
,则B点锌原子坐标为 ,则阿伏加德罗常数
,则阿伏加德罗常数
 (列出计算式)。
(列出计算式)。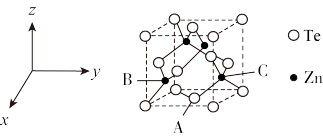
您最近一年使用:0次
名校
解题方法
3 . 长周期元素M的一种配合物对某些有机反应具有优良的催化性能,其结构可用下图表示,其中W、X、Y、Z为原子序数依次增加的短周期元素,M和Z的简单离子的电子层结构相同,下列叙述错误的是
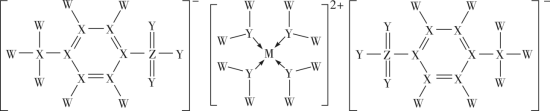
| A.简单离子半径:Z>M |
| B.电负性:Y>X>W>M |
| C.W、X、Y、Z均为元素周期表中p区元素 |
D.该配合物中X原子的轨道杂化类型为 、 、 |
您最近一年使用:0次
4 . 下列说法不正确的是( )
| A.在氢原子的电子云图中,每个小黑点代表一个电子 |
B.某基态原子3d能级中电子排布的情况可能为 |
| C.电子构型为[Ar]3d104s2的元素是过渡金属元素 |
| D.当碳原子的核外电子排布由1s22s22p2转变为1s22s12p3时,碳原子由基态变为激发态 |
您最近一年使用:0次
2016-12-09更新
|
94次组卷
|
2卷引用:云南省普洱市景东一中2019-2020学年高二12月月考化学试题
14-15高三上·云南玉溪·阶段练习
解题方法
5 . 【化学——选修3:物质结构与性质】
(1)含碳物质不完全燃烧会产生CO。血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒,写出铁离子(Fe3+)的核外电子排布式为_______________________ ,CO有多种等电子体,其中常见的一种分子是________ 。利用CO可以合成化工原料COCl2、配合物Fe(CO)5等,已知一个COCl2分子中每个原子最外层都形成8电子的稳定结构,则一个COCl2分子内含有_____ 个δ键,C原子的杂化方式为______ 。Fe(CO)5等在一定条件下分解生成CO和铁,反应过程中断裂的化学键是____________ ,形成的化学键是_______________ 。
(2)A、B均为短周期金属元素。依据下表数据,回答问题:
写出A原子的电子排布图__________________ ,Al原子的第一电离能______ 填:“大于”、“小于”或“等于”)738 kJ·mol-1,原因是________________________ 。
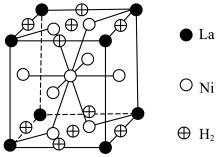
(3)下图是一种镍(Ni)镧(La)合金储氢后的晶胞结构图。该合金储氢后,含0.5mol Ni的合金可吸附氢气的体积(标况)为_______ 。
(1)含碳物质不完全燃烧会产生CO。血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒,写出铁离子(Fe3+)的核外电子排布式为
(2)A、B均为短周期金属元素。依据下表数据,回答问题:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(3)下图是一种镍(Ni)镧(La)合金储氢后的晶胞结构图。该合金储氢后,含0.5mol Ni的合金可吸附氢气的体积(标况)为

您最近一年使用:0次
2014·云南红河·一模
解题方法
6 . 已知:A、B、C、D、E、F六种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中最高;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物。
回答下列问题:
(1)F的原子的M层电子排布式为______ 。
(2)B、C、D的第一电离能由小到大的顺序为______ 。(用元素符号表示)
(3)A的简单氢化物分子极易溶于水,其主要原因是______ 。
(4)E的最高价氧化物分子的空间构型是______ 。其中心原子的杂化方式为______ 。
(5)F的高价离子与A的简单氢化物形成的配离子,配位数为______ 。
(6)A、F形成某种化合物的晶胞结构如图所示,则其化学式为______ ;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为______ g/cm3。

回答下列问题:
(1)F的原子的M层电子排布式为
(2)B、C、D的第一电离能由小到大的顺序为
(3)A的简单氢化物分子极易溶于水,其主要原因是
(4)E的最高价氧化物分子的空间构型是
(5)F的高价离子与A的简单氢化物形成的配离子,配位数为
(6)A、F形成某种化合物的晶胞结构如图所示,则其化学式为

您最近一年使用:0次
2016-12-09更新
|
720次组卷
|
4卷引用:2014届云南省红河州高中毕业生复习统一检测理综化学试卷
(已下线)2014届云南省红河州高中毕业生复习统一检测理综化学试卷(已下线)2013-2014云南省红河州高三下学期毕业生复习统一检测理综化学试卷2016届内蒙古赤峰市宁城县高三上学期第一次统考化学试卷2017届内蒙古赤峰市宁城县高三上统一考试化学试卷
7 . 实验室以含钴废料(主要成分是CoO、Co2O3,含少量Fe2O3、Al2O3等杂质)为原料制备CoCO3的流程如图所示。
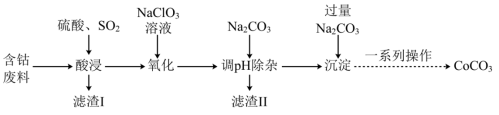
已知:①“酸浸”后过滤得到的滤液中含有Co2+、Fe2+、Al3+等。
②有关沉淀数据如表(完全沉淀时金属离子浓度≤1×10-5mol/L):
回答下列问题:
(1)基态钴原子的价层电子排布式为_______ ,在“酸浸”之前,先要对含钴废料进行粉碎处理,其目的是_______ 。
(2)“酸浸”时需通入SO2,其中SO2作______ (填“氧化剂”或“还原剂”),由于“酸浸”时,溶液中会产生Fe3+,写出SO2与Fe3+反应的离子方程式:______ 。
(3)“氧化”流程中,氧化剂与还原剂的物质的量之比为______ 。
(4)常温下,若浸取液中c(Co2+)=0.1mol/L,则“调pH除杂”时需调节溶液pH的范围为______ 至______ 。(加入NaClO3和Na2CO3时,溶液的体积变化忽略)
(5)“滤渣II”的主要成分为______ 。
(6)“一系列操作”为过滤、洗涤、干燥,其中过滤所需要的硅酸盐材质的仪器有_______ 。
(7)将得到的CoCO3固体在空气中加热,反应温度对反应产物的影响如图所示,则500~1000℃时,发生主要反应的化学方程式为_______ 。
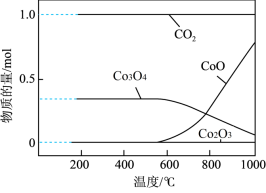

已知:①“酸浸”后过滤得到的滤液中含有Co2+、Fe2+、Al3+等。
②有关沉淀数据如表(完全沉淀时金属离子浓度≤1×10-5mol/L):
| 沉淀 | Al(OH)3 | Fe(OH)3 | Co(OH)2 |
| 恰好完全沉淀时的pH | 5.2 | 2.8 | 9.4 |
(1)基态钴原子的价层电子排布式为
(2)“酸浸”时需通入SO2,其中SO2作
(3)“氧化”流程中,氧化剂与还原剂的物质的量之比为
(4)常温下,若浸取液中c(Co2+)=0.1mol/L,则“调pH除杂”时需调节溶液pH的范围为
(5)“滤渣II”的主要成分为
(6)“一系列操作”为过滤、洗涤、干燥,其中过滤所需要的硅酸盐材质的仪器有
(7)将得到的CoCO3固体在空气中加热,反应温度对反应产物的影响如图所示,则500~1000℃时,发生主要反应的化学方程式为

您最近一年使用:0次
名校
8 . 结构是预测物质性质的重要依据。下列说法错误的是
| A.电负性:Cl>S>P | B.热稳定性: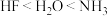 |
| C.第一电离能:N>O>C | D.酸性: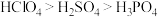 |
您最近一年使用:0次
14-15高二上·山西朔州·阶段练习
名校
9 . 下列各选项所述的两个量,前者一定大于后者的是
①3d轨道的能量和4s轨道的能量;②同一电子层中第一个p轨道与第二个p轨道的能量;③2s和3s的轨道半径;④同一原子的基态和激发态;⑤F元素和O元素的电负性;⑥Mg元素和Al元素的第一电离能;⑦H原子和H+离子的半径
①3d轨道的能量和4s轨道的能量;②同一电子层中第一个p轨道与第二个p轨道的能量;③2s和3s的轨道半径;④同一原子的基态和激发态;⑤F元素和O元素的电负性;⑥Mg元素和Al元素的第一电离能;⑦H原子和H+离子的半径
| A.①⑤⑥⑦ | B.②③⑤ | C.②④⑦ | D.全对 |
您最近一年使用:0次
2016-12-09更新
|
1106次组卷
|
3卷引用:云南省玉溪师范学院附属中学2022-2023学年高二下学期期末考试化学试题
云南省玉溪师范学院附属中学2022-2023学年高二下学期期末考试化学试题(已下线)2013-2014学年山西省朔州市应县一中高二上学期第四次月考化学试卷广西宾阳县宾阳中学2018-2019学年高二5月月考化学试题
10 . 已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A、C原子的L能层中都有两个未成对的电子,C、D同主族。E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态E原子中,电子占据的最高能层符号为_______ ,该能层具有的原子轨道数为_______ 。
(2)E3+离子的价层电子排布式为______________ 。
(3)DCl2中D原子采取的轨道杂化方式为_________________________ ,C元素的气态氢化物的VSEPR模型名称为____________________________ 。
(4)写出一个与DAB-离子互为等电子体的合理分子式:__________________________ 。
(5)利用E(AB)63-检验E2+的离子方程式为_________________________ 。
(6)已知F的晶体结构为面心立方,F的原子直径d= 0.256nm,求1cm3 F中,含有F原子的个数约为_______________ 个。(保留3位有效数字)
(1)基态E原子中,电子占据的最高能层符号为
(2)E3+离子的价层电子排布式为
(3)DCl2中D原子采取的轨道杂化方式为
(4)写出一个与DAB-离子互为等电子体的合理分子式:
(5)利用E(AB)63-检验E2+的离子方程式为
(6)已知F的晶体结构为面心立方,F的原子直径d= 0.256nm,求1cm3 F中,含有F原子的个数约为
您最近一年使用:0次



