9-10高二下·福建三明·期中
名校
解题方法
1 . 下列各组表述中,两个微粒一定不属于同种元素原子的是( )
| A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子 |
| B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子 |
C.最外层电子数是核外电子总数的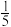 的原子和价电子排布为4s24p5的原子 的原子和价电子排布为4s24p5的原子 |
| D.2p能级有一个未成对电子的基态原子和价电子排布为2s22p5的原子 |
您最近一年使用:0次
2020-02-15更新
|
1199次组卷
|
37卷引用:云南省澄江二中2018-2019学年高二上学期期中考试化学试题
云南省澄江二中2018-2019学年高二上学期期中考试化学试题(已下线)09~10学年三明市五校高二下学期期中联考化学卷(已下线)2011-2012学年河北省衡水中学高二下学期调考试化学试卷(已下线)2011-2012学年福建省师大附中高二下学期期末模块测试化学试卷(已下线)2012-2013学年湖北省黄冈中学高二上学期期中考试化学试卷2014-2015学年辽宁实验分校高二下6月阶段测试化学试卷2015-2016学年四川成都七中高二上12月月考化学试卷2015-2016学年安徽省六安一中高二上第二次阶段测化学卷2015-2016学年陕西西藏民族学院附中高二4月月考化学卷2015-2016学年河北省定州中学高二下期中化学试卷2015-2016学年山西省怀仁一中高二下第三次月考化学试卷安徽省六安市第一中学2016-2017学年高二上学期期末考试化学试题2016-2017学年河南省郑州外国语学校高二下学期月考(一)化学试卷高中化学人教版 选修三 第1章 原子结构与性质 电子云与原子轨道河南省安阳市林虑中学2017-2018学年高二4月份调研考试化学试题山西省实验中学2018-2019学年高二上学期12月月考化学试题山东省烟台第二中学2019-2020学年高二上学期12月月考化学试题安徽省蚌埠二中2019-2020学年高二下学期开学检测化学试题福建省莆田第一中学2019-2020学年高二下学期期中考试化学试题安徽省亳州市涡阳县第九中学2019-2020学年高二7月月考化学试题吉林省长春市实验中学2019-2020高二下学期期中考试化学试题(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 第2节 原子结构与元素周期表(已下线)1.2.1 基态原子的核外电子排布-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练湖北武汉市蔡甸区汉阳一中2020-2021学年高二下学期3月月考化学试题福建省福清西山学校高中部2020-2021学年高二下学期期中考试化学试题湖北省黄石市有色第一中学2020-2021学年高二下学期期中考试化学试题(已下线)课时54 原子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)(已下线)1.1.3 电子云与原子轨道 泡利原理与洪特规则 能量最低原理-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)1.1 原子结构(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)福建省福州教育学院附属中学2021-2022学年高二下学期3月月考化学试题(已下线)专题13 原子结构与性质-2023年高考化学一轮复习小题多维练(全国通用)专题强化练1 基态原子核外电子排布福建省三明第一中学2022-2023学年高二下学期第一次月考化学试题(已下线)考点41 原子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
解题方法
2 . 不同元素的原子在分子内吸引电子的能力大小可用一数值x来表示,若x越大,则原子吸引电子的能力越强,在所形成的分子中成为负电荷一方。下面是某些短周期元素的x值:
(1)通过分析x值的变化规律,确定N、Mg的x值范围:
______ <x(N)<________ ;________ <x(Mg)<________ 。
(2)推测x值与原子半径的关系是_________________________________________________________________ 。
(3)某有机物结构式为C6H5SONH2,在S—N中,你认为共用电子对偏向谁?__________ (写原子名称)。
(4)经验规律告诉我们当成键的两原子相应元素电负性的差值Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键的类型是____________ 。
(5)预测元素周期表中,x值最小的元素位置____________________ (放射性元素除外)。
| 元素 | Li | Be | B | C | O | F |
| x值 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 |
| 元素 | Na | Al | Si | P | S | Cl |
| x值 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
(2)推测x值与原子半径的关系是
(3)某有机物结构式为C6H5SONH2,在S—N中,你认为共用电子对偏向谁?
(4)经验规律告诉我们当成键的两原子相应元素电负性的差值Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键的类型是
(5)预测元素周期表中,x值最小的元素位置
您最近一年使用:0次
2020-02-11更新
|
75次组卷
|
2卷引用:云南省通海县第一中学2021-2022学年高二下学期3月月考化学试题
10-11高二下·福建·期中
名校
解题方法
3 . X和Y是原子序数大于4的短周期元素,Xm+和Yn-两种离子的核外电子排布相同,下列说法中正确的是( )
| A.X的原子半径比Y小 | B.X和Y的核电荷数之差为m-n |
| C.电负性X>Y | D.第一电离能X<Y |
您最近一年使用:0次
2020-01-13更新
|
1487次组卷
|
34卷引用:云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题
云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题(已下线)2010-2011学年福建省师大附中高二下学期期中考试化学试卷(已下线)2011-2012学年四川省南充高中高二上学期期中考试化学试卷(已下线)2011-2012学年河北省衡水中学高二下学期期中考试化学试卷(已下线)2012-2013学年云南省芒市中学高二上学期期中考试化学试卷(已下线)2013-2014学年福建省四地六校高二下学期第一次月考化学试卷2016-2017学年安徽省亳州市涡阳县第一中学高二3月月考化学试卷河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:1.2 原子结构与元素的性质 第2课时山东省单县五中2017-2018学年高二下学期第一次月考化学试题【全国百强校】湖北省武汉市华中师范大学第一附属中学2017-2018学年高一下学期期中考试化学试题(已下线)2018年11月23日 《每日一题》人教版一轮复习-电离能和电负性2020届高三化学选修三二轮专题复习—— 元素周期表、周期律的推断黑龙江省哈尔滨市第六中学2019-2020学年高二上学期期末考试化学试题2019-2020学年人教版高中化学高考基础复习专题12《物质结构与性质》测试卷第3节 原子结构与元素性质——A学习区 夯实基础(鲁科版选修3)安徽省蚌埠二中2019-2020学年高二下学期开学检测化学试题吉林省辽源市东辽县第一高级中学2019-2020高二5月月考化学试题(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 第3节 元素性质及其变化规律(已下线)模块同步卷11 综合检测卷(基础卷)-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)福建省建瓯市芝华中学2020-2021学年高二下学期第一阶段考试化学试题山西省晋中市新一双语学校2020-2021学年高二下学期3月月考化学试题福建省龙岩市长汀县三级达标校2020-2021学年高二下学期期中考试化学试题宁夏长庆高级中学2020-2021学年高二上学期期中考试化学试卷辽宁省鞍山市2020-2021学年高二下学期期末考试化学试题(已下线)模块十三 物质结构与性质(选修3)(模块检测)-2022年高考化学一轮复习小题多维练(全国通用)四川省西充中学 2021-2022 学年高二上学期期中考试化学试题陕西省宝鸡市长岭中学2021-2022学年高二下学期期中考试化学试题(已下线)专题13 原子结构与性质-2023年高考化学一轮复习小题多维练(全国通用)福建省厦门英才学校中学部22021-2022学年高二下学期4月月考化学试题四川省宜宾市叙州区第一中学校2022-2023学年高二上学期期中考试化学试题四川省广元中学2021-2022学年高二下学期第一次段考化学试题四川省广元中学2022-2023学年高二下学期4月月考化学试题1.3.2元素的电离能、电负性及其变化规律(课后)-鲁科版选择性必修2江西省宜春市宜丰中学2022-2023学年高二上学期11月期中(第二次月考)化学试题
4 . 若某元素原子处于能量最低状态时,价电子排布式为4d15s2,则下列说法正确的是( )
| A.该元素原子处于能量最低状态时,原子中共有3个未成对电子 |
| B.该元素原子核外共有5个电子层 |
| C.该元素原子的M层共有8个电子 |
| D.该元素原子最外层有3个电子 |
您最近一年使用:0次
2019-12-11更新
|
431次组卷
|
27卷引用:云南省玉溪市新平三中2019-2020学年高二上学期12月份月考化学试题
云南省玉溪市新平三中2019-2020学年高二上学期12月份月考化学试题云南省玉溪市民族中学2021-2022学年高二上学期期末考试化学试题(已下线)2010年河南省许昌市六校联考高二下学期期末考试化学试题(已下线)2011-2012学年陕西省师大附中高二下学期期中考试化学试卷(已下线)2012-2013学年黑龙江省哈四中高二下学期第一次(4月)月考化学试卷(已下线)2012-2013学年山东省济南一中高二下学期期中考试理科化学试卷2014-2015宁夏银川市唐徕回民中学高二下学期3月月考化学试卷2014-2015江苏省启东中学高二下学期期中考试化学试卷2015-2016学年西藏日喀则一中高二10月月考化学试卷2015-2016学年四川省南充高中高二下期末化学试卷2016-2017学年四川省成都市石室佳兴外国语学校高二下学期第一次月考化学试卷辽宁省六校协作体2016-2017学年高二下学期期中考试化学试题河北省唐山市曹妃甸区第一中学2016-2017学年高二下学期期末考试化学试题【全国百强校】黑龙江省大庆市铁人中学2017-2018学年高二下学期期中考试化学试题云南省楚雄州南华县民族中学2018-2019学年高二上学期期中考试化学试题内蒙古自治区第一机械制造(集团)有限公司第一中学2018-2019学年高二下学期期中考试化学试题黑龙江省鸡西市鸡东县第二中学2018-2019学年高二5月月考化学试题2020届高三化学二轮物质结构题型专攻——基态原子核外电子排布【选择基础专练】宁夏回族自治区吴忠市吴忠中学2019-2020学年高二下学期期中考试化学试题(已下线)山西省原平市范亭中学2018-2019学年高二4月月考化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 第一节 原子结构云南省大姚县一中2020-2021学年高二下学期6月份考试化学试题四川省遂宁中学校2019-2020学年高二下学期期中考试化学试题四川省平昌县得胜中学2021-2022学年高二上学期10月月考化学试题福建省福州市福建师范大学附属中学2021-2022学年高二上学期期末考试化学试题宁夏石嘴山市平罗中学2023-2024学年高二上学期第一次月考化学试题辽宁省沈阳市辽中区第一私立高级中学2023-2024学年高二上学期12月月考化学试题
5 . 钛和钛的合金已被广泛应用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
(1)钛有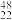 Ti和
Ti和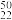 Ti两种原子,它们互称为
Ti两种原子,它们互称为________ 。Ti元素在元素周期表中的位置是第________ 周期,第________ 族;基态原子的电子排布式为________ ,按外围电子排布特征Ti元素在元素周期表分区中属于___________ 区元素。
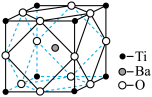
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是_____________ 。
(3)现有含Ti3+的配合物,化学式为[TiCl(H2O)5]Cl2·H2O。配离子[TiCl(H2O)5]2+中含有的化学键类型是________ ,该配合物的配位体是________ 。
(1)钛有
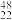 Ti和
Ti和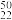 Ti两种原子,它们互称为
Ti两种原子,它们互称为(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是

(3)现有含Ti3+的配合物,化学式为[TiCl(H2O)5]Cl2·H2O。配离子[TiCl(H2O)5]2+中含有的化学键类型是
您最近一年使用:0次
名校
解题方法
6 . 有A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中A为非金属元素,A和E属于同一族,它们原子的最外层电子排布式为ns1。B和D也属于同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是____ ,B是____ ,C是_____ ,D是____ ,E是____ 。
(2)由这五种元素组成的一种化合物是(写化学式)____ 。写出该物质的一种主要用途:____ 。
(3)写出C元素基态原子的电子排布式:___ 。
(4)用电子排布图表示D元素原子的外围电子排布为____ 。
(1)A是
(2)由这五种元素组成的一种化合物是(写化学式)
(3)写出C元素基态原子的电子排布式:
(4)用电子排布图表示D元素原子的外围电子排布为
您最近一年使用:0次
2019-11-24更新
|
442次组卷
|
6卷引用:云南省新平县三中2019-2020学年高二上学期期中考试化学试题
名校
7 . 下列各项叙述中,正确的是
| A.Na、Mg、Al的未成对电子数依次增多 |
| B.价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 |
| C.2p和3p轨道形状均为哑铃形,能量也相等 |
D.氮原子的最外层电子排布图: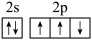 |
您最近一年使用:0次
2019-11-24更新
|
323次组卷
|
6卷引用:云南省新平县三中2019-2020学年高二上学期期中考试化学试题
名校
8 . 有 A 、 B 、 C 、 D 、 E 、 F 六种元素,已知:
① 它们位于三个不同的短周期,核电荷数依次增大。
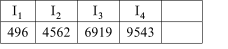
②E元素的电离能数据见下表(KJ/mol):
③B与F同主族。
④A、E 都能与 D 按原子个数比 1:1 和 2:1 形成化合物。
⑤B、C 都能与 D 按原子个数比 1:1 和 1:2 形成化合物。
(1)写出只含有 A、B、D、E 四种元素的两种无水盐的化学式:_______________________________
(2)B2A2 分子中存在______________ 个 键,
键,_____________ 个 键。
键。
(3)人们通常把拆开 1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(△H)化学反应的反应热等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
试计算1molF单质完全燃烧时的反应热△H=________ (已知1molF单质中含2mol F—F键,1molFO2中含有4mol键F—O)。
① 它们位于三个不同的短周期,核电荷数依次增大。
②E元素的电离能数据见下表(KJ/mol):

③B与F同主族。
④A、E 都能与 D 按原子个数比 1:1 和 2:1 形成化合物。
⑤B、C 都能与 D 按原子个数比 1:1 和 1:2 形成化合物。
(1)写出只含有 A、B、D、E 四种元素的两种无水盐的化学式:
(2)B2A2 分子中存在
 键,
键, 键。
键。(3)人们通常把拆开 1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(△H)化学反应的反应热等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
| 化学键 | F—D | F—F | B—B | F—B | B=D | D=D |
| 键能(KJ/mol) | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
试计算1molF单质完全燃烧时的反应热△H=
您最近一年使用:0次
2019-11-21更新
|
214次组卷
|
3卷引用:云南省玉溪市民族中学2021-2022学年高二上学期期末考试化学试题
9 . 原子核外电子是分层排布的,在不同电子上运动的电子的能量不同,下列电子层上运动的电子能量最高的是
| A.K层 | B.L层 | C.M层 | D.N层 |
您最近一年使用:0次
2019-10-30更新
|
104次组卷
|
2卷引用:云南省玉溪市华宁县第二中学2021-2022年高一下学期开学考试化学试题
10 . 在玻璃生产中,熔炉里原料发生的主要反应为:2Na2CO3+CaCO3+3SiO2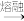 2Na2SiO3+CaSiO3+3CO2↑。
2Na2SiO3+CaSiO3+3CO2↑。
(1)某反应物在熔融状态下不导电,它属于______ 晶体。
(2)上述反应里所涉及的短周期元素原子半径由大到小的顺序为________ 。
(3)碳和硅属于同族元素,该族元素的原子最外层电子的价层电子表示式为________ 。
(4)写一个能比较碳元素和氧元素非金属性强弱的化学反应方程式:________ 。
(5)CO2的电子式为_______ 。
(6)反应物Na2CO3与CaCO3均能制备二氧化碳,但是往往不是都能使用稀硫酸,请说明理由。______
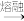 2Na2SiO3+CaSiO3+3CO2↑。
2Na2SiO3+CaSiO3+3CO2↑。(1)某反应物在熔融状态下不导电,它属于
(2)上述反应里所涉及的短周期元素原子半径由大到小的顺序为
(3)碳和硅属于同族元素,该族元素的原子最外层电子的价层电子表示式为
(4)写一个能比较碳元素和氧元素非金属性强弱的化学反应方程式:
(5)CO2的电子式为
(6)反应物Na2CO3与CaCO3均能制备二氧化碳,但是往往不是都能使用稀硫酸,请说明理由。
您最近一年使用:0次
2019-10-24更新
|
62次组卷
|
2卷引用:云南省玉溪市玉溪第一中学2018-2019学年高二上学期11月月考化学试题



