名校
1 . 元素的性质呈现周期性变化的根本原因是( )
| A.原子半径呈周期性变化 |
| B.元素的化合价呈周期性变化 |
| C.元素的电负性呈周期性变化 |
| D.元素原子的核外电子排布呈周期性变化 |
您最近一年使用:0次
2018-12-19更新
|
121次组卷
|
3卷引用:云南省保山市昌宁县一中2019-2020学年高二10月月考化学试题
名校
2 . 某元素的原子核外有三个电子层,其中M层电子数是L层电子数的一半,则此元素( )
| A.C | B.Si | C.S | D.C1 |
您最近一年使用:0次
2018-12-17更新
|
219次组卷
|
3卷引用:云南省保山市昌宁县一中2019-2020学年高二10月月考化学试题
名校
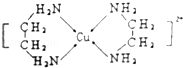
3 . Cu2+能与NH3、H2O、OH﹣、Cl﹣等形成配位数为4的配合物。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2+中的配位键__ 。
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有__ (填序号)。
A.离子键 B.金属键 C.极性共价键 D.非极性共价键
(2)金属铜单独与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生如下反应:Cu+H2O2+4NH3═[Cu(OH)4]2++2OH﹣。其原因是_________________ .
(3)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图):
①H、O、N三种元素的电负性从大到小的顺序____ 。
②乙二胺分子中N原子成键时采取的杂化类型是__ 。
③乙二胺沸点高于Cl﹣CH2CH2﹣Cl的主要原因是__ 。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2+中的配位键
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有
A.离子键 B.金属键 C.极性共价键 D.非极性共价键
(2)金属铜单独与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生如下反应:Cu+H2O2+4NH3═[Cu(OH)4]2++2OH﹣。其原因是
(3)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图):
①H、O、N三种元素的电负性从大到小的顺序
②乙二胺分子中N原子成键时采取的杂化类型是
③乙二胺沸点高于Cl﹣CH2CH2﹣Cl的主要原因是
您最近一年使用:0次
2018-12-17更新
|
284次组卷
|
5卷引用:云南省保山市昌宁县一中2019-2020学年高二10月月考化学试题
名校
4 . 氯元素的原子结构示意图为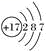 ,下列说法正确的是( )
,下列说法正确的是( )
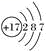 ,下列说法正确的是( )
,下列说法正确的是( )| A.氯原子在化学反应中易失去电子 |
| B.氯原子易得到电子形成稳定的氯离子 |
| C.氯元素的化合价只有-1价 |
| D.氯的原子核外有7个电子 |
您最近一年使用:0次
2018-08-02更新
|
211次组卷
|
9卷引用:云南省腾冲市第一中学2021-2022学年高一下学期3月份考试化学试题
云南省腾冲市第一中学2021-2022学年高一下学期3月份考试化学试题云南省曲靖市沾益二中2017-2018学年高一下学期期末考试化学试题云南省文山壮族苗族自治州富宁县第二中学2019-2020学年高一上学期期末考试化学试题2020年春季人教版高中化学必修2第一章《物质结构 元素周期律》测试卷广西壮族自治区崇左市扶绥县第二中学2019-2020学年高一上学期期末考试化学试题(已下线)3.1.2 氯气的性质与应用练习(1)——《高中新教材同步备课》(苏教版 必修第一册)湖北省沙市中学2020-2021学年高一上学期期中考试化学(学考)试题云南省玉溪市江川区第二中学2020-2021学年高一下学期期中考试化学试题云南省盐津县第一中学2020-2021学年高一下学期6月份考试化学试题
名校
5 . X2+的核外电子排布式为1s22s22p6,下列说法正确的是( )
| A.X可能为稀有元素 | B.X原子的核外电子排布为1s22s22p63s2 |
| C.X原子的核外电子排布为1s22s22p62d2 | D.X2+的最外电子层上有6个电子 |
您最近一年使用:0次
2018-04-24更新
|
235次组卷
|
6卷引用:云南省保山市昌宁县一中2019-2020学年高二10月月考化学试题
云南省保山市昌宁县一中2019-2020学年高二10月月考化学试题宁夏银川市唐徕回民中学2017-2018学年高二4月月考化学试题贵州省遵义市习水县一中2018-2019学年高二上学期11月考试化学试题(已下线)2019年11月21日《每日一题》2020年高考化学一轮复习—— 原子(或离子)的核外电子排布(已下线)课时54 原子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)云南省通海县第一中学2021-2022学年高二下学期3月月考化学试题
名校
6 . 基态硅原子的最外能层的各能级中,电子排布的方式正确的是( )
A. | B. |
C. | D.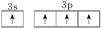 |
您最近一年使用:0次
2018-01-18更新
|
126次组卷
|
9卷引用:云南省施甸县第三中学2019-2020学年高二12月月考化学试题
云南省施甸县第三中学2019-2020学年高二12月月考化学试题宁夏育才中学2017-2018学年高二上学期期末考试化学试题云南省玉溪市通海三中2018-2019学年高二上学期10月考试化学试题云南省河口县一中2018-2019学年高二上学期期中考试化学试题云南省景谷一中2018-2019学年高二下学期第一次月考化学试题吉林省汪清县第六中学2018-2019学年高二下学期期中考试化学试题贵州省凯里市第三中学2020-2021学年高二下学期第一次月考化学试题海南省儋州川绵中学2021-2022学年高二下学期第一次月考化学试题云南省玉溪市华宁县第二中学2021-2022年高二下学期开学考试化学试题
名校
7 . 下列各基态原子的电子排布式正确的是( )
①Be:1s22s12p1 ②O:1s22s22p4
③He:1s12s1 ④Cl:1s22s22p63s23p5
①Be:1s22s12p1 ②O:1s22s22p4
③He:1s12s1 ④Cl:1s22s22p63s23p5
| A.①② | B.②③ |
| C.①③ | D.②④ |
您最近一年使用:0次
2018-01-18更新
|
174次组卷
|
3卷引用:云南省腾冲市第一中学2021-2022学年高二下学期3月份考试化学试题
2016高二·全国·课时练习
名校
8 . 下列是某些元素基态原子的电子排布式,其中表示第三周期元素的是
| A.1s22s1 | B.1s22s22p5 |
| C.1s22s22p63s2 | D.1s22s22p63s23p64s1 |
您最近一年使用:0次
2017-11-27更新
|
346次组卷
|
8卷引用:云南省施甸县第三中学2019-2020学年高二12月月考化学试题
云南省施甸县第三中学2019-2020学年高二12月月考化学试题(已下线)同步君 选修3 第一章 第二节 原子结构与元素周期表高中化学人教版 选修三 第1章 原子结构与性质 原子结构与元素周期表甘肃省武威市第十八中学 2017-2018学年高二下学期期中考试化学试题2020届高三化学二轮物质结构题型专攻——基态原子核外电子排布【选择基础专练】(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质 课时1 原子结构与元素周期表云南省瑞丽市第一民族中学2021-2022学年高二下学期3月月考化学试题江苏省盐城市东台创新高级中学2021-2022学年高二2月份月检测化学试题
名校
9 . 下列说法中正确的是( )
| A.s电子绕核旋转,其轨道为一圆圈,而p电子是∞字形 |
| B.能层为1时,有自旋相反的两个轨道 |
| C.能层为3时,有3s、3p、3d、4f四个轨道 |
| D.s电子云是球形对称的,其疏密程度表示电子在该处出现的概率大小 |
您最近一年使用:0次
2017-04-12更新
|
547次组卷
|
9卷引用:云南省保山市昌宁县一中2019-2020学年高二10月月考化学试题
云南省保山市昌宁县一中2019-2020学年高二10月月考化学试题2016-2017学年甘肃省武威市第十八中学高二下学期第一次月考化学试卷湖北省襄阳市第四中学2017-2018学年高二12月月考化学试题河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1贵州省安顺市普定县第一中学2018-2019学年高二上学期12月考试化学试题【全国百强校】吉林省长春外国语学校2018-2019学年高二下学期第一次月考化学试题四川省乐山沫若中学2020-2021学年高二上学期第一次月考化学试题(已下线)模块同步卷02 原子结构与元素的性质-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)河北省石家庄市第一中学2019-2020学年高二下学期第一次月考化学试题
11-12高二·全国·课时练习
名校
解题方法
10 . A、B、C、D、E、F六种短周期元素,原子序数依次增大;A、B的阴离子与C、D的阳离子的电子排布式均为1s22s22p6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道数有9个,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且离子半径A小于F。回答:
(1)上述六种元素中,哪种元素的原子的第一电离能最大___ ?说明理由___ 。
(2)比较C、D元素的第一电离能___ ,并解释____ 。
(3)将上述六种元素按电负性从小到大排列_____ 。
(4)C、D、E、F元素形成的最高价氧化物是离子化合物还是共价化合物?___
(1)上述六种元素中,哪种元素的原子的第一电离能最大
(2)比较C、D元素的第一电离能
(3)将上述六种元素按电负性从小到大排列
(4)C、D、E、F元素形成的最高价氧化物是离子化合物还是共价化合物?
您最近一年使用:0次
2016-12-09更新
|
892次组卷
|
3卷引用:云南省腾冲市第一中学2021-2022学年高二下学期3月份考试化学试题
云南省腾冲市第一中学2021-2022学年高二下学期3月份考试化学试题(已下线)2012年人教版高中化学选修3 1.2原子结构与元素的性质练习卷第3节 原子结构与元素性质——A学习区 夯实基础(鲁科版选修3)



