名校
解题方法
1 . 结合物质结构与性质相关知识,回答下列问题。
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为_______ 。
(2) 分子中的N原子杂化类型为
分子中的N原子杂化类型为_______ ,分子的空间构型为_______ ,属于_______ (填“极性”或“非极性”)分子。
(3)吡啶(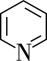 )在水中的溶解度远大于苯,可能原因是①吡啶和
)在水中的溶解度远大于苯,可能原因是①吡啶和 均为极性分子相似相溶,而苯为非极性分子;②
均为极性分子相似相溶,而苯为非极性分子;②_______ 。
(4)①如图所示,该有机物中 和
和 键的数目比为
键的数目比为_______ 。
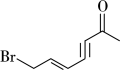
②比较 、P、S的第一电离能的大小:
、P、S的第一电离能的大小:_______ (从大到小排序)。
(5)钛的某配合物可用于催化环烯烃聚合,其结构如图所示:
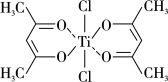
该配合物中存在的化学键有_______ (填序号)。
a.离子键 b.配位键 c.金属键 d.共价键 e.氢键
(6)氮化钛晶体的晶胞结构如图所示,该晶体结构中所含N、 原子个数比为
原子个数比为_______ 。

(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为(2)
 分子中的N原子杂化类型为
分子中的N原子杂化类型为(3)吡啶(
 )在水中的溶解度远大于苯,可能原因是①吡啶和
)在水中的溶解度远大于苯,可能原因是①吡啶和 均为极性分子相似相溶,而苯为非极性分子;②
均为极性分子相似相溶,而苯为非极性分子;②(4)①如图所示,该有机物中
 和
和 键的数目比为
键的数目比为
②比较
 、P、S的第一电离能的大小:
、P、S的第一电离能的大小:(5)钛的某配合物可用于催化环烯烃聚合,其结构如图所示:

该配合物中存在的化学键有
a.离子键 b.配位键 c.金属键 d.共价键 e.氢键
(6)氮化钛晶体的晶胞结构如图所示,该晶体结构中所含N、
 原子个数比为
原子个数比为
您最近一年使用:0次
2023-04-01更新
|
269次组卷
|
3卷引用:云南省保山市高(完)中C、D类学校2022~2023学年高二下学期3月份联考化学试题
2 . 反应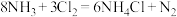 可用于氯气管道的检漏。下列说法正确的是
可用于氯气管道的检漏。下列说法正确的是
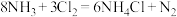 可用于氯气管道的检漏。下列说法正确的是
可用于氯气管道的检漏。下列说法正确的是A.中子数为20的氯原子: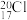 |
B.基态氯原子的电子排布图为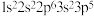 |
C.该反应中,未被氧化的 与被氧化的 与被氧化的 的物质的量之比为 的物质的量之比为 |
D. 没有孤电子对,不能作为配合物的配位体 没有孤电子对,不能作为配合物的配位体 |
您最近一年使用:0次
名校
3 . 短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子最外层有3个未成对电子,Y是地壳中含量高的元素,Z单质能与冷水剧烈反应并放出氢气,W的周期数与族序数相等。下列说法正确的是
| A.简单离子的半径:Z>W | B.简单气态氢化物的稳定性:X>Y |
| C.电负性大小:X>Y>W>Z | D.Z、W的最高价氧化物对应水化物之间不能发生反应 |
您最近一年使用:0次
2023-04-01更新
|
169次组卷
|
3卷引用:云南省保山市高(完)中C、D类学校2022~2023学年高二下学期3月份联考化学试题
4 . 短周期元素W、X、Y、Z在元素周期表中的相对位置如图4所示,其中W的简单气态氢化物与其最高价氧化物对应的水化物能相互反应,下列说法错误的是
| W | X | |
| Y | Z |
A.基态X原子的轨道表示式为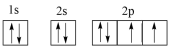 |
| B.第一电离能:W>X |
| C.简单氢化物的稳定性:X>Y |
| D.Z的氧化物对应的水化物为强酸 |
您最近一年使用:0次
名校
解题方法
5 . 下列各原子或离子的电子排布式或电子排布图表示正确的是
| A.Ca2+:1s22s22p63s23p6 |
| B.F-:1s22s23p6 |
C.P:最外层电子排布图为  |
| D.Cr:1s22s22p63s23p63d44s2 |
您最近一年使用:0次
2022-10-18更新
|
1412次组卷
|
18卷引用:云南省保山市昌宁县一中2019-2020学年高二10月月考化学试题
云南省保山市昌宁县一中2019-2020学年高二10月月考化学试题宁夏吴忠市2017-2018学年高二人教版选修3化学同步练习:第1章 原子结构与性质综合练习1【全国百强校】宁夏回族自治区育才中学勤行校区2018-2019学年高二下学期3月月考化学试题湖北省宜昌市葛洲坝中学2018-2019学年高二下学期期中考试化学试题吉林省汪清县第六中学2018-2019学年高二6月月考化学试题宁夏回族自治区吴忠市青铜峡市高级中学2019-2020学年高二上学期期末考试化学试题云南省元阳县第三中学2019-2020学年高二上学期期末考试化学试题吉林省长春市第二十九中学2020-2021学年高二上学期期末考试化学试题海南省海南鑫源高级中学2019-2020学年高三上学期期中考试化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期期中考试化学试题河北省石家庄市第一中学2019-2020学年高二下学期第一次月考化学试题海南省儋州市鑫源中学2021-2022学年高二上学期期末考试化学试题四川省绵阳市盐亭中学2022-2023学年高二上学期第一次月考教学质量检测化学试题黑龙江省哈尔滨市宾县第二中学2021-2022学年高二6月月考化学试题(已下线)1.1.2 电子云与原子轨道-同步学习必备知识第一章 原子结构与性质(A卷·知识通关练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)甘肃省武威市凉州区2022-2023学年高二下学期期中考试化学试题(已下线)热点01 原子结构
解题方法
6 . 下列说法错误的是
A.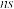 电子的能量不一定高于 电子的能量不一定高于 p电子的能量 p电子的能量 |
B.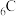 的电子排布式 的电子排布式 违反了洪特规则 违反了洪特规则 |
C.电子排布式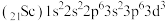 违反了构造原理 违反了构造原理 |
D.电子排布式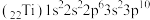 违反了泡利原理 违反了泡利原理 |
您最近一年使用:0次
2022-10-07更新
|
591次组卷
|
3卷引用:云南省腾冲市第八中学2023--2024学年上学期高二第3次月考化学试卷
11-12高二上·福建厦门·期中
名校
7 . 下列各组P、Q原子中,彼此的化学性质一定相似的是
| A.P原子:最外电子层1s2;Q原子:最外电子层2s2 |
| B.P原子:M电子层上有2个电子;Q原子:N电子层上有2个电子 |
| C.P原子:2p能级上有1个未成对电子;Q原子:3p能级上也有1个未成对电子 |
| D.P原子:最外电子层L层上只有一个空轨道;Q原子:最外电子层M层上也只有一个空轨道 |
您最近一年使用:0次
2022-08-16更新
|
272次组卷
|
11卷引用:云南省腾冲市第一中学2021-2022学年高二下学期3月份考试化学试题
云南省腾冲市第一中学2021-2022学年高二下学期3月份考试化学试题(已下线)2011-2012学年福建省厦门一中高二上学期期中考试化学试卷(已下线)2013-2014学年福建省厦门一中高二上学期期中考试化学试卷(已下线)2014高考化学苏教版总复习 专题12物质结构与性质练习卷辽宁省六校协作体2016-2017学年高二下学期期中考试化学试题福建省宁德市六校2018-2019学年高二第二学期期中联合考试化学试题2020届高三化学二轮物质结构题型专攻——原子结构与性质【基础专练】(人教版2019)选择性必修2 第一章 原子结构与性质 第一节 原子结构鲁科版2019选择性必修2第1章 原子结构与元素性质 第2节 原子结构与元素周期表 第1课时 基态原子的核外电子排布云南省石屏县第一中学2021-2022学年高二下学期3月份考试化学试题重庆市渝高中学校2022-2023学年高二下学期第一次月考化学试题
名校
解题方法
8 . 下列离子半径的大小顺序正确的是
① Na+ ② X2-:1s22s22p63s23p6 ③ Y2-:2s22p6 ④ Z-:3s23p6
① Na+ ② X2-:1s22s22p63s23p6 ③ Y2-:2s22p6 ④ Z-:3s23p6
| A.③>④>②>① | B.④>③>②>① |
| C.④>③>①>② | D.②>④>③>① |
您最近一年使用:0次
2022-04-02更新
|
615次组卷
|
8卷引用:云南省腾冲市第一中学2021-2022学年高二下学期3月份考试化学试题
云南省腾冲市第一中学2021-2022学年高二下学期3月份考试化学试题云南省昭通市绥江县二中2019-2020学年高二上学期期末考试化学试题(已下线)1.2.2 原子半径 元素的电离能及其变化规律-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)1.2.2 元素周期律-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)云南省宣威市第三中学2021-2022学年高二下学期3月份考试化学试题云南省普洱市第一中学2021-2022学年高二下学期3月份考试化学试题云南省曲靖市马龙区第一中学2021-2022学年高二下学期3月考试化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第1章01讲核心
名校
解题方法
9 . 氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
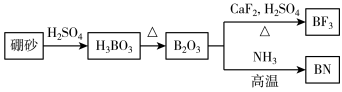
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是___________ 、___________ 。
(2)基态B的电子排布式为___________ ;B和N相比,电负性较大的是___________ ,BN中B的化合价为___________ 。
(3)在BF3中,F—B—F的键角是___________ ,B的杂化轨道类型为___________ ,BF3和过量NaF作用可生成NaBF4,BF 的立体结构为
的立体结构为___________ 。

请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是
(2)基态B的电子排布式为
(3)在BF3中,F—B—F的键角是
 的立体结构为
的立体结构为
您最近一年使用:0次
2022-03-29更新
|
159次组卷
|
4卷引用:云南省腾冲市第一中学2021-2022学年高二下学期3月份考试化学试题
名校
解题方法
10 . 碳、氮、铜形成的单质及它们形成的化合物有重要研究和应用价值,回答下列问题:
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
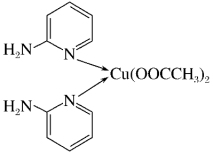
①基态Cu原子的价电子排布式为___________ ,在元素周期表中铜位于___________ 区(填“s”“p”“d”或“ds”)。
②C、N、O三种元素的第一电离能由大到小的顺序为___________ 。
③邻氨基吡啶的铜配合物中,Cu2+的配位数是________ ,N原子的杂化类型为_________ 。
(2)C60是富勒烯族分子中稳定性最高的一种,N60是未来的火箭燃料,二者结构相似。
①有关C60和N60的说法中正确的是___________ 。
A.C60和N60均属于分子晶体 B.N60的稳定性强于N2
C.C60中碳原子是sp3杂化 D.C60易溶于CS2、苯
②近年来,科学家合成了一种具有“二重结构”的球形分子,它是把足球形分子C60容纳在足球形分子Si60中,则该分子中含有的化学键类型为___________ (填“极性键”“非极性键”)。
(3)原子坐标参数和晶胞参数是晶胞的两个基本参数。

①图a中原子坐标参数分别为:A(0,0,0),B( ,
, ,0),C(
,0),C( ,0,
,0, ),则D的原子坐标参数为
),则D的原子坐标参数为___________ 。
②图b为铜的晶胞,铜原子半径为Rnm,NA是阿伏加德罗常数的值,则铜晶体的密度为______ g·cm-3(用含R、NA的式子表示)。
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。

①基态Cu原子的价电子排布式为
②C、N、O三种元素的第一电离能由大到小的顺序为
③邻氨基吡啶的铜配合物中,Cu2+的配位数是
(2)C60是富勒烯族分子中稳定性最高的一种,N60是未来的火箭燃料,二者结构相似。
①有关C60和N60的说法中正确的是
A.C60和N60均属于分子晶体 B.N60的稳定性强于N2
C.C60中碳原子是sp3杂化 D.C60易溶于CS2、苯
②近年来,科学家合成了一种具有“二重结构”的球形分子,它是把足球形分子C60容纳在足球形分子Si60中,则该分子中含有的化学键类型为
(3)原子坐标参数和晶胞参数是晶胞的两个基本参数。

①图a中原子坐标参数分别为:A(0,0,0),B(
 ,
, ,0),C(
,0),C( ,0,
,0, ),则D的原子坐标参数为
),则D的原子坐标参数为②图b为铜的晶胞,铜原子半径为Rnm,NA是阿伏加德罗常数的值,则铜晶体的密度为
您最近一年使用:0次



