名校
1 . Na2FeO4、Li4Ti5O12和LiFePO4均可用作电极材料。请回答下列问题:
(1)基态Fe3+的核外电子排布式为_______ ;在同周期元素中,基态原子的未成对电子数与基态Fe3+相同的元素为_______ (填元素符号)。
(2) 的空间构型为
的空间构型为_______ ,其中P原子的杂化轨道类型为_______ ;写出一种与 互为等电子体且中心原子与P不同主族的阴离子:
互为等电子体且中心原子与P不同主族的阴离子:_______ (填离子符号)。
(3)[Ti(H2O)6]Cl3为紫色晶体,其中1 mol阳离子中所含σ键的数目为_______ ;[Ti(H2O)6]Cl3中存在的作用力类型有_______ (填字母)。
A.氢键 B.配位键 C.共价键 D.离子键 E.金属键
(4)已知物质间的转化关系如图甲所示,其中a、c均大于0。

①基态Na原子的第一电离能可表示为_______ 。
②相同条件下,K2O的晶格能_______ (填“>”“<”或“=”)c kJ·mol-1,原因为_______ 。
③Na2O的立方晶胞结构如图乙所示。若紧邻的两个Na+之间的距离为d pm,阿伏加德罗常数的值为NA,晶体的密度为ρg·cm-3,则Na2O的摩尔质量可表示为_______ g·mol-1(用含有d、ρ、NA的代数式表示)。

(1)基态Fe3+的核外电子排布式为
(2)
 的空间构型为
的空间构型为 互为等电子体且中心原子与P不同主族的阴离子:
互为等电子体且中心原子与P不同主族的阴离子:(3)[Ti(H2O)6]Cl3为紫色晶体,其中1 mol阳离子中所含σ键的数目为
A.氢键 B.配位键 C.共价键 D.离子键 E.金属键
(4)已知物质间的转化关系如图甲所示,其中a、c均大于0。

①基态Na原子的第一电离能可表示为
②相同条件下,K2O的晶格能
③Na2O的立方晶胞结构如图乙所示。若紧邻的两个Na+之间的距离为d pm,阿伏加德罗常数的值为NA,晶体的密度为ρg·cm-3,则Na2O的摩尔质量可表示为

您最近一年使用:0次
2022-05-10更新
|
431次组卷
|
3卷引用:云南省德宏州2021届高三上学期期末教学质量检测理综化学试题
解题方法
2 . 硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
(1)基态硅原子的价电子排布式为_______ ,晶体硅和碳化硅熔点较高的是_______ (填化学式)。
(2)硅和卤素单质反应可以得到 ,
, 的熔沸点如下表:
的熔沸点如下表:
①0℃时, 、
、 、
、 、
、 呈气态是
呈气态是_______ (填化学式),沸点依次升高的原因是_______ ,气态 分子中心原子的杂化类型为
分子中心原子的杂化类型为_______ 。
② 与N-甲基咪唑(
与N-甲基咪唑( )反应可以得到M2+,其结构如图所示:
)反应可以得到M2+,其结构如图所示:

M2+中硅原子的杂化轨道类型为_______ (填标号:①sp3、②sp3d、③sp3d2)。H、C、N的电负性由大到小的顺序为_______ 。
(3)下图是Mg、 、
、 三种元素形成的某化合物的晶胞示意图。
三种元素形成的某化合物的晶胞示意图。
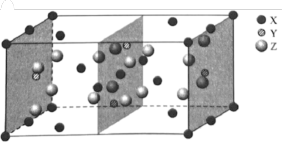
①已知化合物中 和
和 的原子个数比为1:4,图中Y表示
的原子个数比为1:4,图中Y表示_______ 原子(填元素符号),该化合物的化学式为_______ 。
②已知该晶胞的晶胞参数分别为a pm、b pm、c pm, ,则该晶体的密度
,则该晶体的密度
_______  (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,用含a、b、c、
,用含a、b、c、 的代数式表示)。
的代数式表示)。
(1)基态硅原子的价电子排布式为
(2)硅和卤素单质反应可以得到
 ,
, 的熔沸点如下表:
的熔沸点如下表: |  |  |  | |
| 熔点/K | 183.0 | 203.2 | 278.6 | 393.7 |
| 沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
 、
、 、
、 、
、 呈气态是
呈气态是 分子中心原子的杂化类型为
分子中心原子的杂化类型为②
 与N-甲基咪唑(
与N-甲基咪唑( )反应可以得到M2+,其结构如图所示:
)反应可以得到M2+,其结构如图所示:
M2+中硅原子的杂化轨道类型为
(3)下图是Mg、
 、
、 三种元素形成的某化合物的晶胞示意图。
三种元素形成的某化合物的晶胞示意图。
①已知化合物中
 和
和 的原子个数比为1:4,图中Y表示
的原子个数比为1:4,图中Y表示②已知该晶胞的晶胞参数分别为a pm、b pm、c pm,
 ,则该晶体的密度
,则该晶体的密度
 (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,用含a、b、c、
,用含a、b、c、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
3 . 现有三种元素的基态原子的电子排布式如下:①1s22s22p4;②1s22s22p63s23p4;③1s22s22p5。则下列有关比较中正确的是
| A.第一电离能;③>②>① | B.原子半径;②>①>③ |
| C.电负性:②>①>③ | D.最高正化合价:③>②=① |
您最近一年使用:0次
2022-04-27更新
|
264次组卷
|
7卷引用:云南省楚雄州2021-2022学年高二下学期期末考试化学试题
名校
解题方法
4 . 下列离子半径的大小顺序正确的是
① Na+ ② X2-:1s22s22p63s23p6 ③ Y2-:2s22p6 ④ Z-:3s23p6
① Na+ ② X2-:1s22s22p63s23p6 ③ Y2-:2s22p6 ④ Z-:3s23p6
| A.③>④>②>① | B.④>③>②>① |
| C.④>③>①>② | D.②>④>③>① |
您最近一年使用:0次
2022-04-02更新
|
615次组卷
|
8卷引用:云南省昭通市绥江县二中2019-2020学年高二上学期期末考试化学试题
云南省昭通市绥江县二中2019-2020学年高二上学期期末考试化学试题云南省腾冲市第一中学2021-2022学年高二下学期3月份考试化学试题云南省宣威市第三中学2021-2022学年高二下学期3月份考试化学试题云南省普洱市第一中学2021-2022学年高二下学期3月份考试化学试题云南省曲靖市马龙区第一中学2021-2022学年高二下学期3月考试化学试题(已下线)1.2.2 原子半径 元素的电离能及其变化规律-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)1.2.2 元素周期律-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)(已下线)【知识图鉴】单元讲练测选择性必修2第1章01讲核心
名校
解题方法
5 . 现有A、B、C、D四种元素,A是第五周期第ⅠA族元素,B是第三周期元素。B、C、D的最外层电子分别为2、2和7个。四种元素原子序数从小到大的顺序是B、C、D、A。已知C和D的次外层电子均为18个。
(1)写出A、B、C、D的元素符号A:_______ B:_______ C:_______ D:_______ 。
(2)写出B原子的电子排布式:_______ ;A、C、D的价电子排布式A:_______ C:_______ D:_______ 。
(3)写出碱性最强的最高价氧化物的水化物的化学式:_______ 。
(4)写出酸性最强的最高价氧化物的水化物的化学式:_______ 。
(1)写出A、B、C、D的元素符号A:
(2)写出B原子的电子排布式:
(3)写出碱性最强的最高价氧化物的水化物的化学式:
(4)写出酸性最强的最高价氧化物的水化物的化学式:
您最近一年使用:0次
2022-03-31更新
|
96次组卷
|
4卷引用:云南省玉溪市通海县第三中学2021-2022学年高二上学期期末考试化学试题
名校
解题方法
6 . 20世纪80年代至今,超分子化学在识别、催化、传输等功能方面迅速渗透到各学科领域。一种由 、
、 、
、 甲酸丁酯吡啶及
甲酸丁酯吡啶及 通过配位键形成的超分子结构如图所示。回答下列问题:
通过配位键形成的超分子结构如图所示。回答下列问题:

(1)写出超分子的两个重要特征_______ 。如图超分子中存在的化学键类型有_______ 。
a.离子键 b.配位键 c.氢键 d.分子间力
(2)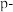 甲酸丁酯吡啶分子(
甲酸丁酯吡啶分子(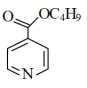 )中碳原子的杂化方式有
)中碳原子的杂化方式有_______ 。
(3) 的基态价电子排布图为
的基态价电子排布图为_______ ;基态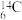 原子核外存在
原子核外存在_______ 对自旋相反的电子。
(4)吡啶(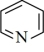 )是类似于苯的芳香族化合物。
)是类似于苯的芳香族化合物。 吡啶分子中含有的
吡啶分子中含有的 键数目为
键数目为_______ 。广义酸碱理论认为:凡能给出质子( )的任何分子或离子都是酸;凡能结合质子(
)的任何分子或离子都是酸;凡能结合质子( )的分子或离子都是碱。按此理论,吡啶(
)的分子或离子都是碱。按此理论,吡啶(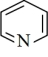 )属于
)属于_______ (填“酸”“碱”或“盐”).
(5) 的晶胞(如下图Ⅰ)与干冰的晶胞(如下图Ⅱ)相似,则每个
的晶胞(如下图Ⅰ)与干冰的晶胞(如下图Ⅱ)相似,则每个 分子周围与它最近距离且等距离的
分子周围与它最近距离且等距离的 分子有
分子有_______ 个;已知 晶体密度为
晶体密度为 ,则两个最近
,则两个最近 分子间的距离为
分子间的距离为_______ nm( 代表阿伏加德罗常数的值,用含
代表阿伏加德罗常数的值,用含 、
、 的代数式表示)。
的代数式表示)。

 、
、 、
、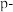 甲酸丁酯吡啶及
甲酸丁酯吡啶及 通过配位键形成的超分子结构如图所示。回答下列问题:
通过配位键形成的超分子结构如图所示。回答下列问题:
(1)写出超分子的两个重要特征
a.离子键 b.配位键 c.氢键 d.分子间力
(2)
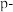 甲酸丁酯吡啶分子(
甲酸丁酯吡啶分子( )中碳原子的杂化方式有
)中碳原子的杂化方式有(3)
 的基态价电子排布图为
的基态价电子排布图为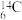 原子核外存在
原子核外存在(4)吡啶(
 )是类似于苯的芳香族化合物。
)是类似于苯的芳香族化合物。 吡啶分子中含有的
吡啶分子中含有的 键数目为
键数目为 )的任何分子或离子都是酸;凡能结合质子(
)的任何分子或离子都是酸;凡能结合质子( )的分子或离子都是碱。按此理论,吡啶(
)的分子或离子都是碱。按此理论,吡啶( )属于
)属于(5)
 的晶胞(如下图Ⅰ)与干冰的晶胞(如下图Ⅱ)相似,则每个
的晶胞(如下图Ⅰ)与干冰的晶胞(如下图Ⅱ)相似,则每个 分子周围与它最近距离且等距离的
分子周围与它最近距离且等距离的 分子有
分子有 晶体密度为
晶体密度为 ,则两个最近
,则两个最近 分子间的距离为
分子间的距离为 代表阿伏加德罗常数的值,用含
代表阿伏加德罗常数的值,用含 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
7 . 原子序数依次增大的五种元素A、B、E、F、G,A是周期表中原子半径最小的元素;B的基态原子价层电子排布为 ;E的基态原子
;E的基态原子 能级有3个单电子;
能级有3个单电子;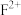 的
的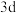 轨道中有10个电子;G单质在金属活动性顺序表中排在最末位。回答下列问题:
轨道中有10个电子;G单质在金属活动性顺序表中排在最末位。回答下列问题:
(1)F的基态原子的电子排布式为_______ 。
(2)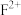 与
与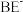 形成配离子时,配位数为4;
形成配离子时,配位数为4;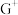 与
与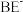 形成配离子时,配位数为2。工业上常用
形成配离子时,配位数为2。工业上常用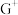 与
与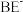 形成的配离子与F单质反应,生成
形成的配离子与F单质反应,生成 与
与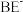 形成的配离子和G单质来提取G,写出上述反应的离子方程式
形成的配离子和G单质来提取G,写出上述反应的离子方程式_______ 。
(3)一种合成W(聚甲基丙烯酸甲酯)的流程中涉及化合物“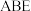 ”的应用,以下是其合成路线:
”的应用,以下是其合成路线:
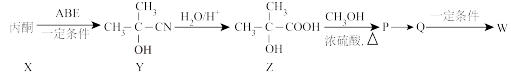
①X生成Y的反应类型是_______ 。
② 的化学方程式为
的化学方程式为_______ 。
③Q经加聚反应生成聚甲基丙烯酸甲酯,化学方程式为_______ 。
 ;E的基态原子
;E的基态原子 能级有3个单电子;
能级有3个单电子;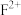 的
的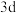 轨道中有10个电子;G单质在金属活动性顺序表中排在最末位。回答下列问题:
轨道中有10个电子;G单质在金属活动性顺序表中排在最末位。回答下列问题:(1)F的基态原子的电子排布式为
(2)
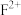 与
与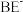 形成配离子时,配位数为4;
形成配离子时,配位数为4;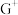 与
与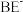 形成配离子时,配位数为2。工业上常用
形成配离子时,配位数为2。工业上常用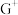 与
与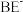 形成的配离子与F单质反应,生成
形成的配离子与F单质反应,生成 与
与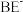 形成的配离子和G单质来提取G,写出上述反应的离子方程式
形成的配离子和G单质来提取G,写出上述反应的离子方程式(3)一种合成W(聚甲基丙烯酸甲酯)的流程中涉及化合物“
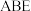 ”的应用,以下是其合成路线:
”的应用,以下是其合成路线:
①X生成Y的反应类型是
②
 的化学方程式为
的化学方程式为③Q经加聚反应生成聚甲基丙烯酸甲酯,化学方程式为
您最近一年使用:0次
名校
8 . 中国的铋储量居世界第一。元素铋在周期表中的数据如图所示,下列说法正确的是


| A.元素铋位于周期表第五周期ⅤB族 | B.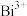 的核外电子有80种不同的运动状态 的核外电子有80种不同的运动状态 |
C.铋原子的 能级有一个未成对电子 能级有一个未成对电子 | D.铋元素的质量数为209.0 |
您最近一年使用:0次
2022-03-30更新
|
249次组卷
|
3卷引用:云南省昆明市第一中学2021-2022学年高二上学期期末考试化学试题
名校
9 . 结构是预测物质性质的重要依据。下列说法正确的是
A.电负性: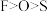 |
B.热稳定性: |
C.第一电离能: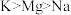 |
D.酸性: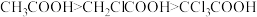 |
您最近一年使用:0次
10 . 某元素X的逐级电离能如图所示,下列说法正确的是
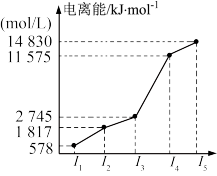

| A.X元素可能为+4价 | B.X可能为非金属 |
| C.X为第五周期元素 | D.X与氯反应时最可能生成的阳离子为X3+ |
您最近一年使用:0次
2022-03-28更新
|
290次组卷
|
26卷引用:云南省曲靖市沾益二中2017-2018学年高二下学期期末考试化学试题
云南省曲靖市沾益二中2017-2018学年高二下学期期末考试化学试题云南省双柏县第一中学2018-2019学年高二上学期期中考试化学试题云南省彝良县民族中学2018-2019学年高二上学期12月份考试化学试题云南省通海县第一中学2021-2022学年高二下学期3月月考化学试题云南省宁蒗彝族自治县第一中学2021-2022学年高二下学期3月考试化学试题云南省普洱市第一中学2021-2022学年高二下学期3月份考试化学试题云南省玉溪市华宁县第二中学2021-2022年高二下学期开学考试化学试题(已下线)2013-2014学年四川省成都市六校协作体高二上学期期中考试化学试卷(已下线)2014-2015学年四川邛崃市高埂中学高二上学期第一次月考化学试卷2014-2015福建省福州八中高二上学期期中化学(理)试卷2015-2016学年贵州省思南中学高二下期中化学试卷2020届高三化学二轮物质结构题型专攻——元素性质的递变规律【选择提升专练】人教化学选修3第一章第二节课时5山东省济南外国语学校2019-2020学年高二下学期3月份“空中课堂”阶段性测试化学试题天津市第二十中学2019-2020学年高二下学期阶段性检测化学试题四川省乐山沫若中学2020-2021学年高二上学期第一次月考化学试题(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 第3节 元素性质及其变化规律(已下线)模块同步卷02 原子结构与元素的性质-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)河南省汤阴县五一中学2019-2020学年高二下学期期中考试化学试题吉林省长春市实验中学2020-2021学年度高二下学期阶段考试化学试题新疆乌鲁木齐市第八中学2020-2021学年高二下学期第一阶段考试化学试题四川省平昌县得胜中学2021-2022学年高二上学期10月月考化学试题四川省巴中市平昌县博雅学校2021-2022学年高二上学期第二次月考化学试题河北省唐山市迁西县职教中心2021-2022学年高二(普职融通二部)下学期4月月考化学试题1.3.2元素的电离能、电负性及其变化规律(课前)-鲁科版选择性必修2陕西省咸阳市实验中学2022-2023学年高二上学期第一次月考化学试题



