名校
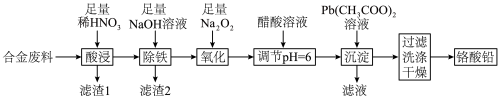
1 . 铬酸铅(PbCrO4)是黄色涂料“铬黄”的主要成分,实验室由某合金废料(主要成分为Fe、C、Cr2O3)制备PbCrO4的流程如图:
回答下列问题:
(1)基态82Pb2+的价层电子排布图为_______ 。
(2)“酸浸”时,加热可以加快反应速率,但温度不宜过高的原因是_______ (用化学方程式解释)。
(3)“滤渣2”中电负性最大的元素是_______ (填元素符号)。
(4)“氧化”时发生反应的离子方程式为_______ 。
(5)“调节pH=6”的目的是_______ 。
(6)二卤化铅(PbX2)是一类重要的含铅化合物,其熔点如下表所示:
①结合PbX2的熔点变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性_______ (填“增强”“不变”或“减弱”,后同)、共价性_______ 。
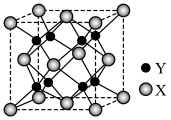
②PbF2的立方晶胞如图所示,其中X代表的离子是_______ (填离子符号);若该晶胞参数为anm,则正、负离子的最小核间距为_______ pm。
回答下列问题:
(1)基态82Pb2+的价层电子排布图为
(2)“酸浸”时,加热可以加快反应速率,但温度不宜过高的原因是
(3)“滤渣2”中电负性最大的元素是
(4)“氧化”时发生反应的离子方程式为
(5)“调节pH=6”的目的是
(6)二卤化铅(PbX2)是一类重要的含铅化合物,其熔点如下表所示:
| 二卤化铅 | PbF2 | PbCl2 | PbBr2 | PbI2 |
| 熔点/℃ | 824 | 501 | 373 | 402 |
②PbF2的立方晶胞如图所示,其中X代表的离子是
您最近一年使用:0次
2024-05-12更新
|
88次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高三下学期适应性月考(九)理综试卷-高中化学
名校
解题方法
2 . LiDFOB是一种新型的电解质锂盐,被广泛用于目前的锂电池中。LiDFOB的结构如图所示,其中元素M、X、Y、Z位于同一短周期且原子序数依次增大,X原子核外的s轨道与p轨道上的电子数之比为2:1,下列叙述正确的是
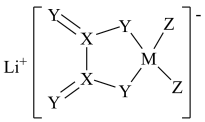
| A.基态Z原子核外有5种能量不同的电子 |
| B.该化合物中有极性键、非极性键、配位键和离子键 |
| C.第一电离能:Z>X>Y>M |
| D.M、X、Y、Z中,Z的最高价氧化物对应的水化物酸性最强 |
您最近一年使用:0次
2024-05-12更新
|
97次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高三下学期适应性月考(九)理综试卷-高中化学
名校
3 . 黑火药的主要成分为木炭(C)、硫黄(S)和火硝(KNO3).请回答下列问题。
(1)基态碳原子的电子占据最高能级的电子云轮廓图为___________ 形。
(2)原子核外电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数。基态N原子的电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。基态N原子的电子自旋磁量子数的代数和为___________ 。
(3)C、N、O、K四种元素的第一电离能由大到小的顺序为___________ 。
(4)O、S、Se、Te同主族元素,Te位于第五周期
①基态Te原子价电子排布式为___________ ;
②H2Se的中心原子杂化类型是:___________ , SeO32-的立体构型是___________ ;
③比较H2S与H2O沸点高低,并说明原因:___________ 。
(1)基态碳原子的电子占据最高能级的电子云轮廓图为
(2)原子核外电子有两种相反的自旋状态,分别用
 和
和 表示,称为电子的自旋磁量子数。基态N原子的电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。基态N原子的电子自旋磁量子数的代数和为(3)C、N、O、K四种元素的第一电离能由大到小的顺序为
(4)O、S、Se、Te同主族元素,Te位于第五周期
①基态Te原子价电子排布式为
②H2Se的中心原子杂化类型是:
③比较H2S与H2O沸点高低,并说明原因:
您最近一年使用:0次
名校
4 . 下列解释不正确的是
| 选项 | 物质的结构或性质或者实验目的 | 解释 |
| A | 键角: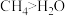 | CH4中C原子与H2O中O原子杂化不同 |
| B | CH4、SiH4、GeH4熔点逐渐升高 | 相对分子质量逐渐增大 |
| C | 一氟乙酸的 大于一溴乙酸 大于一溴乙酸 |  的电负性比 的电负性比 的大 的大 |
| D | 水中溶解性;苯<吡啶( | 吡啶能与水形成分子间氢键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 下列化学用语或图示表达正确的是
| A.基态25Mn的价电子3d44s2 |
| B.PCl3分子的空间结构模型:正四面体 |
C.2pz的电子云轮廓图: |
D.基态氧原子的轨道表示式: 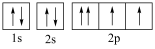 |
您最近一年使用:0次
名校
解题方法
6 . 现有A、B、C、D、E、F六种元素,均为前4周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
(1)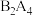 的电子式为
的电子式为___________ (用元素符号表示,下同)。
(2)C元素的原子核外共有___________ 种不同运动状态的电子,基态原子中能量最高的电子所占据的原子轨道呈___________ 形。
(3)某同学推断D元素基态原子的轨道表示式为: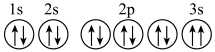 。该同学所画的轨道表示式违背了
。该同学所画的轨道表示式违背了___________ (填序号)。
a.泡利不相容原理 b.洪特规则
(4)C、D、E三种元素的简单离子半径由大到小的顺序是___________ (用离子符号表示)。
(5)其中五种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈狭长的八面体结构(如下图所示)。阳离子中存在的化学键类型有___________ (填序号)。
该化合物加热时阳离子首先失去的组分是___________ (填化学式),判断理由是___________ 。
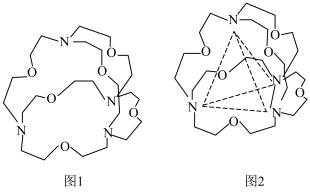
(6)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是___________ (填标号)。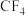 b.
b. c.
c. d.
d.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素基态原子的核外p电子数比s电子数少1 |
| C元素基态原子的核外p轨道中有两个未成对电子 |
D元素的气态基态原子的第一至第四电离能分别是: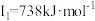 , ,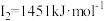 , ,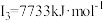 , ,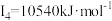 |
| E元素的主族序数比周期数大3 |
| F元素位于元素周期表中的第11列 |
(1)
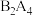 的电子式为
的电子式为(2)C元素的原子核外共有
(3)某同学推断D元素基态原子的轨道表示式为:
 。该同学所画的轨道表示式违背了
。该同学所画的轨道表示式违背了a.泡利不相容原理 b.洪特规则
(4)C、D、E三种元素的简单离子半径由大到小的顺序是
(5)其中五种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈狭长的八面体结构(如下图所示)。阳离子中存在的化学键类型有

该化合物加热时阳离子首先失去的组分是
(6)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是
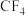 b.
b. c.
c. d.
d.
您最近一年使用:0次
7 . 下列化学用语或图示表达不正确的是
| A.乙炔的结构简式为HC≡CH |
| B.HClO的结构式为H―O―Cl |
C.基态Si原子价电子轨道表示式为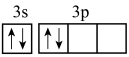 |
D.Na2O2的电子式为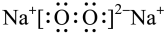 |
您最近一年使用:0次
名校
解题方法
8 . 锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)元素Zn位于元素周期表的___________ 区,基态Zn原子核外电子占据的最高能层的符号是___________ ,占据该能层电子的电子云轮廓图形状为___________ 形。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。其中,第一电离能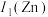
___________  (填“大于”或“小于”),原因是
(填“大于”或“小于”),原因是___________ 。
(3) 形成的某种化合物M是很好的补锌剂,其键线式如图所示。
形成的某种化合物M是很好的补锌剂,其键线式如图所示。___________ 。
②常见含氮的配体有 、
、 、
、 等,
等, 分子的空间构型为
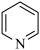
分子的空间构型为___________ ,叠氮化钠( )用于汽车的安全气囊,结构如图甲。
)用于汽车的安全气囊,结构如图甲。 中存在的两个大π键可用符号
中存在的两个大π键可用符号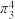 表示,一个
表示,一个 中键合电子(形成化学键的电子)总数为
中键合电子(形成化学键的电子)总数为___________ 。叠氮酸(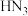 )结构如图乙,分子中②号N原子的杂化方式为
)结构如图乙,分子中②号N原子的杂化方式为___________ 。 最近的4个
最近的4个 所围成的空间构型为
所围成的空间构型为___________ ,距离 最近且等距离的
最近且等距离的 有
有___________ 个。若晶胞参数为apm,则 与
与 最近距离为
最近距离为___________ pm(用含a的代数式表示)。
(1)元素Zn位于元素周期表的
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。其中,第一电离能
 (填“大于”或“小于”),原因是
(填“大于”或“小于”),原因是(3)
 形成的某种化合物M是很好的补锌剂,其键线式如图所示。
形成的某种化合物M是很好的补锌剂,其键线式如图所示。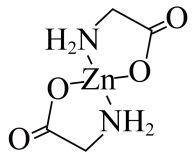
②常见含氮的配体有
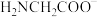 、
、 、
、 等,
等, 分子的空间构型为
分子的空间构型为 )用于汽车的安全气囊,结构如图甲。
)用于汽车的安全气囊,结构如图甲。 中存在的两个大π键可用符号
中存在的两个大π键可用符号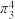 表示,一个
表示,一个 中键合电子(形成化学键的电子)总数为
中键合电子(形成化学键的电子)总数为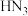 )结构如图乙,分子中②号N原子的杂化方式为
)结构如图乙,分子中②号N原子的杂化方式为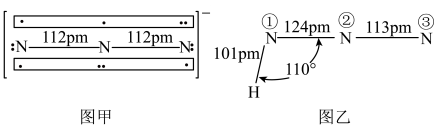
 最近的4个
最近的4个 所围成的空间构型为
所围成的空间构型为 最近且等距离的
最近且等距离的 有
有 与
与 最近距离为
最近距离为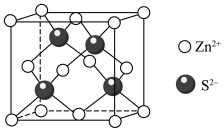
您最近一年使用:0次
9 . 五种前四周期的元素X、Y、Z、Q、T。已知X元素基态原子的M层有6种运动状态不同的电子;Y原子的价电子构型为3d84s2,基态Z原子的L层p能级有一个空轨道;Q原子的L电子层的p能级只有一对成对电子;基态T原子的M电子层上p轨道半充满。下列说法错误的是
| A.Y、Q及氢三种元素形成的某化合物,能用于制作可充电电池的电极材料 |
| B.若X、T、Z的最高价的氧化物对应的水化物分别为u、v、w,则酸性为:u>v>w。理由是含氧酸酸性与非羟基氧原子数有关 |
| C.X、Y、T三种元素第一电离能的大小次序是:X>T>Y |
| D.化合物ZQ2、ZX2均是由极性键构成的非极性分子 |
您最近一年使用:0次
10 . 下列关于价电子排布3s23p4的描述正确的是
| A.它的元素符号为O |
| B.它的核外电子排布式为1s22s22p63s23p4 |
| C.可以与H2化合生成液态化合物 |
D.其电子排布图为 |
您最近一年使用:0次
2024-04-13更新
|
195次组卷
|
44卷引用:云南省武定县第一中学2018-2019学年高二上学期12月份考试化学试题
云南省武定县第一中学2018-2019学年高二上学期12月份考试化学试题云南省昭通水田新区中学2018-2019学年高二上学期12月月考化学试题(已下线)2012届浙江省杭州高中高三第二次月考化学试卷2015-2016学年西藏日喀则一中高二10月月考化学试卷2015-2016学年贵州省思南中学高二下第二次月考化学试卷宁夏回族自治区银川市长庆高级中学2018-2019学年高二下学期第二次月考化学试题新疆石河子第二中学2018-2019学年高二下学期第一次月考化学试题河南省林州市第一中学2019-2020学年高二3月线上调研考试化学试题江苏省盐城市伍佑中学2019-2020学年高二下学期第一次阶段考试化学试题湖北省武汉市黄陂区第六中学2019-2020学年高二下学期三月线上考试化学试题黑龙江省牡丹江市海林市朝鲜族中学2021-2022学年高二下学期第一次月考化学试题宁夏吴忠市吴忠中学2022-2023学年高三上学期阶段性测试 化学试题河北省保定高碑店市崇德实验中学2022-2023学年高三上学期10月月考化学试题贵州省遵义市桐梓县荣兴高级中学2023-2024学年高二下学期第一次(3月)月考化学试题(已下线)吉林一中2009--2010学年度下学期期末考试第一次质量检测高二化学试卷(已下线)2011-2012学年福建省厦门一中高二上学期期中考试化学试卷(已下线)2011-2012学年内蒙古包头三十三中高二下学期期中考试化学试卷(已下线)2011-2012学年河南许昌鄢陵一高高二下学期期中考试化学试卷(已下线)2012-2013学年山东省淄博市沂源一中高二下学期期中模块检测化学卷(已下线)2012-2013学年山东省济南一中高二下学期期中考试理科化学试卷(已下线)2013-2014学年福建省厦门一中高二上学期期中考试化学试卷2013-2014山东省即墨市高二下学期期中考试化学试卷宁夏育才中学2016-2017学年高二下学期期中考试化学试题江苏省盘湾中学、陈洋中学2017-2018学年高二上学期期中联考(选修)化学试题2016-2017学年高中化学选修3(人教版)模块综合测评【全国校级联考】新疆昌吉市教育共同体四校2017-2018学年高二下学期期末联考化学试题宁夏回族自治区青铜峡市高级中学2018-2019学年高二上学期期末考试化学试题新疆维吾尔自治区北京大学附属中学新疆分校2018-2019学年高二下学期期中考试化学试题福建省长泰县第一中学2018-2019学年高二下学期期末考试化学试题甘肃省静宁县第一中学2019-2020学年高二下学期期中考试(第二次月考)化学试题(普通班)广西防城港市防城中学2019-2020学年高二下学期期中考试化学试题湖北省仙桃市汉江中学2018-2019学年高二下学期期中考试化学试题新疆新源县第二中学2019-2020学年高二下学期期末考试化学试题(已下线)考点33 原子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)课时54 原子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)宁夏石嘴山市平罗中学2021-2022学年高二上学期期中考试化学试题宁夏青铜峡市高级中学2021-2022学年高二上学期期末考试化学试题(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)重庆市西南大学附属中学校2022-2023学年高二上学期开学定时训练化学试题(广延班)(已下线)考点41 原子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江西省南昌市八一中学2022-2023学年高二上学期1月期末考试化学试题(已下线)第01讲 原子结构-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)(已下线)选择题6-10(已下线)第一章章节专项提升

 )
)

