1 . 氮化钛为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。 晶体的晶胞结构如图所示(白球代表N,黑球代表Ti)。下列说法错误的是
晶体的晶胞结构如图所示(白球代表N,黑球代表Ti)。下列说法错误的是
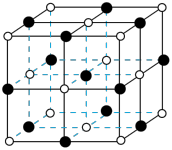
 晶体的晶胞结构如图所示(白球代表N,黑球代表Ti)。下列说法错误的是
晶体的晶胞结构如图所示(白球代表N,黑球代表Ti)。下列说法错误的是
A.基态 原子的价层电子排布式为 原子的价层电子排布式为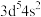 |
B. 均位于N构成的八面体空隙中 均位于N构成的八面体空隙中 |
C.该晶胞中含有6个 原子和4个N原子 原子和4个N原子 |
D. 元素位于元素周期表d区,是过渡元素 元素位于元素周期表d区,是过渡元素 |
您最近一年使用:0次
2023-06-27更新
|
301次组卷
|
2卷引用:云南省部分名校2022-2023学年高二下学期6月联考化学试题
解题方法
2 . X、Y、Z、Q、W原子序数依次增大。X的电子只有一种自旋取向,Y元素基态原子的价层电子排布是 ,Z元素的最高价氧化物的水化物与其简单氢化物能形成盐,Q单质的水溶液具有漂白性,W为第4周期金属元素,基态原子无未成对电子且内层电子全满。下列说法正确的是
,Z元素的最高价氧化物的水化物与其简单氢化物能形成盐,Q单质的水溶液具有漂白性,W为第4周期金属元素,基态原子无未成对电子且内层电子全满。下列说法正确的是
 ,Z元素的最高价氧化物的水化物与其简单氢化物能形成盐,Q单质的水溶液具有漂白性,W为第4周期金属元素,基态原子无未成对电子且内层电子全满。下列说法正确的是
,Z元素的最高价氧化物的水化物与其简单氢化物能形成盐,Q单质的水溶液具有漂白性,W为第4周期金属元素,基态原子无未成对电子且内层电子全满。下列说法正确的是| A.Q单质可从Z的简单气态氢化物中置换出Z |
B.第一电离能: |
| C.Q与Y原子形成的分子空间结构为四面体型 |
D.1mol中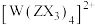 中 中 键数为 键数为 |
您最近一年使用:0次
2023-06-27更新
|
306次组卷
|
2卷引用:云南省部分名校2022-2023学年高二下学期6月联考化学试题
3 . 下列化学用语正确的是
A.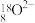 的结构示意图: 的结构示意图: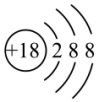 |
B.基态 的价电子排布图为 的价电子排布图为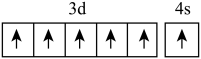 |
C.用箭头表示 的配位键: 的配位键: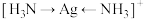 |
D. 的VSEPR模型: 的VSEPR模型: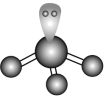 |
您最近一年使用:0次
2023-06-27更新
|
472次组卷
|
3卷引用:云南省部分名校2022-2023学年高二下学期6月联考化学试题
云南省部分名校2022-2023学年高二下学期6月联考化学试题云南省三校2024届高三上学期备考实用性联考(一)化学试题(已下线)专题01 基本概念-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
4 . 草酸钴在化学中应用广泛,可以用于制取催化剂和指示剂。用水钴矿(主要成分为Co2O3,还含有少量SiO2、Al2O3、CuO、FeO及MnO2杂质)制取草酸钴晶体(CoC2O4·2H2O)的工艺流程如图所示:

常温下,有关沉淀数据如下表(“完全沉淀”时,金属离子浓度≤1.0×10-5mol·L-1)。
回答下列问题:
(1)下列状态的钴中,电离最外层一个电子所需能量最大的是 (填序号)。
(2)“酸浸”时Co2O3发生反应的化学方程式为___________________ 。
(3)“氧化”时发生反应的离子方程式为___________________________ 。
(4)滤渣②的主要成分有_______________________ ,常温下,若“调节pH”后,溶液中c(Co2+)=0.1 mol·L-1,则需调节溶液pH的范围是______________________ ( 忽略溶液的体积变化)。
(5)“提纯”分为萃取和反萃取两步进行,先向除杂后的溶液中加入某有机酸萃取剂(HA)2,发生反应:Co2++n(HA)2 CoA2·(n-1)(HA)2+2H+。当溶液pH处于4.5到6.5之间时,Co2+萃取率随着溶液pH增大而增大,其原因是
CoA2·(n-1)(HA)2+2H+。当溶液pH处于4.5到6.5之间时,Co2+萃取率随着溶液pH增大而增大,其原因是_________________________ ;反萃取时,应加入的物质是_____ ( 填溶液名称)。
(6)某含钴配合物的组成为CoCl3·5NH3·H2O,该配合物中钴离子的配位数是6。1 mol该配合物可以与足量的硝酸银反应生成3 mol AgCl沉淀,则该配合物的配体是________ ,若NH3分子与钴离子形成配合物后,H-N- H键角会____________ (填“变大”“变小”或“不变”),并说明理由:_______________ 。

常温下,有关沉淀数据如下表(“完全沉淀”时,金属离子浓度≤1.0×10-5mol·L-1)。
| 沉淀 | Mn(OH)2 | Co(OH)2 | Cu(OH)2 | Fe(OH)3 | Al(OH)3 |
| 恰好完全沉淀时pH | 10.1 | 9.4 | 6.7 | 2.8 | 5.2 |
(1)下列状态的钴中,电离最外层一个电子所需能量最大的是 (填序号)。
| A.[Ar]3d74s1 | B.[ Ar]3d74s2 |
| C.[Ar]3d74s14p1 | D.[Ar]3d74p1 |
(3)“氧化”时发生反应的离子方程式为
(4)滤渣②的主要成分有
(5)“提纯”分为萃取和反萃取两步进行,先向除杂后的溶液中加入某有机酸萃取剂(HA)2,发生反应:Co2++n(HA)2
 CoA2·(n-1)(HA)2+2H+。当溶液pH处于4.5到6.5之间时,Co2+萃取率随着溶液pH增大而增大,其原因是
CoA2·(n-1)(HA)2+2H+。当溶液pH处于4.5到6.5之间时,Co2+萃取率随着溶液pH增大而增大,其原因是(6)某含钴配合物的组成为CoCl3·5NH3·H2O,该配合物中钴离子的配位数是6。1 mol该配合物可以与足量的硝酸银反应生成3 mol AgCl沉淀,则该配合物的配体是
您最近一年使用:0次
名校
解题方法
5 . 已知:BF3熔点-127°C,沸点-100°C,水解生成H3BO3(一元弱酸,结构如图所示)和HBF4,与氨气相遇立即生成白色的BF3·NH3(氨合三氟化硼)固体。下列说法错误的是
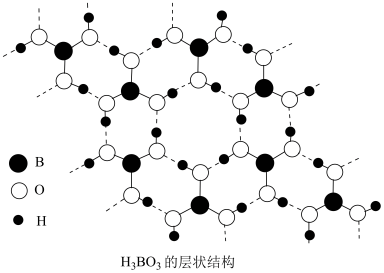

| A.电负性:F>N>H>B |
B. 的空间结构为三角锥形 的空间结构为三角锥形 |
| C.H3BO3中存在分子间氢键,BF3·NH3中存在配位键 |
D.H3BO3的电离方程式为:H3BO3+H2O H+ + H+ + |
您最近一年使用:0次
名校
解题方法
6 . 元素周期表是元素周期律的具体表现,是学习和研究化学的一种重要工具。下图是元素周期表的一部分,回答下列问题:
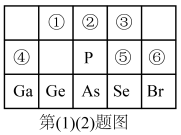

(1)元素①最简单的气态氢化物分子的空间构型是___________ 。请用一个方程式比较元素①和元素②的非金属性强弱:___________ 。
(2)元素⑤、⑥非金属性更强的是:___________ (用元素符号表示),请从原子结构的角度解释:___________ 。
电离能是指由气态原子失去电子形成阳离子需要的能量。从中性原子中失去第一个电子所需要的能量为第一电离能 ,失去第二个电子所需要的能量为第二电离能
,失去第二个电子所需要的能量为第二电离能 ,依次类推。上图为1-19号元素第一电离能
,依次类推。上图为1-19号元素第一电离能 。回答下列问题:
。回答下列问题:
(3)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常,预测下列关系式中正确的是___________(填编号)。
(4)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
锰元素位于第四周期第VIIB族。请写出基态 的价层电子排布式:
的价层电子排布式:___________ ,比较两元素的 、
、 ,可知,气态
,可知,气态 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子难,对此你的解释是
再失去1个电子难,对此你的解释是___________ 。
(5)短周期元素中符合“对角线规则”的元素有Be和Al、B和Si,它们的性质分别有一定的相似性,写出 与NaOH溶液反应的离子方程式:
与NaOH溶液反应的离子方程式:___________ 。


(1)元素①最简单的气态氢化物分子的空间构型是
(2)元素⑤、⑥非金属性更强的是:
电离能是指由气态原子失去电子形成阳离子需要的能量。从中性原子中失去第一个电子所需要的能量为第一电离能
 ,失去第二个电子所需要的能量为第二电离能
,失去第二个电子所需要的能量为第二电离能 ,依次类推。上图为1-19号元素第一电离能
,依次类推。上图为1-19号元素第一电离能 。回答下列问题:
。回答下列问题:(3)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常,预测下列关系式中正确的是___________(填编号)。
A.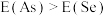 | B. |
C. | D.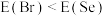 |
| 元素 | Mn | Fe | |
电离能 |  | 717 | 759 |
 | 1509 | 1561 | |
 | 3248 | 2957 | |
 的价层电子排布式:
的价层电子排布式: 、
、 ,可知,气态
,可知,气态 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子难,对此你的解释是
再失去1个电子难,对此你的解释是(5)短周期元素中符合“对角线规则”的元素有Be和Al、B和Si,它们的性质分别有一定的相似性,写出
 与NaOH溶液反应的离子方程式:
与NaOH溶液反应的离子方程式:
您最近一年使用:0次
名校
解题方法
7 . 1919年,卢瑟福通过实验,实现了人类历史上第一次人工核反应,其反应原理为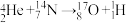 。下列说法正确的是
。下列说法正确的是
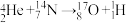 。下列说法正确的是
。下列说法正确的是A.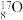 和 和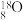 互为同素异形体 互为同素异形体 |
B. 的原子结构示意图为 的原子结构示意图为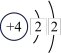 |
C.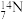 的核外电子共有7种运动状态 的核外电子共有7种运动状态 |
D.一个 原子中含有一个质子、一个中子和一个电子 原子中含有一个质子、一个中子和一个电子 |
您最近一年使用:0次
名校
解题方法
8 . 下列说法正确的是
A. 分子的球棍模型为 分子的球棍模型为 |
B.铍原子最外层的电子云图为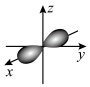 |
C.基态Fe原子的价电子轨道表示式为 |
D.基态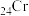 的简化电子排布式: 的简化电子排布式: |
您最近一年使用:0次
名校
9 . 短周期主族元素X、Y、Z、W的原子序数依次增大,W的最外层电子数比X的最外层电子数少1个,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物(ZXY)2的结构式如图所示。下列说法错误的是
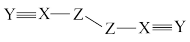
| A.W位于元素周期表的p区 | B.第一电离能:Y>Z>X |
| C.W的原子中有9种运动状态不同的电子 | D.Y、W可形成共价晶体 |
您最近一年使用:0次
2023-06-01更新
|
51次组卷
|
3卷引用:云南省曲靖市会泽县实验高级中学校2022-2023学年高二下学期6月月考化学试题
10 . 四种元素的基态原子的核外电子排布式分别是:①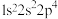 ,②
,②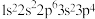 ,③
,③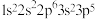 ,④
,④ ,下列说法不正确的是
,下列说法不正确的是
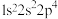 ,②
,②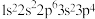 ,③
,③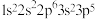 ,④
,④ ,下列说法不正确的是
,下列说法不正确的是| A.最高价含氧酸的酸性:②<③ | B.第一电离能:①>④ |
| C.①②③④都是p区元素 | D.电负性:①>② |
您最近一年使用:0次
2023-05-07更新
|
567次组卷
|
4卷引用:云南省保山市高(完)中C、D类学校2022-2023学年高二下学期6月份联考化学试题
云南省保山市高(完)中C、D类学校2022-2023学年高二下学期6月份联考化学试题北京市第五中学通州分校2023-2024学年高三上学期12月练习二化学试题北京市昌平区2023届高三下学期第二次统一练习化学试题(已下线)考点巩固卷05 物质结构 元素周期律(2大考点50题)-2024年高考化学一轮复习考点通关卷(新高考通用)



