1 . 实验室以含钴废料(主要成分是CoO、Co2O3,含少量Fe2O3、Al2O3等杂质)为原料制备CoCO3的流程如图所示。
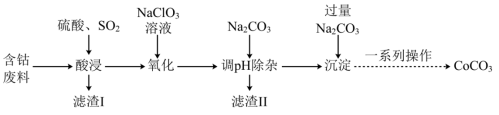
已知:①“酸浸”后过滤得到的滤液中含有Co2+、Fe2+、Al3+等。
②有关沉淀数据如表(完全沉淀时金属离子浓度≤1×10-5mol/L):
回答下列问题:
(1)基态钴原子的价层电子排布式为_______ ,在“酸浸”之前,先要对含钴废料进行粉碎处理,其目的是_______ 。
(2)“酸浸”时需通入SO2,其中SO2作______ (填“氧化剂”或“还原剂”),由于“酸浸”时,溶液中会产生Fe3+,写出SO2与Fe3+反应的离子方程式:______ 。
(3)“氧化”流程中,氧化剂与还原剂的物质的量之比为______ 。
(4)常温下,若浸取液中c(Co2+)=0.1mol/L,则“调pH除杂”时需调节溶液pH的范围为______ 至______ 。(加入NaClO3和Na2CO3时,溶液的体积变化忽略)
(5)“滤渣II”的主要成分为______ 。
(6)“一系列操作”为过滤、洗涤、干燥,其中过滤所需要的硅酸盐材质的仪器有_______ 。
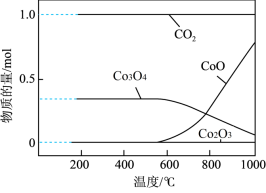
(7)将得到的CoCO3固体在空气中加热,反应温度对反应产物的影响如图所示,则500~1000℃时,发生主要反应的化学方程式为_______ 。

已知:①“酸浸”后过滤得到的滤液中含有Co2+、Fe2+、Al3+等。
②有关沉淀数据如表(完全沉淀时金属离子浓度≤1×10-5mol/L):
| 沉淀 | Al(OH)3 | Fe(OH)3 | Co(OH)2 |
| 恰好完全沉淀时的pH | 5.2 | 2.8 | 9.4 |
(1)基态钴原子的价层电子排布式为
(2)“酸浸”时需通入SO2,其中SO2作
(3)“氧化”流程中,氧化剂与还原剂的物质的量之比为
(4)常温下,若浸取液中c(Co2+)=0.1mol/L,则“调pH除杂”时需调节溶液pH的范围为
(5)“滤渣II”的主要成分为
(6)“一系列操作”为过滤、洗涤、干燥,其中过滤所需要的硅酸盐材质的仪器有
(7)将得到的CoCO3固体在空气中加热,反应温度对反应产物的影响如图所示,则500~1000℃时,发生主要反应的化学方程式为

您最近一年使用:0次
解题方法
2 . 短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的价层电子排布式为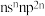 ,X、Y、Z三种元素组成的一种化合物
,X、Y、Z三种元素组成的一种化合物 的焰色呈黄色,向该化合物中滴加盐酸,产生刺激性气味气体和浅黄色固体,该气体通入品红溶液中,品红溶液褪色。下列叙述错误的是
的焰色呈黄色,向该化合物中滴加盐酸,产生刺激性气味气体和浅黄色固体,该气体通入品红溶液中,品红溶液褪色。下列叙述错误的是
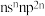 ,X、Y、Z三种元素组成的一种化合物
,X、Y、Z三种元素组成的一种化合物 的焰色呈黄色,向该化合物中滴加盐酸,产生刺激性气味气体和浅黄色固体,该气体通入品红溶液中,品红溶液褪色。下列叙述错误的是
的焰色呈黄色,向该化合物中滴加盐酸,产生刺激性气味气体和浅黄色固体,该气体通入品红溶液中,品红溶液褪色。下列叙述错误的是| A.基态Y原子最外层电子的电子云轮廓图为球形 |
B.电负性: |
C. 的VSEPR模型为平面三角形 的VSEPR模型为平面三角形 |
D.Z的最简单氢化物的中心原子采取 杂化 杂化 |
您最近一年使用:0次
名校
3 . 2023年的诺贝尔化学奖授予了“发现和合成量子点”的三位科学家。下图是一种量子点的结构,下列说法不正确的是

A.基态原子第一电离能: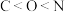 |
B.基态Se原子的价层电子排布式为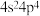 |
| C.该结构中C和N原子轨道的杂化类型相同 |
D.该结构中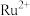 提供空轨道,N原子提供孤电子对 提供空轨道,N原子提供孤电子对 |
您最近一年使用:0次
2024-02-25更新
|
180次组卷
|
2卷引用:云南省保山市2023-2024学年高三上学期期末质量监测理综化学试题
4 . 下列化学用语或图示表达不正确的是
A.基态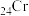 原子的价层电子排布图: 原子的价层电子排布图: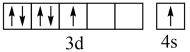 |
B.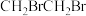 的名称:1,2-二溴乙烷 的名称:1,2-二溴乙烷 |
C. 的电子式: 的电子式: |
D.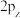 的电子云轮廓图: 的电子云轮廓图: |
您最近一年使用:0次
解题方法
5 . 皓矾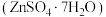 主要用作制取颜料和其他含锌材料,在防腐、电镀、医学、畜牧业和农业上也有诸多应用。皓矾可由菱锌矿(主要成分为
主要用作制取颜料和其他含锌材料,在防腐、电镀、医学、畜牧业和农业上也有诸多应用。皓矾可由菱锌矿(主要成分为 ,还含有少量
,还含有少量 以及
以及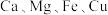 等的化合物)制备,制备流程图如图所示:
等的化合物)制备,制备流程图如图所示:

已知:常温下,金属离子开始沉淀和完全沉淀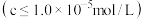 时的
时的 如下表所示:
如下表所示:
回答下列问题:
(1)写出基态铜原子的价层电子排布式_______ 。
(2)滤渣①的主要成分为_______ ;“浸取”工序中,能加快浸取效率的措施有_______ (任写一种作答)。
(3)“氧化”时该步骤离子方程式为_______ 。
(4)若“调 过滤”工序中,调节溶液
过滤”工序中,调节溶液 ,所得“滤渣②的主要成分为
,所得“滤渣②的主要成分为_______ ,氢氧化铁的溶度积常数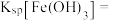
_______ 。
(5)“转化过滤”中加入锌粉的目的是_______ 。
(6)从滤液④获得皓矾晶体的具体操作为_______ 、_______ 、过滤、洗涤、干燥。
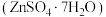 主要用作制取颜料和其他含锌材料,在防腐、电镀、医学、畜牧业和农业上也有诸多应用。皓矾可由菱锌矿(主要成分为
主要用作制取颜料和其他含锌材料,在防腐、电镀、医学、畜牧业和农业上也有诸多应用。皓矾可由菱锌矿(主要成分为 ,还含有少量
,还含有少量 以及
以及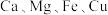 等的化合物)制备,制备流程图如图所示:
等的化合物)制备,制备流程图如图所示:
已知:常温下,金属离子开始沉淀和完全沉淀
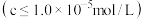 时的
时的 如下表所示:
如下表所示:| 金属离子 |  |  |  |  |  |
开始沉淀时 | 1.9 | 6.4 | 4.7 | 7.0 | 9.1 |
沉淀完全时 | 3.4 | 8.4 | 6.7 | 9.0 | 11.1 |
(1)写出基态铜原子的价层电子排布式
(2)滤渣①的主要成分为
(3)“氧化”时该步骤离子方程式为
(4)若“调
 过滤”工序中,调节溶液
过滤”工序中,调节溶液 ,所得“滤渣②的主要成分为
,所得“滤渣②的主要成分为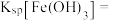
(5)“转化过滤”中加入锌粉的目的是
(6)从滤液④获得皓矾晶体的具体操作为
您最近一年使用:0次
6 . 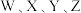 为原子序数依次增大的短周期主族元素,
为原子序数依次增大的短周期主族元素, 的简单氢化物能与它的最高价氧化物的水化物反应生成盐,
的简单氢化物能与它的最高价氧化物的水化物反应生成盐, 原子核外
原子核外 能级上的电子总数与
能级上的电子总数与 能级上的电子总数相等,
能级上的电子总数相等, 原子核外没有未成对电子,
原子核外没有未成对电子, 与
与 位于同一主族。下列说法正确的是
位于同一主族。下列说法正确的是
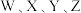 为原子序数依次增大的短周期主族元素,
为原子序数依次增大的短周期主族元素, 的简单氢化物能与它的最高价氧化物的水化物反应生成盐,
的简单氢化物能与它的最高价氧化物的水化物反应生成盐, 原子核外
原子核外 能级上的电子总数与
能级上的电子总数与 能级上的电子总数相等,
能级上的电子总数相等, 原子核外没有未成对电子,
原子核外没有未成对电子, 与
与 位于同一主族。下列说法正确的是
位于同一主族。下列说法正确的是A.简单离子半径: | B. 的第一电离能比 的第一电离能比 第一电离能小 第一电离能小 |
C.用电解 的氧化物制备 的氧化物制备 单质 单质 | D. 的简单氢化物比 的简单氢化物比 的简单氢化物稳定 的简单氢化物稳定 |
您最近一年使用:0次
7 . 下列说法或有关化学用语的表达正确的是
| A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 |
B.基态Fe原子的外围电子排布图为: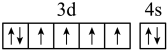 |
| C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 |
| D.根据原子核外电子排布的特点,Cu在周期表中属于s区元素 |
您最近一年使用:0次
2024-02-04更新
|
183次组卷
|
61卷引用:2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷
2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷(已下线)2013-2014宁夏银川一中高二下学期期末考试化学试卷新疆呼图壁县第一中学2016-2017学年高二下学期期末考试化学试题贵州省思南中学2016-2017学年高二下学期期末考试化学试题辽宁省丹东市2017-2018学年高二下学期期末质量监测化学试题安徽省蚌埠第三中学2019-2020学年高二下学期期末考试化学试题新疆昌吉教育共同体2020-2021学年高二下学期期末质量检测化学试题福建省漳州市正兴学校2020-2021学年高二下学期期末考试化学试题宁夏银川市第六中学2020-2021学年高二下学期期末考试化学试题辽宁省本溪市第二高级中学2021-2022学年高二上学期期末考试化学试题吉林地区普通高中友好学校联合体2021-2022学年高二下学期期末考试化学试题云南省石屏县第一中学2021-2022学年高二下学期3月份考试化学试题福建省莆田市第一中学2021-2022学年高二下学期期末考试化学试题甘肃省庆阳市第六中学2021-2022学年高二下学期期末考试化学试题新疆克拉玛依市高级中学2021-2022学年高二下学期期末考试化学试题重庆市荣昌永荣中学校2021-2022学年高二下学期期末考试化学试题河北省唐山市开滦一中2022-2023学年高二下学期期末考试化学试题吉林省普通高中友好学校联合体2023-2024学年高二上学期第三十七届基础年段期末联考化学试题2014-2015学年宁夏宁大附中高二上学期期中考试化学试卷2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷2015-2016学年山西省大同一中高二下3月月考化学试卷2015-2016学年贵州省思南中学高二下期中化学试卷2015-2016学年辽宁省五校协作体高二下学期期中考试化学试卷山西省大同市第一中学2016-2017学年高二5月月考化学试题2017-2018学年人教版高中化学选修三 模块综合质量检测吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题四川省广安市第二中学校2017-2018学年高二下学期第二次月考化学试题山西省沁县中学2018-2019学年高二下学期第一次月考化学试题吉林省扶余市第一中学2018-2019学年高二下学期第一次月考化学试题内蒙古自治区第一机械制造(集团)有限公司第一中学2018-2019学年高二下学期期中考试化学试题山东省聊城市2019-2020学年高三化学一轮复习《物质结构与性质(》模拟测试四川省广安第二中学校2017-2018学年高二下学期第一次月考化学试题广西靖西市第二中学2019-2020学年高二下学期开学考试化学试题陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题吉林省长春市第二十九中学2019-2020学年高二下学期期中考试化学试题江苏省如东高级中学2019-2020学年高一下学期第二次阶段测试化学试题安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题福建省莆田市仙游县第二中学2019-2020学年高二下学期期中考试化学试题四川省南充市阆中中学2020-2021学年高二上学期期中考试化学试题(已下线)模块同步卷12 综合检测卷(提升卷)-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记山东省济南市济阳区闻韶中学2020-2021学年高三(3班)12月第一次模拟考试化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期第一次月考化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期期中考试化学试题辽宁省沈阳市辽中区第一高级中学2020-2021学年高二下学期开学考试化学试题天津市实验中学滨海学校2020-2021学年高二下学期期中化学试题甘肃省武威第十八中学2020-2021学年高二下学期期中考试化学试题(已下线)作业02 原子结构与元素的性质-2021年高二化学暑假作业(人教版2019)四川省遂宁市第二中学校2021-2022学年高二上学期期中考试化学试题山西省长治市沁源县第一中学等名校2021-2022学年高二下学期5月联考化学试题第一章 本章复习提升1安徽省合肥市肥东县综合高中2021-2022学年高二下学期期中考试化学试题四川省广安市邻水县二中 2022-2023学年高三上学期9月考化学试题福建省泉州科技中学2021-2022学年高二下学期期中考试化学试题山东省新泰市第一中学2022-2023学年高二下学期第一次大单元考试化学试题山东省青岛第十九中学2022-2023学年高二下学期4月月考化学试题宁夏青铜峡市宁朔中学2022-2023学年高二下学期期中考试化学试题四川省广元中学2022-2023学年高二下学期5月期中考试化学试题安徽省安庆市第二中学2022-2023学年高二下学期期中考试化学试题湖南省长郡中学2023-2024学年高二下学期寒假检测(开学考试)化学试题湖北省武汉西藏中学2023-2024学年高二下学期4月月考化学试题
解题方法
8 . a、b、c、d、e、f是原子序数依次增大的非0族元素,位于元素周期表的前四周期。a的一种核素无中子,b的s能级电子数与p能级的电子数之比为4:3,c与e同主族,未成对电子数为2,d在同周期元素中的原子半径最大,f在同周期元素中的未成对电子数最多。请回答下列问题:
(1)上述元素中,位于元素周期表p区的元素有________ (填元素符号),其中基态c原子中电子占据的最高能级的原子轨道形状是________ 。
(2)基态e原子的核外电子排布式为_______ ,其核外有____ 种不同空间运动状态的电子。
(3)b、c、d、e简单离子半径由大到小的顺序为_____ (用离子符号表示)。
(4)基态f原子的未成对电子数与成对电子数之比为______ 。
(1)上述元素中,位于元素周期表p区的元素有
(2)基态e原子的核外电子排布式为
(3)b、c、d、e简单离子半径由大到小的顺序为
(4)基态f原子的未成对电子数与成对电子数之比为
您最近一年使用:0次
9 . 元素周期表被认为是“科学共同的语言”,它的发现使化学学习和研究变得有规律可循。其简洁有序的背后,是众多科学家艰苦奋斗的结果。下图是元素周期表的一部分,请按要求回答下列问题:

(1)317年左右,东晋炼丹家葛洪在炼丹时分离出了砷。砷的原子结构示意图为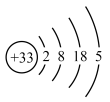 ,砷在周期表中的位置是
,砷在周期表中的位置是___________ 。我国“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。原子半径:Ga___________ As(填“>”或“<”)。
(2)1787年,法国化学家拉瓦锡首次发现硅存在于岩石中。硅元素位于元素周期表金属与非金属的分界处,请写出硅单质的一种用途___________ 。
(3)1817年瑞典化学家贝采利乌斯发现硒元素。硫化硒(SeS)可用于治疗脂溢性皮炎。硫元素和硒元素简单气态氢化物热稳定性较强的为___________ (填化学式)。
(4)1825年,丹麦化学家奥斯特首次分离出了铝的单质。铝是地壳中含量最高的金属元素,但铝的利用却比铜和铁晚得多,可能的原因是___________ 。
(5)目前,世界上还有许多科学家为发现新元素孜孜不倦地努力着。可能存在的第119号元素,有人称“类钫”,位于元素周期表第八周期ⅠA族,有关“类钫”的预测说法正确的是
(6)小赵同学在研究元素周期表时发现,碳元素有“ ”这一信息,观察元素周期表后,寻找规律,推测某元素“
”这一信息,观察元素周期表后,寻找规律,推测某元素“ ”中
”中 可能的含义是
可能的含义是___________ 。

(1)317年左右,东晋炼丹家葛洪在炼丹时分离出了砷。砷的原子结构示意图为
 ,砷在周期表中的位置是
,砷在周期表中的位置是(2)1787年,法国化学家拉瓦锡首次发现硅存在于岩石中。硅元素位于元素周期表金属与非金属的分界处,请写出硅单质的一种用途
(3)1817年瑞典化学家贝采利乌斯发现硒元素。硫化硒(SeS)可用于治疗脂溢性皮炎。硫元素和硒元素简单气态氢化物热稳定性较强的为
(4)1825年,丹麦化学家奥斯特首次分离出了铝的单质。铝是地壳中含量最高的金属元素,但铝的利用却比铜和铁晚得多,可能的原因是
(5)目前,世界上还有许多科学家为发现新元素孜孜不倦地努力着。可能存在的第119号元素,有人称“类钫”,位于元素周期表第八周期ⅠA族,有关“类钫”的预测说法正确的是
| A.“类钫”在化合物中显+1价 |
| B.“类钫”单质具有强氧化性 |
| C.“类钫”最高价氧化物对应的水化物为弱碱 |
| D.“类钫”单质能与冷水剧烈反应 |
(6)小赵同学在研究元素周期表时发现,碳元素有“
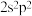 ”这一信息,观察元素周期表后,寻找规律,推测某元素“
”这一信息,观察元素周期表后,寻找规律,推测某元素“ ”中
”中 可能的含义是
可能的含义是
您最近一年使用:0次
10 . 金属铜、铁在日常生活中应用广泛,根据下列说法回答下列问题。
(1) 的制备反应为
的制备反应为 。
。
上述氧化过程中, (II)
(II)_____ (答简化电子排布式)变为 III)
III)_____ (答外围电子排布图),基态 (III)电子占据
(III)电子占据_____ 个不同轨道。
(2)对上述反应式中的短周期元素按照电负性由小到大排序为_____
(3)配合物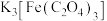 的配位数为6,其配体
的配位数为6,其配体 中的
中的 的杂化方式为
的杂化方式为_____ 杂化。
(4)铜原子与氯原子形成化合物的晶胞如图所示(黑球代表铜原子,白球表示氯原子)。
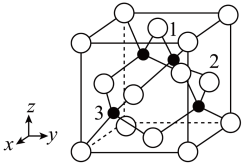
①已知铜和氯的电负性分别为1.9和3.0,则铜与氯形成的化合物属于_____ (填“离子”或“共价”)化合物。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为( ,
, ,1),则原子2和3的坐标分别为
,1),则原子2和3的坐标分别为_____ 、_____ 。
③已知该晶体的密度为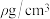 ,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为
,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为_____ pm(只写计算式)。
(1)
 的制备反应为
的制备反应为 。
。上述氧化过程中,
 (II)
(II) III)
III) (III)电子占据
(III)电子占据(2)对上述反应式中的短周期元素按照电负性由小到大排序为
(3)配合物
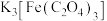 的配位数为6,其配体
的配位数为6,其配体 中的
中的 的杂化方式为
的杂化方式为(4)铜原子与氯原子形成化合物的晶胞如图所示(黑球代表铜原子,白球表示氯原子)。

①已知铜和氯的电负性分别为1.9和3.0,则铜与氯形成的化合物属于
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为(
 ,
, ,1),则原子2和3的坐标分别为
,1),则原子2和3的坐标分别为③已知该晶体的密度为
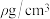 ,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为
,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为
您最近一年使用:0次



