解题方法
1 . 2019年,我国第二艘国产航母即将下水。建造航母需要大量的新型材料。航母的龙骨要耐冲击,甲板要耐高温,外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,其中主要金属为铬、镍、铁等。基态铬的价电子排布图为:______ ;基态铁的未成对电子数是:_____ ;我们常用SCN-检验Fe3+,请写出SCN-的电子式:______ 。
(2)海水中含有大量盐,对金属有很强的腐蚀性,其中大多数盐是卤盐。根据下列卤化钠的信息回答有关问题
①NaF的熔点比NaI的熔点高的原因是:___________ 。
②NaH具有NaCl型的立方晶体结构,已知NaH晶体的晶胞参数a=488pm,H-的半径为142pm,则Na+半径为:______ pm;NaH的理论密度是:______ g·cm−3(保留三位有效数字)。

(3)钛的“热传导系数低”,耐高温耐腐蚀,所以配备垂直起降战斗机的甲板是需要钛合金铆钉的。
①在钛合金中添加硅可以提高其耐热性能。硅在自然界中主要以二氧化硅和硅酸盐的形式存在,在硅酸盐中 的空间构型为
的空间构型为___________ ,在二氧化硅中硅原子的杂化方式为___________ 。
②在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1∶5,,则该配离子的化学式为:___________ 。
(1)镍铬钢抗腐蚀性能强,其中主要金属为铬、镍、铁等。基态铬的价电子排布图为:
(2)海水中含有大量盐,对金属有很强的腐蚀性,其中大多数盐是卤盐。根据下列卤化钠的信息回答有关问题
| 化学式 | NaF | NaCl | NaBr | NaI |
| 熔点/℃ | 995 | 801 | 775 | 651 |
①NaF的熔点比NaI的熔点高的原因是:
②NaH具有NaCl型的立方晶体结构,已知NaH晶体的晶胞参数a=488pm,H-的半径为142pm,则Na+半径为:

(3)钛的“热传导系数低”,耐高温耐腐蚀,所以配备垂直起降战斗机的甲板是需要钛合金铆钉的。
①在钛合金中添加硅可以提高其耐热性能。硅在自然界中主要以二氧化硅和硅酸盐的形式存在,在硅酸盐中
 的空间构型为
的空间构型为②在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1∶5,,则该配离子的化学式为:
您最近一年使用:0次
名校
解题方法
2 . 用NaBH4进行“化学镀”镀镍,可以得到坚硬、耐腐蚀的保护层(3Ni3B+Ni),反应的离子方程式为:20Ni2++16BH +34OH-+6H2O=2(3Ni3B+Ni)+10B(OH)
+34OH-+6H2O=2(3Ni3B+Ni)+10B(OH)  +35H2↑,下列说法不正确的是
+35H2↑,下列说法不正确的是
 +34OH-+6H2O=2(3Ni3B+Ni)+10B(OH)
+34OH-+6H2O=2(3Ni3B+Ni)+10B(OH)  +35H2↑,下列说法不正确的是
+35H2↑,下列说法不正确的是
A.1 mol B(OH)  含有σ键的数目为8NA 含有σ键的数目为8NA |
B.BH 的立体构型是正四面体形 的立体构型是正四面体形 |
| C.B原子核外电子的运动状态和能量均不相同 |
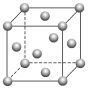
| D.Ni的晶胞结构如图所示,镍原子的配位数为12 |
您最近一年使用:0次
2021-08-28更新
|
339次组卷
|
4卷引用:辽宁省锦州市2019-2020学年高二下学期期末考试化学试卷
辽宁省锦州市2019-2020学年高二下学期期末考试化学试卷(已下线)2021年秋季高三开学摸底考化学试卷03(江苏专用)江苏省苏州市相城区陆慕高级中学2021-2022学年高三上学期第一次阶段性诊断测试化学试题四川省内江市威远中学校2021-2022学年高二上学期期中考试化学试题
3 . 下列对一些实验事实及其理论解释都正确的是
| 选项 | 实验事实 | 理论解释 |
| A |  原子的第一电离能小于 原子的第一电离能小于 原子 原子 | 同周期元素原子的电离能随原子序数增大而增大 |
| B |  为直线形分子 为直线形分子 |  分子中 分子中 为 为 杂化,键角为 杂化,键角为 |
| C | 金刚石的熔点高于石墨 | 金刚石是原子晶体,石墨是分子晶体 |
| D |  的沸点低于 的沸点低于 |  的相对分子质量小于 的相对分子质量小于 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题:
(1)基态砷原子的核外子排布式为_______ 。
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为_______ ,电负性由大到小的顺序为_______ 。
(3)AsCl3分子的立体构型为_______ ,其中As的杂化轨道类型为_______ 。
(4)H2O与H2S为同族元素的氢化物,H2O可以形成H9O 或H3O+,而H2S几乎不能形成类似的H9S
或H3O+,而H2S几乎不能形成类似的H9S 或H3S+,其原因是
或H3S+,其原因是_______ 。
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2 000 ℃,其晶胞结构如图所示。
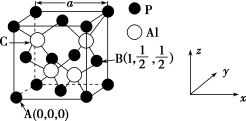
①磷化铝的晶体类型为_______ 。
②A、B点的原子坐标如图所示,则C点的原子坐标为_______ 。
③磷化铝的晶胞参数a=546.35 pm,其密度为_______ g·cm-3(列出计算式即可,用NA表示阿伏加德罗常数的值)。
(1)基态砷原子的核外子排布式为
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为
(3)AsCl3分子的立体构型为
(4)H2O与H2S为同族元素的氢化物,H2O可以形成H9O
 或H3O+,而H2S几乎不能形成类似的H9S
或H3O+,而H2S几乎不能形成类似的H9S 或H3S+,其原因是
或H3S+,其原因是(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2 000 ℃,其晶胞结构如图所示。

①磷化铝的晶体类型为
②A、B点的原子坐标如图所示,则C点的原子坐标为
③磷化铝的晶胞参数a=546.35 pm,其密度为
您最近一年使用:0次
2021-04-22更新
|
395次组卷
|
3卷引用:辽宁省海城市高中教育集团2019-2020学年高二下学期6月联考化学试题
名校
5 . 电子数相等的微粒叫等电子体,下列微粒组是等电子体的是
| A.N2O4和NO2 | B.Na+和Cl- | C. 和 和 | D.NO和O2 |
您最近一年使用:0次
2021-04-08更新
|
137次组卷
|
4卷引用:2015-2016学年新疆伊犁州伊宁二中高二下期末化学试卷
解题方法
6 . C、Si、Ge、Sn都是IVA族元素,该族元素单质及其化合物在材料、医药等方面有重要应用.请回答下列问题:
(1)Ge的原子核外电子排布式为_______ 。
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是_______ 。
(3)CO2分子的空间构型及碳氧之间的成键方式_______ 。
(4)1molSiO2晶体中的硅氧键数目为_______ 。
(5)CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为_______ 。
(6)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm- 1,CO分子中碳氧键的伸缩振动频率为2143cm - 1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度_______ (填字母)。
(A)强 (B)弱 (C)相等 (D)无法判断。
(1)Ge的原子核外电子排布式为
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是
(3)CO2分子的空间构型及碳氧之间的成键方式
(4)1molSiO2晶体中的硅氧键数目为
(5)CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为
(6)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm- 1,CO分子中碳氧键的伸缩振动频率为2143cm - 1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度
(A)强 (B)弱 (C)相等 (D)无法判断。
您最近一年使用:0次
7 . (1)①用一个离子方程式说明 和
和 结合
结合 能力的相对强弱
能力的相对强弱_______ 。
②用一个化学方程式说明 与
与 氧化性的相对强弱
氧化性的相对强弱_______ 。
(2)维生素 的结构简式如图所示,维生素
的结构简式如图所示,维生素 晶体溶于水的过程,需要克服的微粒间作用力,除范德华力外还有
晶体溶于水的过程,需要克服的微粒间作用力,除范德华力外还有_______ 。

(3)联氨(又称肼,分子式 )是一种应用广泛的化工原料,可用作火箭燃料.联氨为二元弱碱,在水中的电离方程式与氨相似。
)是一种应用广泛的化工原料,可用作火箭燃料.联氨为二元弱碱,在水中的电离方程式与氨相似。
①肼的水溶液显碱性原因是_______ (请用肼在水中一级电离的方程式来表示)。
②联氨与硫酸形成的酸式盐的化学式为_______ 。
 和
和 结合
结合 能力的相对强弱
能力的相对强弱②用一个化学方程式说明
 与
与 氧化性的相对强弱
氧化性的相对强弱(2)维生素
 的结构简式如图所示,维生素
的结构简式如图所示,维生素 晶体溶于水的过程,需要克服的微粒间作用力,除范德华力外还有
晶体溶于水的过程,需要克服的微粒间作用力,除范德华力外还有
(3)联氨(又称肼,分子式
 )是一种应用广泛的化工原料,可用作火箭燃料.联氨为二元弱碱,在水中的电离方程式与氨相似。
)是一种应用广泛的化工原料,可用作火箭燃料.联氨为二元弱碱,在水中的电离方程式与氨相似。①肼的水溶液显碱性原因是
②联氨与硫酸形成的酸式盐的化学式为
您最近一年使用:0次
名校
8 . 等电子体是指原子总数相同、价电子总数也相同的微粒。下列各选项中的两种微粒不互为等电子体的是
| A.N2O和CO2 | B.O3和 | C.CH4和 | D.CO2和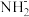 |
您最近一年使用:0次
2021-03-18更新
|
455次组卷
|
3卷引用:广西田东县田东中学2020-2021学年高二上学期12月月考化学试题
广西田东县田东中学2020-2021学年高二上学期12月月考化学试题黑龙江省哈尔滨市第六中学2020-2021学年高二4月月考化学试题(已下线)第39练 共价键-2023年高考化学一轮复习小题多维练(全国通用)
20-21高二·全国·课时练习
9 . 以下各能级是否存在?如果存在,各包含多少个原子轨道?
(1)2s:___________ 。
(2)2d:___________ 。
(3)3p___________ 。
(4)5d___________ 。
(1)2s:
(2)2d:
(3)3p
(4)5d
您最近一年使用:0次
名校
解题方法
10 . 前四周期元素X、Y在元素周期表中的相对位置如图所示,X的基态原子的价电子排布式为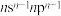 ,下列说法不正确的是
,下列说法不正确的是
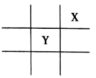
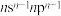 ,下列说法不正确的是
,下列说法不正确的是
| A.X元素的电负性大于Y元素的电负性 | B.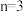 |
| C.Y位于元素周期表中第四周期第ⅤA族 | D.原子半径: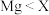 |
您最近一年使用:0次
2021-02-19更新
|
516次组卷
|
2卷引用:四川省遂宁中学校2019-2020学年高二下学期第二次月考化学试题



