解题方法
1 . 含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1)基态S原子的价电子中,两种自旋状态的电子数之比为___________ 。
(2)Cu与Zn相比,第二电离能与第一电离能差值更大的是___________ ,原因是___________ 。
(3) 的几何构型为
的几何构型为___________ ,其中心离子杂化方式为___________ 。
(4)如图是硫的四种含氧酸根的结构:
A. B.
B.
C. D.
D.
根据组成和结构推断,能在酸性溶液中将 转化为
转化为 的是
的是___________ (填标号),理由是___________ 。
(5)如图是CZTS四元半导体化合物的四方晶胞。
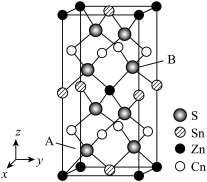
①该物质的化学式为___________ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为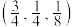 ,则B原子的坐标为
,则B原子的坐标为___________ 。
(1)基态S原子的价电子中,两种自旋状态的电子数之比为
(2)Cu与Zn相比,第二电离能与第一电离能差值更大的是
(3)
 的几何构型为
的几何构型为(4)如图是硫的四种含氧酸根的结构:
A.
 B.
B.
C.
 D.
D.
根据组成和结构推断,能在酸性溶液中将
 转化为
转化为 的是
的是(5)如图是CZTS四元半导体化合物的四方晶胞。

①该物质的化学式为
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为
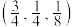 ,则B原子的坐标为
,则B原子的坐标为
您最近一年使用:0次
名校
2 . 氮、硅和铬及其相关化合物用途非常广泛。回答下列问题:
(1)基态N原子的核外电子排布式是_______ ,Cr位于元素周期表第四周期_______ 族。
(2)K和Cr属于同一周期,且核外最外层电子构型相同,两种元素原子第一电离能的大小关系是K_______ Cr(填“>”或“<”或“=”); 的熔点(83℃)比
的熔点(83℃)比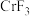 的熔点(1100℃)低得多,这是因为
的熔点(1100℃)低得多,这是因为_______ 。
(3)硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元。硅氧四面体可以表示成 :其中
:其中 表示氧原子,中心
表示氧原子,中心 表示硅原子,其俯视图为
表示硅原子,其俯视图为 。
。
①SiO2晶胞可理解成将金刚石晶胞(如图1所示)中的C原子置换成Si原子,然后在Si-Si之间插入O原子而形成。

推测SiO2晶胞中含有_______ 个O原子,O—Si—O的键角为_______ 。
②蒙脱石散中的“(SixOy)”是一种大片层状的多硅酸根,其可能结构如图2所示,则x:y=_______ 。
(1)基态N原子的核外电子排布式是
(2)K和Cr属于同一周期,且核外最外层电子构型相同,两种元素原子第一电离能的大小关系是K
 的熔点(83℃)比
的熔点(83℃)比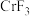 的熔点(1100℃)低得多,这是因为
的熔点(1100℃)低得多,这是因为(3)硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元。硅氧四面体可以表示成
 :其中
:其中 表示氧原子,中心
表示氧原子,中心 表示硅原子,其俯视图为
表示硅原子,其俯视图为 。
。①SiO2晶胞可理解成将金刚石晶胞(如图1所示)中的C原子置换成Si原子,然后在Si-Si之间插入O原子而形成。

推测SiO2晶胞中含有
②蒙脱石散中的“(SixOy)”是一种大片层状的多硅酸根,其可能结构如图2所示,则x:y=
您最近一年使用:0次
名校
解题方法
3 . 三草酸合铁酸钾{K3[Fe(C2O4)3]·3H2O}是制备铁触媒的主要原料,在光照下能分解:2 K3[Fe(C2O4)3]·3H2O 3K2C2O4+2FeC2O4+2CO2↑+6H2O。回答下列问题:
3K2C2O4+2FeC2O4+2CO2↑+6H2O。回答下列问题:
(1)基态Fe原子的电子排布式为___________ ,基态Fe2+与Fe3+中未成对电子的数目之比为___________ 。
(2)三草酸合铁酸钾所含元素中,第一电离能最大的是___________ (填元素符号,下同),电负性最大的是___________ 。
(3)H2O分子的立体构型为___________ 。
(4)金刚石的晶胞结构如图1所示,碳原子分别位于顶点、面心和体内。
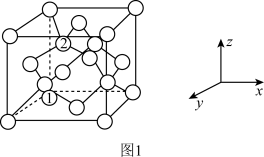
若图中原子1的坐标为(0,0,0),则原子2的坐标为___________ 。若金刚石的晶胞边长为apm,则其中碳碳键的键长d___________ (用含a的代数式表示)pm。
(5)铁有δ、γ、α三种同素异形体(如图2),三种晶体在不同温度下能发生转化。
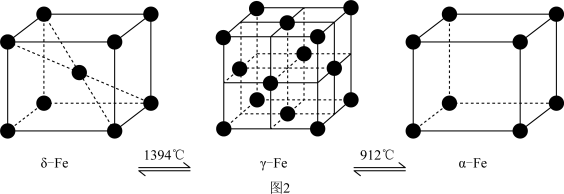
①δ、γ、α三种晶体晶胞中铁原子的配位数之比为___________ 。
②若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶胞的密度之比为___________ (用含a、b的代数式表示)。
 3K2C2O4+2FeC2O4+2CO2↑+6H2O。回答下列问题:
3K2C2O4+2FeC2O4+2CO2↑+6H2O。回答下列问题:(1)基态Fe原子的电子排布式为
(2)三草酸合铁酸钾所含元素中,第一电离能最大的是
(3)H2O分子的立体构型为
(4)金刚石的晶胞结构如图1所示,碳原子分别位于顶点、面心和体内。

若图中原子1的坐标为(0,0,0),则原子2的坐标为
(5)铁有δ、γ、α三种同素异形体(如图2),三种晶体在不同温度下能发生转化。

①δ、γ、α三种晶体晶胞中铁原子的配位数之比为
②若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶胞的密度之比为
您最近一年使用:0次
名校
解题方法
4 . 磷的单质及其化合物用途非常广泛。回答下列问题:
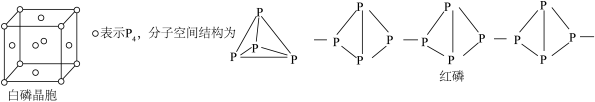
(1)白磷晶胞属于面心立方最密堆积,每个 周围距离最近的
周围距离最近的 个数为
个数为___________ ;白磷隔绝空气加热转化为红磷,红磷是巨型分子,无定型结构,能证明白磷是晶体的实验验证方法是___________ 。
(2)黑磷晶体是一种新型材料,其中正交型黑磷具有类似石墨的片层结构。正交型黑磷中P原子的杂化方式为___________ 。白磷和正交型黑磷相比,熔点较高的是___________ ,原因是___________ 。
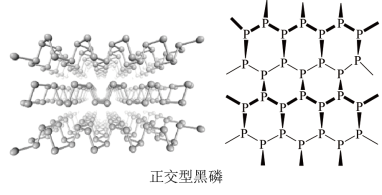
(3)BP是一种超硬耐磨涂层材料,晶胞结构与金刚石晶胞相似,其晶胞可看作金刚石晶胞内部的C原子被B原子替代,顶点和面心的C原子被P原子替代,晶胞参数为apm。沿z轴从上往下俯视的晶胞投影图如下所示。
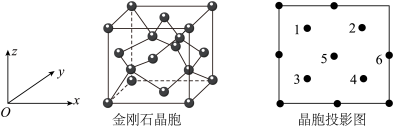
①投影图中原子5代表原子___________ (填“P”或“B”)。
②若投影图中原子6的分数坐标是(1,0.5,0.5),则原子1的分数坐标是___________ ,原子1、6之间的距离为___________ pm。
(1)白磷晶胞属于面心立方最密堆积,每个
 周围距离最近的
周围距离最近的 个数为
个数为
(2)黑磷晶体是一种新型材料,其中正交型黑磷具有类似石墨的片层结构。正交型黑磷中P原子的杂化方式为

(3)BP是一种超硬耐磨涂层材料,晶胞结构与金刚石晶胞相似,其晶胞可看作金刚石晶胞内部的C原子被B原子替代,顶点和面心的C原子被P原子替代,晶胞参数为apm。沿z轴从上往下俯视的晶胞投影图如下所示。

①投影图中原子5代表原子
②若投影图中原子6的分数坐标是(1,0.5,0.5),则原子1的分数坐标是
您最近一年使用:0次
名校
解题方法
5 . 点击化学(click chemistry)是一种能够让分子的构建模块快速、高效地结合在一起的化学反应。科学工作者可以利用基础模块搭建出变化无穷的造型,就如同玩乐高玩具一般。叠氮化物和炔烃合成抗真菌药物三唑是点击化学的重要应用,反应示例如下。下列说法正确的是
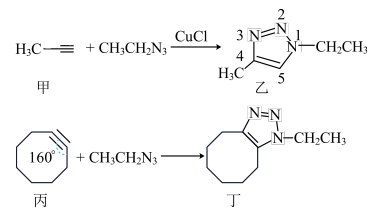

A. 的价电子排布图为 的价电子排布图为 |
B.H、C、N的第一电离能由大到小的顺序为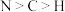 |
| C.丁形成的晶体中存在的微粒间作用力有氢键 |
| D.分子中碳碳三键的活泼性:甲<丙 |
您最近一年使用:0次
名校
解题方法
6 . 氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(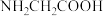 )是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
(1)
 分子中氮原子和氢原子的价电子排布图分别为
分子中氮原子和氢原子的价电子排布图分别为a. b.
b.  c.
c.  d.
d.
(2)
 和
和 分子中均含有以N原子为中心原子的大
分子中均含有以N原子为中心原子的大 健
健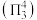 。
。 分子中
分子中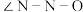
 分子中
分子中 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
(3)甘氨酸的晶体类型为
(4)三价铁的强酸盐溶于水后经水解可以生成如下图1所示的二聚体,其中
 的配位数为
的配位数为 、②
、② 、③
、③ ,该二聚体中Fe采取的杂化类型为
,该二聚体中Fe采取的杂化类型为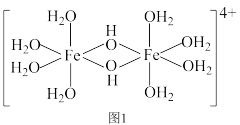
(5)碳有多种同素异形体如石墨和金刚石。石墨结构如上图2所示,金刚石晶胞如上图3所示,其中碳碳键的键长石墨
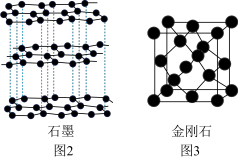
您最近一年使用:0次
2023-11-21更新
|
562次组卷
|
3卷引用:江西省赣州市全南中学2023-2024学年高三上学期11月期中考试化学试题
解题方法
7 . 钕铁硼废料的主要成分为Nd2Fe14B,还有少量的硅酸盐和Al2O3。在实验室中回收钕铁硼废料中的稀土元素的工艺流程如图所示。
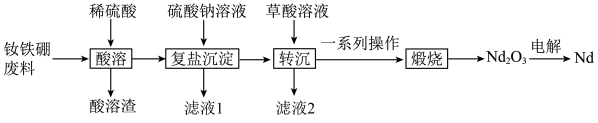
已知:
①钕的活动性较强,能与稀酸发生置换反应;硼不与稀酸反应;
②室温下, 。
。
回答下列问题:
(1)“酸溶”操作中,为提高钕的浸出率,可采取的措施有_______ (任写一点)。
(2)“复盐沉淀”过程中得到的沉淀是Nd2(SO4)3·Na2SO4·xH2O,写出生成沉淀的化学方程式:_______ 。
(3)“一系列操作”包括过滤、洗涤、干燥等,其中检验洗涤干净的操作是_______ 。实验室中,“煅烧”过程可在_______ (填仪器名称)中进行。
(4)“转沉”过程中,当Nd3+完全沉淀 时,
时, 的最小浓度为
的最小浓度为_______ mol·L-1。
(5)针对钕铁硼废料中金属离子浸出成本高、污染大的问题,某研究团队提出采用电化学阳极氧化技术直接浸出钕铁硼废料中的钕和铁元素,以_______ 为阳极,Na2SO4溶液为电解质溶液进行电解。研究表明Na2SO4溶液不需要外加酸即可达到分离钕和铁元素的目的,原因是_______ {已知Ksp[Fe(OH)3]=2.6×10-39,Ksp [Nd(OH)3]=1.9×10-21}。
(6)钕是最活泼的稀土金属之一,晶体为六方晶系,结构如图所示,钕原子以六方最密堆积方式连接。晶胞参数:a=xpm,b=xpm,c=ypm,α=90°,β=90°,γ=120°。每个晶胞含有_______ 个钕原子,设阿伏加德罗常数的值为NA,则金属钕的密度为_______ g·cm-3(列出计算表达式)。

已知:
①钕的活动性较强,能与稀酸发生置换反应;硼不与稀酸反应;
②室温下,
 。
。回答下列问题:
(1)“酸溶”操作中,为提高钕的浸出率,可采取的措施有
(2)“复盐沉淀”过程中得到的沉淀是Nd2(SO4)3·Na2SO4·xH2O,写出生成沉淀的化学方程式:
(3)“一系列操作”包括过滤、洗涤、干燥等,其中检验洗涤干净的操作是
(4)“转沉”过程中,当Nd3+完全沉淀
 时,
时, 的最小浓度为
的最小浓度为(5)针对钕铁硼废料中金属离子浸出成本高、污染大的问题,某研究团队提出采用电化学阳极氧化技术直接浸出钕铁硼废料中的钕和铁元素,以
(6)钕是最活泼的稀土金属之一,晶体为六方晶系,结构如图所示,钕原子以六方最密堆积方式连接。晶胞参数:a=xpm,b=xpm,c=ypm,α=90°,β=90°,γ=120°。每个晶胞含有

您最近一年使用:0次
2023-10-08更新
|
210次组卷
|
3卷引用:江西省部分高中学校2024届高三上学期9月第一次联考化学试题
名校
解题方法
8 . 白磷(P4)是磷的单质之一,与卤素单质反应生成卤化磷。卤化磷通常有三卤化磷和五卤化磷(PCl5分子结构如图所示,其中Cl原子有两种不同位置)。回答下列问题:_____ 。P、S、Cl的第一电离能由小到大顺序为_____ 。
(2)PCl5水解产生一种无色油状中间产物POCl3,该分子的空间结构为_____ 。
(3)PCl5中P的轨道杂化类型为_____(填字母标号)。
(4)三卤化磷的熔点见下表,分析变化趋势及原因是_____ 。
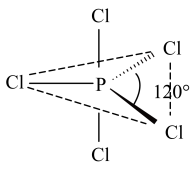
(5)PCl5晶体呈CsCl(晶胞结构如下图)型构造,其中含有等量的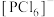 和正四面体形的
和正四面体形的_____ (填化学式),两者之间形成_____ 键。晶胞中含有的P原子的个数为_____ 。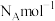 ,则该晶体密度为
,则该晶体密度为_____  (用含NA、a的式子表示)。
(用含NA、a的式子表示)。
(2)PCl5水解产生一种无色油状中间产物POCl3,该分子的空间结构为
(3)PCl5中P的轨道杂化类型为_____(填字母标号)。
| A.sp3 | B.sp3d | C.d2sp3 | D.dsp2 |
| 三卤化磷 | PF3 | PCl3 | PBr3 | PI3 |
| 熔点/℃ | -151.5 | -93.6 | -41.5 | 61.2 |
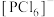 和正四面体形的
和正四面体形的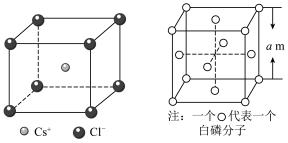
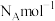 ,则该晶体密度为
,则该晶体密度为 (用含NA、a的式子表示)。
(用含NA、a的式子表示)。
您最近一年使用:0次
2023-09-25更新
|
452次组卷
|
2卷引用:江西省南昌十九中2023-2024学年高三上学期第二次月考化学试卷
解题方法
9 . 氧化石墨烯是一种淡柠檬黄色、不稳定的新型化合物,其单层局部结构如图所示。下列关于该化合物的说法正确的是
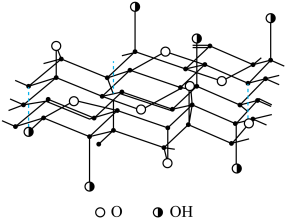

| A.氧化石墨烯的导电性优于石墨烯 |
| B.氧化石墨烯的抗氧化能力比石墨烯弱 |
| C.氧化石墨烯中C-C键的键能比C-O键大 |
| D.氧化石墨烯中所有C原子均为sp3杂化 |
您最近一年使用:0次
2023-08-30更新
|
278次组卷
|
3卷引用:江西省部分学校(稳派)2023-2024学年高三上学期8月模拟预测化学试题
名校
解题方法
10 . 新能源汽车使用的电池是磷酸亚铁锂(LiFePO4)电池,工业上用FeCl3、NH4H2PO4、LiCl及苯胺( )为原料制磷酸亚铁锂材料。请回答下列问题。
)为原料制磷酸亚铁锂材料。请回答下列问题。
(1)Fe元素在周期表中的位置___________ ,属于___________ 区。
(2)比较离子半径大小:Li+___________H-(填“>”、“<”或“=”)。
(3)四种状态的Li原子轨道表示式如下所示,其能量大小关系为___________ (用字母表示)。
A. B.
B. 
C. D.
D. 
(4)苯胺( )与甲苯(
)与甲苯( )的相对分子质量相近,但熔沸点苯胺
)的相对分子质量相近,但熔沸点苯胺___________ 甲苯(填“>”、“<”或“=”),原因是___________ 。
(5)磷酸铁锂电池的负极材料为Li原子嵌入两层石墨层中间形成的晶体,其晶胞结构如图甲所示,放电时,负极反应式为___________ 。在甲晶胞中,石墨层中最近的两个碳原子间的距离是apm,石墨层与层间的距离是bpm,则负极材料的密度为___________ g·cm-3(列出计算式即可,用NA表示阿伏加德罗常数的值)。

 )为原料制磷酸亚铁锂材料。请回答下列问题。
)为原料制磷酸亚铁锂材料。请回答下列问题。(1)Fe元素在周期表中的位置
(2)比较离子半径大小:Li+___________H-(填“>”、“<”或“=”)。
(3)四种状态的Li原子轨道表示式如下所示,其能量大小关系为
A.
 B.
B. 
C.
 D.
D. 
(4)苯胺(
 )与甲苯(
)与甲苯( )的相对分子质量相近,但熔沸点苯胺
)的相对分子质量相近,但熔沸点苯胺(5)磷酸铁锂电池的负极材料为Li原子嵌入两层石墨层中间形成的晶体,其晶胞结构如图甲所示,放电时,负极反应式为

您最近一年使用:0次
2023-08-16更新
|
434次组卷
|
3卷引用:江西省吉安市第三中学2023-2024学年高三上学期开学考试化学试题



