名校
解题方法
1 . 为维护国家安全和利益,经国务院批准,决定对镓、锗相关物项实施出口管制。镓的某种化合物的晶胞结构如下图所示(晶胞参数为a pm,1 pm=10-10cm,NA表示阿伏加德罗常数)。下列说法正确的是
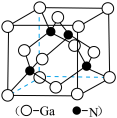

| A.Ga元素位于元素周期表的ds区 |
| B.晶体结构中N的配位数为6 |
| C.该物质的化学式为Ga4N4 |
D.该晶体的密度为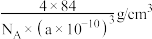 |
您最近一年使用:0次
2023-10-10更新
|
555次组卷
|
2卷引用:重庆市拔尖强基联盟(西南大学附中、育才中学)2023-2024学年高三10月联合考试化学试题
名校
解题方法
2 . 一种La、Ba、Co、O等元素为代表的新型双钙钛矿阴极材料,晶胞结构如图所示,目前已成为低温固体氧化物燃料电池(IT-SOFCs)的一大研究热点(A点为Ba,A’点为La,B点为Co,晶胞为正方体,棱长为a pm)。下列回答错误的是
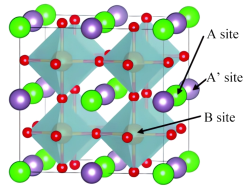

| A.该晶体的化学式为LaBaCo2O6 |
| B.距离Ba等距且最近的La的数目为12 |
C.该晶胞密度为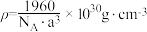 |
| D.Co元素在周期表中的位置为第四周期第Ⅷ族 |
您最近一年使用:0次
名校
解题方法
3 . 已知X、Y、Z三种主族元素在元素周期表中的位置如图所示。设X的原子序数为a,则下列说法不正确的是
| Y | ||
| X | ||
| Z |
| A.Y的原子序数可能为a-17 | B.Y与Z的原子序数之和可能为2a |
| C.Z的原子序数可能为a+31 | D.X、Y、Z可能均为短周期元素 |
您最近一年使用:0次
2023-06-18更新
|
987次组卷
|
8卷引用:【全国校级联考】湖北省部分重点中学2017-2018学年高一下学期期中考试化学试题
名校
解题方法
4 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
(1)元素p为26号元素,请写出其基态原子的核外电子排布式:___________ ,其在元素周期表中的位置___________ 。
(2)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:___________ 。
(3)o、p两元素的部分电离能数据如表2:
比较两元素的 、
、 可知,气态
可知,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子难。对此,你的解释是
再失去一个电子难。对此,你的解释是___________ 。
(4)周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。b、c、d中第一电离能最大的是___________ (填元素符号),e的价电子排布图为___________ 。
a | |||||||||||||||||
b | c | d | e | f | |||||||||||||
g | h | i | j | k | l | m | |||||||||||
n | o | p |
(1)元素p为26号元素,请写出其基态原子的核外电子排布式:
(2)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:
(3)o、p两元素的部分电离能数据如表2:
元素 电离能(kJ/mol) | o | p |
| 717 | 759 |
| 1509 | 1561 |
| 3248 | 2957 |
比较两元素的
 、
、 可知,气态
可知,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子难。对此,你的解释是
再失去一个电子难。对此,你的解释是(4)周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。b、c、d中第一电离能最大的是
您最近一年使用:0次
名校
解题方法
5 . 短周期主族元素X、Y、Z、W在周期表中位置如图,下列表述正确的是
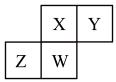

| A.Y最高正价可能为+6价 |
| B.W有可能周期数等于其族序数 |
| C.Z的最高价氧化物有可能与Y的最高价氧化物对应的水化物反应 |
| D.若X为氧元素,则离子半径顺序:r(W2-)>r(Y-)>r(X2-)>r(Z3-) |
您最近一年使用:0次
2023-02-16更新
|
791次组卷
|
2卷引用:广东省深圳市高级中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
6 . 近年来我国航天事业成果显著,其制造材料中包含了铝、镁、锌、钛、锰、铜、镍、铬、硅、氮、氧等多种元素。回答下列问题:
(1)铬元素属于周期表中_______ 区的元素,其基态原子核外电子空间运动状态有_______ 种,
(2)钛能形成多种配合物,如Ti(CO)6、[Ti(H2O)6]Cl3、[Ti(NH3)6]Cl3等。其配合物的配位数均为_______ ,其中配位原子的电负性由小到大的顺序是_______ (写元素符号),[Ti(NH3)6]Cl3中∠H-N-H_______ (填“大于”、“小于”或“等于”)单个氨气分子中∠H-N-H,原因是_______ 。
(3)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为_______ 。
(4)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为_______ ,其配位数为_______ 。已知晶胞参数为a pm,设阿伏加德罗常数的值为NA,晶胞密度
_______  。(列出计算式即可)
。(列出计算式即可)

(1)铬元素属于周期表中
(2)钛能形成多种配合物,如Ti(CO)6、[Ti(H2O)6]Cl3、[Ti(NH3)6]Cl3等。其配合物的配位数均为
(3)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为
(4)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为

 。(列出计算式即可)
。(列出计算式即可) 
您最近一年使用:0次
名校
解题方法
7 . 短周期元素W、X、Y、Z、Q,原子序数依次增大,W原子没有中子,X元素为地壳中含量最多的元素,Y、Z、Q同周期,且Y、Z、Q最外层电子数之和为14,Y与W同主族,下列结论不正确的是
| A.原子半径大小顺序为Y>Z>Q>X>W |
| B.W、X、Y形成的化合物中只有共价键 |
| C.X、Y可以形成的原子个数比1:1或1:2的化合物 |
| D.最高价氧化物对应的水化物酸性Z﹤Q |
您最近一年使用:0次
2023-01-12更新
|
1063次组卷
|
4卷引用:江苏省南京市第五高级中学2022-2023学年高一上学期学情自测卷化学试题
江苏省南京市第五高级中学2022-2023学年高一上学期学情自测卷化学试题 山东省青岛第五十八中学2022-2023学年高一下学期3月月考化学试题山东省青岛第十九中学2022-2023学年高一4月月考化学试题(已下线)专题09 原子结构 元素周期律和周期表-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)
8 . 随着新能源汽车销量的猛增,动力电池退役高峰将至,磷酸铁锂 是目前使用最多的动力电池材料,因此回收磷酸铁锂具有重要意义。一种从废旧磷酸铁锂正极片(
是目前使用最多的动力电池材料,因此回收磷酸铁锂具有重要意义。一种从废旧磷酸铁锂正极片( 、导电石墨、铝箔)中回收锂的工艺流程如下:
、导电石墨、铝箔)中回收锂的工艺流程如下:
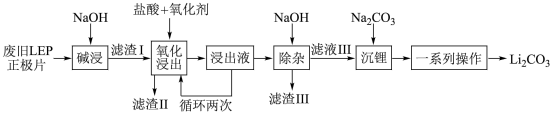
已知:i.废旧磷酸铁锂正极片中的化学物质均不溶于水也不与水反应。
ii. 在水中的溶解度随温度升高而降低,但煮沸时与水发生反应。
在水中的溶解度随温度升高而降低,但煮沸时与水发生反应。
回答下列问题:
(1) 中密度最小的金属元素在周期表中的位置是
中密度最小的金属元素在周期表中的位置是_______ 。
(2)“氧化浸出”时,保持其他条件不变,不同氧化剂对锂的浸出实验结果如下表,实际生产中氧化剂选用 ,不选用
,不选用 的原因是
的原因是_______ 。在“氧化浸出”时,适当的升温可加快反应速率,但一般不采取高温法,其原因是_______ 。 “氧化浸出”时生成了难溶的 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(3)“浸出液”循环两次的目的是_______ 。
(4)“滤渣II”经纯化可得 ,流程中生成的
,流程中生成的 、
、 在高温条件下与
在高温条件下与 煅烧可得
煅烧可得 ,实现再生利用,其化学方程式为
,实现再生利用,其化学方程式为_______ 。
(5)“一系列操作”具体包括_______ 、洗涤、干燥。
 是目前使用最多的动力电池材料,因此回收磷酸铁锂具有重要意义。一种从废旧磷酸铁锂正极片(
是目前使用最多的动力电池材料,因此回收磷酸铁锂具有重要意义。一种从废旧磷酸铁锂正极片( 、导电石墨、铝箔)中回收锂的工艺流程如下:
、导电石墨、铝箔)中回收锂的工艺流程如下:
已知:i.废旧磷酸铁锂正极片中的化学物质均不溶于水也不与水反应。
ii.
 在水中的溶解度随温度升高而降低,但煮沸时与水发生反应。
在水中的溶解度随温度升高而降低,但煮沸时与水发生反应。回答下列问题:
(1)
 中密度最小的金属元素在周期表中的位置是
中密度最小的金属元素在周期表中的位置是(2)“氧化浸出”时,保持其他条件不变,不同氧化剂对锂的浸出实验结果如下表,实际生产中氧化剂选用
 ,不选用
,不选用 的原因是
的原因是 ,该反应的化学方程式为
,该反应的化学方程式为| 序号 | 锂含量/% | 氧化剂 |  | 浸出液 浓度 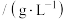 | 浸出渣中 含量/% |
| 1 | 3.7 |  | 3.5 | 9.02 | 0.10 |
| 2 | 3.7 |  | 3.5 | 9.05 | 0.08 |
| 3 | 3.7 |  | 3.5 | 7.05 | 0.93 |
| 4 | 3.7 |  | 3.5 | 8.24 | 0.43 |
(4)“滤渣II”经纯化可得
 ,流程中生成的
,流程中生成的 、
、 在高温条件下与
在高温条件下与 煅烧可得
煅烧可得 ,实现再生利用,其化学方程式为
,实现再生利用,其化学方程式为(5)“一系列操作”具体包括
您最近一年使用:0次
9 . 下表标出的是元素周期表的一部分元素,回答下列问题:

(1)第三周期中原子半径最小的是___________ 。(用元素符号表示)
(2)表中用字母标出的15种元素中,化学性质最不活泼的是___________ (用元素符号表示),金属性最强的是___________ ,(用元素符号表示)非金属性最强的是___________ ,(用元素符号表示)属于过渡元素的是___________ (用字母表示)。
(3)d,e,f气态氢化物最稳定的为___________ , 最不稳定的为___________ 。(填化学式)
(4)钛被称为继铁、铝之后的第三金属,钛元素在元素周期表中的位置为___________ ,其价电子排布式为___________ 。
(5)请画出26号元素其价电子排布图:___________ 。
(6)d与a反应的产物的分子中心原子的杂化形式为___________ ,该分子是___________ (填“极性”或“非极性”)分子。
(7)写出铜元素在周期表中的位置___________ ,它位于___________ 区。并写出Cu+ 基态电子排布式___________ 。
(8)o、p两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态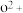 再失去一个电子比气态
再失去一个电子比气态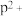 再失去一个电子难。对此,你的解释是
再失去一个电子难。对此,你的解释是___________
(9)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX的晶体结构如图所示。
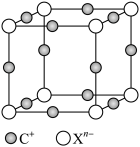
该晶体中阳离子和阴离子个数比为___________ ,晶体中每个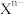 被
被___________ 个等距离的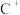 包围。
包围。

(1)第三周期中原子半径最小的是
(2)表中用字母标出的15种元素中,化学性质最不活泼的是
(3)d,e,f气态氢化物最稳定的为
(4)钛被称为继铁、铝之后的第三金属,钛元素在元素周期表中的位置为
(5)请画出26号元素其价电子排布图:
(6)d与a反应的产物的分子中心原子的杂化形式为
(7)写出铜元素在周期表中的位置
(8)o、p两元素的部分电离能数据列于下表:
| 元素 | o | p | |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 |
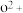 再失去一个电子比气态
再失去一个电子比气态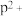 再失去一个电子难。对此,你的解释是
再失去一个电子难。对此,你的解释是(9)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX的晶体结构如图所示。

该晶体中阳离子和阴离子个数比为
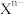 被
被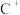 包围。
包围。
您最近一年使用:0次
名校
10 . 下列表格是元素周期表的一部分。请按要求填空(用化学用语填写)
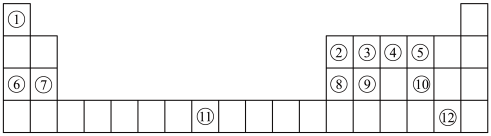
(1)元素①和⑥形成的化合物中存在的化学键类型为_______ 。
(2)用化学方程式表示④的简单氢化物的工业制法_______ 。
(3)写出由③④⑥形成的化合物的电子式_______ 。
(4)列举元素⑨形成的氧化物的一种用途_______ ,元素⑪在周期表中的位置_______ 。
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为_______ 。
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为_______ 。
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为_______ 。

(1)元素①和⑥形成的化合物中存在的化学键类型为
(2)用化学方程式表示④的简单氢化物的工业制法
(3)写出由③④⑥形成的化合物的电子式
(4)列举元素⑨形成的氧化物的一种用途
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol
 ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为
您最近一年使用:0次
2022-11-28更新
|
340次组卷
|
2卷引用:天津市南开中学2022-2023学年高三上学期第二次月考化学试题




