名校
1 . 已知W、X、Y、Z为短周期元素,原子序数依次增大。W、Z同主族,X、Y、Z同周期,其中只有X为金属元素。下列说法一定正确的是
| A.简单离子半径:W > X |
| B.含氧酸的酸性:W > Z |
| C.气态氢化物的稳定性:W < Y |
| D.若W与X原子序数差为5,则形成化合物的化学式为X3W2 |
您最近一年使用:0次
2017-03-27更新
|
889次组卷
|
3卷引用:2017届山东省济南市高三第一次模拟考试理科综合化学试卷
解题方法
2 . 4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
回答下列问题:
(1)元素x在周期表中的位置是____ ,其单质可采用电解熔融________ 的方法制备。
(2)气体分子(mn)2的电子式为____ ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为____ 。
(3)已知氰化钠(NaCN),可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物Na[Au(CN)2],其反应方程式为:①4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH,Na[Au(CN)2]在水溶液中的电离方程式为:②Na[Au(CN)2]=Na++[Au(CN)2]-,然后再用锌从溶液中把金置换出来,锌转化为Na2[Zn(CN)4]。据此,请利用①写出在空气中用氰化钠溶液提取金的电极反应式:正极:____ ,负极:_____ 。
(4)若人不慎氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为红色。写出解毒原理的相关离子方程式____ 。
| m | n | ||
| x | y |
(1)元素x在周期表中的位置是
(2)气体分子(mn)2的电子式为
(3)已知氰化钠(NaCN),可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物Na[Au(CN)2],其反应方程式为:①4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH,Na[Au(CN)2]在水溶液中的电离方程式为:②Na[Au(CN)2]=Na++[Au(CN)2]-,然后再用锌从溶液中把金置换出来,锌转化为Na2[Zn(CN)4]。据此,请利用①写出在空气中用氰化钠溶液提取金的电极反应式:正极:
(4)若人不慎氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为红色。写出解毒原理的相关离子方程式
您最近一年使用:0次
解题方法
3 . 下表列出了A﹣R 9种元素在周期表中的位置
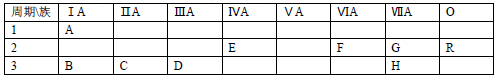
(1)这 9种元素中化学性质最不活泼的是________ (以上均填元素符号)
(2)B、C、D三种元素按原子半径由大到小的顺序排列为________ (用元素符号表示)
(3)F元素简单氢化物的化学式是________ ,H元素跟B元素形成化合物的化学式是______ ,高温灼烧该化合物时,火焰呈________ 色.
(4)G元素和 H元素两者核电荷数之差是________ .

(1)这 9种元素中化学性质最不活泼的是
(2)B、C、D三种元素按原子半径由大到小的顺序排列为
(3)F元素简单氢化物的化学式是
(4)G元素和 H元素两者核电荷数之差是
您最近一年使用:0次
名校
解题方法
4 . 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。请用相关的化学术语回答下列问题:
(1) 在这些元素中,最不活泼的是 ,非金属性最强的是___________,金属性最强的是___________;(填元素符号或化学式,下同。)
(2) 这些元素形成的最高价氧化物对应的水化物中碱性最强的 ,酸性最强的__________;
(3) ①、②、③、④、⑤这五种元素的原子半径由大到小的顺序为 ;
(4) ⑥的氢化物的电子式为 ,① 在空气中燃烧后生成产物的电子式 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA[ | 0 |
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ① | ③ | ④ | ⑧ | ⑨ | |||
| 4 | ② |
(2) 这些元素形成的最高价氧化物对应的水化物中碱性最强的 ,酸性最强的__________;
(3) ①、②、③、④、⑤这五种元素的原子半径由大到小的顺序为 ;
(4) ⑥的氢化物的电子式为 ,① 在空气中燃烧后生成产物的电子式 。
您最近一年使用:0次
5 . X、Y是短周期元素,且X的原子序数比Y大4。请填空:
I.若X是金属元素,Y是非金属元素,化合物XY是优质的耐高温材料。
(1)元素Y在元素周期表的位置为 。
(2)粉末状X是制造烟花的重要原料之一,生产粉末状X时,将X蒸气在某种气体中冷却。下列可作为冷却气体的是 。
II.若X是短周期最活泼的金属元素。
(3)Y2H4、O2与XOH溶液组成的电池,其负极的电极反应式(已知:Y2H4可以和O2反应生成Y2和H2O)为 。该电池中OH-移向 极。
(4)25℃时,往a mol·L-1 YH3的水溶液(甲)中滴加0.01 mol·L-1H2SO4溶液(乙),滴加过程中溶液的导电能力 (填“增强”、“减弱”或“不变”),当甲与乙等体积混合后,溶液呈中性(设温度不变),甲中溶质的电离常数Kb= (填表达式,用含a的代数式表示)。
I.若X是金属元素,Y是非金属元素,化合物XY是优质的耐高温材料。
(1)元素Y在元素周期表的位置为 。
(2)粉末状X是制造烟花的重要原料之一,生产粉末状X时,将X蒸气在某种气体中冷却。下列可作为冷却气体的是 。
| A.空气 | B.氮气 | C.氩气 | D.二氧化碳 |
II.若X是短周期最活泼的金属元素。
(3)Y2H4、O2与XOH溶液组成的电池,其负极的电极反应式(已知:Y2H4可以和O2反应生成Y2和H2O)为 。该电池中OH-移向 极。
(4)25℃时,往a mol·L-1 YH3的水溶液(甲)中滴加0.01 mol·L-1H2SO4溶液(乙),滴加过程中溶液的导电能力 (填“增强”、“减弱”或“不变”),当甲与乙等体积混合后,溶液呈中性(设温度不变),甲中溶质的电离常数Kb= (填表达式,用含a的代数式表示)。
您最近一年使用:0次
解题方法
6 . A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的离子不含电子;B元素的最高价氧化物对应水化物与其氢化物能反应生成盐F;D与A同主族,且与 E同周期;E元素原子的最外层电子数是其次外层电子数的 3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)E元素在元素周期表中的位置是_______________ 。
(2)由A、B、C三种元素形成的离子化合物的化学式为_________________ 。
(3)A可分别与C、E形成甲、乙两种三原子分子,且甲有18个电子、乙有10个电子,甲与乙比较,沸点较高的是(填化学式)_______________ 。
(4)F含有的化学键类型是___________ 和_____________ ,其水溶液呈酸性,请用相关的离子方程式解释其原因___________ 。
(5)D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该过程的化学方程式为______ 。
(1)E元素在元素周期表中的位置是
(2)由A、B、C三种元素形成的离子化合物的化学式为
(3)A可分别与C、E形成甲、乙两种三原子分子,且甲有18个电子、乙有10个电子,甲与乙比较,沸点较高的是(填化学式)
(4)F含有的化学键类型是
(5)D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该过程的化学方程式为
您最近一年使用:0次
解题方法
7 . 已知A、B、C、D四种元素分别为短周期元素,表示中三个不同短周期的主族元素,且原子序数依次增
大。D原子的质子数是B原子质子数的2倍,A原子与D原子的最外层电子数之和是B原子与C原子质子
数之和的1/3。A与B可形成BA3型化合物,该化合物与C的单质在一定条件下反应,能生成化合物BC,请按要求填写下列空白:
(1)D元素的名称____________ ,C元素在元素周期表中的位置_____________ 。
(2)写出BA3的电子式____________ ,BA3跟C的单质在一定条件下反应,能生成化合物BC的化学方程式________________________________ 。
(3)D单质在工业上最重要的用途是_________ ,写出工业上制取D单质的化学方程式__________ 。
(4)在实验室中B的最高价氧化物的水化物的浓溶液应如何保存__________________ ,用化学方程
式说明理由____________________________________ 。
大。D原子的质子数是B原子质子数的2倍,A原子与D原子的最外层电子数之和是B原子与C原子质子
数之和的1/3。A与B可形成BA3型化合物,该化合物与C的单质在一定条件下反应,能生成化合物BC,请按要求填写下列空白:
(1)D元素的名称
(2)写出BA3的电子式
(3)D单质在工业上最重要的用途是
(4)在实验室中B的最高价氧化物的水化物的浓溶液应如何保存
式说明理由
您最近一年使用:0次
名校
8 . 下列叙述不正确的是
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤沸点:NH3<PH3<AsH3
⑥已知2H2(g)+O2(g)=2H2O(l) △H=﹣571kJ·mol﹣1,则氢气的燃烧热为285.5kJ·mol﹣1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤沸点:NH3<PH3<AsH3
⑥已知2H2(g)+O2(g)=2H2O(l) △H=﹣571kJ·mol﹣1,则氢气的燃烧热为285.5kJ·mol﹣1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
| A.②④⑥ | B.①③⑤⑦ | C.②④⑥⑦ | D.⑤⑥⑦ |
您最近一年使用:0次
2016-12-09更新
|
2036次组卷
|
6卷引用:2016届湖南省衡阳县第四中学高三9月月考试化学试卷
解题方法
9 . 下表为元素周期表的一部分,其中编号代表对应的元素。
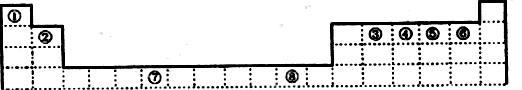
请回答下列问题:
(1)写出元素⑦的基态原子外围电子排布式________________ ,元素⑧位于_______ 区。⑤元素原子的价层电子的电子排布图为_____________________ ;
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中所有杂化原子的杂化方式分别为___________ 和________________ 。
(3)元素③④⑤⑥的第一电离能由大到小的顺序是_________ (用元素符号表示)。请写出由④和⑤两种元素形成的与N3ˉ互为等电子体的分子的化学式________________ ,(写出一种即可)其VSEPR构型为___________ 。
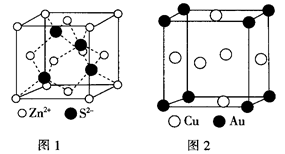
(4)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2-的配位数为___________ 。
(5)铜能与类卤素(SCN)2分子(与氯气分子性质相似)反应生成Cu(SCN)2,1mol(SCN)2分子中含有共价键的数目为______________ 。铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为__________ (用含“a、NA的代数式表示)g/cm3)。

请回答下列问题:
(1)写出元素⑦的基态原子外围电子排布式
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中所有杂化原子的杂化方式分别为
(3)元素③④⑤⑥的第一电离能由大到小的顺序是
(4)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2-的配位数为
(5)铜能与类卤素(SCN)2分子(与氯气分子性质相似)反应生成Cu(SCN)2,1mol(SCN)2分子中含有共价键的数目为

您最近一年使用:0次
10-11高三上·福建·阶段练习
解题方法
10 . 短周期元素X、Y、Z在元素周期表中的位置如右图所示,它们的质子数之和为21。

(1)氢元素与Z形成原子个数比为1∶1的化合物,其电子式为_____________ 。该化合物分子中存在__________ (填“共价键”或“离子键”)。
(2)Y最高价氧化物的水化物与Y的氢化物恰好完全反应时,生成物的水溶液呈酸性,其原因是____________________ ;(用离子方程式表示)该溶液中各种离子浓度由大到小顺序为_______________ 。
(3)①恒温下,在容积为2L的刚性容器中充入2mol H2与2mol Y的单质,5分钟后反应达到平衡时,此时Y的单质为1.8mol,则产物的反应速率为_______________ ,平衡时容器内压强与反应前压强比为__________________ ;
②若该反应在恒温恒压条件下进行(其它条件相同),反应达到平衡时,H2的转化率比上述条件下H2的转化率_______ (填“大”、“小”或“相同”)。
(4)常温下,由X的最简单气态氢化物3.2g在氧气中完全燃烧后恢复至常温,放出a kJ 的热量,试写出该反应的热化学方程式:__________________ 。

(1)氢元素与Z形成原子个数比为1∶1的化合物,其电子式为
(2)Y最高价氧化物的水化物与Y的氢化物恰好完全反应时,生成物的水溶液呈酸性,其原因是
(3)①恒温下,在容积为2L的刚性容器中充入2mol H2与2mol Y的单质,5分钟后反应达到平衡时,此时Y的单质为1.8mol,则产物的反应速率为
②若该反应在恒温恒压条件下进行(其它条件相同),反应达到平衡时,H2的转化率比上述条件下H2的转化率
(4)常温下,由X的最简单气态氢化物3.2g在氧气中完全燃烧后恢复至常温,放出a kJ 的热量,试写出该反应的热化学方程式:
您最近一年使用:0次



