1 . 下表是元素周期表的一部分,针对元素①~⑥回答下列问题。
(1)④元素在周期表中的位置为_______ 。
(2)金属性最强的元素为_______ (填元素符号),其最高价氧化物对应的水化物中含有的化学键为_______ 。
(3)①③⑤三种元素对应的简单离子半径由大到小的顺序为_______ (用离子符号表示)。
(4)元素的非金属性⑥_______ Br(填“>”“<”或“=”),写出能证明该结论的离子方程式_______ 。
| ④ | ⑤ | ||||||
| ① | ③ | ⑥ | |||||
| ② | |||||||
(2)金属性最强的元素为
(3)①③⑤三种元素对应的简单离子半径由大到小的顺序为
(4)元素的非金属性⑥
您最近一年使用:0次
名校
解题方法
2 . 下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:

(1)地壳中含量最高的金属元素是___________ (填标号);化学性质最不活泼的元素是___________ (填元素符号)。
(2)A分别与G、H、I形成的最简单化合物中,稳定性最强的是___________ (填化学式)。
(3)B、C、E、H四种元素对应的简单离子半径由大到小的顺序是___________ (用离子符号表示)。
(4)B、C形成的最高价氧化物对应水化物的碱性从强到弱的顺序为___________ (填化学式)。
(5)用电子式表示J与C形成化合物的过程:___________ 。
(6)请写出B、E的最高价氧化物对应的水化物发生反应的化学方程式:___________ 。

(1)地壳中含量最高的金属元素是
(2)A分别与G、H、I形成的最简单化合物中,稳定性最强的是
(3)B、C、E、H四种元素对应的简单离子半径由大到小的顺序是
(4)B、C形成的最高价氧化物对应水化物的碱性从强到弱的顺序为
(5)用电子式表示J与C形成化合物的过程:
(6)请写出B、E的最高价氧化物对应的水化物发生反应的化学方程式:
您最近一年使用:0次
2023-01-11更新
|
441次组卷
|
4卷引用:河北省保定市部分高中2022-2023学年高一上学期期末考试化学试题
3 . 下表是元素周期表的一部分,请回答:
(1)元素⑦的原子结构示意图为_______ ;元素⑩的名称为_______ 。
(2)在这些元素中,化学性质最活泼的金属元素是_______ (填元素符号,下同),最不活泼的元素是_______ ;原子半径最小的元素是_______ 。
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是_______ (填化学式,下同);具有两性的是_______ 。
(4)用电子式表示⑤⑦形成化合物过程:_______ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(2)在这些元素中,化学性质最活泼的金属元素是
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是
(4)用电子式表示⑤⑦形成化合物过程:
您最近一年使用:0次
4 . 元素周期表反应了元素存在周期性的变化规律,下表是周期表中部分元素的部分信息:
分析并回答下列问题:
(1)周期表从左到右依次有18个纵行,上述元素在周期表的第______ 个纵行。
(2)上表中xBr、zAt的x=______ ,z=______ 。
(3)yI在周期表中的位置是_______________________ 。
(4)常温下,描述最接近砹单质物理性质的是 。
(5)单质从F2到I2分别与氢气反应的条件依次是 。
(6)下列化学式正确的是 。
(7)IBr是一种拟卤素,它的性质与卤素单质的化学性质相似。请写出Cl2和IBr分别与NaOH溶液反应的化学方程式①____ 、②____ 。其中属于氧化还原反应有____ 。
| 元素名称 | 氟 | 氯 | 溴 | 碘 | 砹 |
| 元素符号 | 9F | 17Cl | xBr | yI | zAt |
| 单质颜色(常态) | 浅黄绿色 | 黄绿色 | 深红棕色 | 紫黑色 | / |
| 单质熔点/℃ | -219.6 | -101 | -7.2 | 113.5 | / |
| 单质沸点/℃ | -188.1 | -34.6 | 58.78 | 184.4 | / |
| 主要化合价 | -1 | -1、+7 | -1、+7 | -1、+7 | / |
分析并回答下列问题:
(1)周期表从左到右依次有18个纵行,上述元素在周期表的第
(2)上表中xBr、zAt的x=
(3)yI在周期表中的位置是
(4)常温下,描述最接近砹单质物理性质的是 。
| A.红色液体易挥发 | B.无色气体易液化 |
| C.灰色固体易升华 | D.黑色固体易升华 |
| A.点燃、接触、加热、强热 | B.强热、接触、加热、点燃 |
| C.接触、点燃、加热、强热 | D.加热、接触、强热、加热 |
| A.Na2At | B.CAt4 | C.AgAt2 | D.At2O7 |
您最近一年使用:0次
5 . 元素在周期表中的位置反映了元素的原子结构和性质,矿物白云母是一种重要的化工原料,其化学式的氧化物形式为:K2O·3Al2O3·6SiO2·2H2O。就其组成元素完成下列填空:
(1)Al元素在元素周期表中的位置为_____ ,K2O的电子式为_____ 。
(2)上述元素中(Si、H除外),形成的简单离子的半径最小,该离子与过量氨水反应的离子方程式为_____ 。
(3)根据KH的存在,有人提议可把氢元素放在第ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的第_____ 族。
(4)某元素R与氧元素同主族,对延长人类寿命起着重要作用,被誉为“生命元素”。已知R元素的原子有4个电子层,则元素R的质子数是_____ 。
(1)Al元素在元素周期表中的位置为
(2)上述元素中(Si、H除外),形成的简单离子的半径最小,该离子与过量氨水反应的离子方程式为
(3)根据KH的存在,有人提议可把氢元素放在第ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的第
(4)某元素R与氧元素同主族,对延长人类寿命起着重要作用,被誉为“生命元素”。已知R元素的原子有4个电子层,则元素R的质子数是
您最近一年使用:0次
解题方法
6 . 海洋是巨大的化学资源宝库。从海水中可以制取氯、溴、镁等多种化工产品。
(1) 在元素周期表中的位置是第
在元素周期表中的位置是第_______ 周期、第_______ 族。
(2) 的最高价氧化物对应的水化物为
的最高价氧化物对应的水化物为 ,其中溴元素的化合价是
,其中溴元素的化合价是_______ , 的酸性比
的酸性比 的酸性
的酸性_______ (填“强”或“弱”)。
(3)金属性 强于
强于 用原子结构解释原因:
用原子结构解释原因: 和
和 位于同一周期,原子核外电子层数相同,
位于同一周期,原子核外电子层数相同,_______ ,原子半径 大于
大于 ,失电子能力
,失电子能力 强于
强于 。
。
(4)在元素周期表中,溴( )位于第4周期,与
)位于第4周期,与 同主族。下列实验或事实能说明得电子能力
同主族。下列实验或事实能说明得电子能力 强于
强于 的是
的是_______ (填字母)。
a.将 通入
通入 溶液中可制得
溶液中可制得
b.常温常压下, 为气态,
为气态, 为液态
为液态
c. 约500℃开始分解,HCl约1000℃开始缓慢分解
约500℃开始分解,HCl约1000℃开始缓慢分解
(1)
 在元素周期表中的位置是第
在元素周期表中的位置是第(2)
 的最高价氧化物对应的水化物为
的最高价氧化物对应的水化物为 ,其中溴元素的化合价是
,其中溴元素的化合价是 的酸性比
的酸性比 的酸性
的酸性(3)金属性
 强于
强于 用原子结构解释原因:
用原子结构解释原因: 和
和 位于同一周期,原子核外电子层数相同,
位于同一周期,原子核外电子层数相同, 大于
大于 ,失电子能力
,失电子能力 强于
强于 。
。(4)在元素周期表中,溴(
 )位于第4周期,与
)位于第4周期,与 同主族。下列实验或事实能说明得电子能力
同主族。下列实验或事实能说明得电子能力 强于
强于 的是
的是a.将
 通入
通入 溶液中可制得
溶液中可制得
b.常温常压下,
 为气态,
为气态, 为液态
为液态c.
 约500℃开始分解,HCl约1000℃开始缓慢分解
约500℃开始分解,HCl约1000℃开始缓慢分解
您最近一年使用:0次
解题方法
7 . 下表为元素周期表的一部分,请回答有关问题
(1)已知元素⑩的一种核素,其中中子数为45,用原子符号表示该核素为__________
(2)⑥是地壳中含量最高的金属元素,用原子符号表示该元素为__________
(3)由上述④⑤元素构成的淡黄色固体化合物的化学式______ ,该化合物与水反应的化学方程式___________________ 。
(4)元素⑨的焰色试验火焰颜色为__________
(5)元素④在元素周期表中的位置是第______ 周期第_____ 族
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
(1)已知元素⑩的一种核素,其中中子数为45,用原子符号表示该核素为
(2)⑥是地壳中含量最高的金属元素,用原子符号表示该元素为
(3)由上述④⑤元素构成的淡黄色固体化合物的化学式
(4)元素⑨的焰色试验火焰颜色为
(5)元素④在元素周期表中的位置是第
您最近一年使用:0次
解题方法
8 . 根据下列几种粒子的结构示意图,回答问题
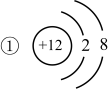 、
、 、
、 、
、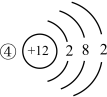
(1)其中属于阴离子的是_______ 。
(2)在化学反应中容易失去电子的是_______ 。
(3)属于同种元素的是_______ 。
 、
、 、
、 、
、
(1)其中属于阴离子的是
(2)在化学反应中容易失去电子的是
(3)属于同种元素的是
您最近一年使用:0次
解题方法
9 . 原子结构与元素周期表存在着内在联系。根据已学知识,请你回答下列问题:
(1)指出31号元素镓(Ga)在元素周期表中的位置:_______ 周期_______ 族。
(2)X原子在第二电子层上只有一个空轨道,则X是_______ ;其轨道表示式为_______ 。
(3)被誉为“21世纪的金属”的钛(Ti)元素原子的价电子排布式为:_______ 。
(4)写出原子序数最小的Ⅷ族元素原子的核外电子排布式:_______ 。
(5)写出3p轨道上有2个未成对电子的元素符号:_______ 。
(6)日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素,该元素的价电子排布式为3d54s1,该元素的名称为:_______ 。
(1)指出31号元素镓(Ga)在元素周期表中的位置:
(2)X原子在第二电子层上只有一个空轨道,则X是
(3)被誉为“21世纪的金属”的钛(Ti)元素原子的价电子排布式为:
(4)写出原子序数最小的Ⅷ族元素原子的核外电子排布式:
(5)写出3p轨道上有2个未成对电子的元素符号:
(6)日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素,该元素的价电子排布式为3d54s1,该元素的名称为:
您最近一年使用:0次
2022-12-20更新
|
290次组卷
|
2卷引用:山东省威海市文登新一中2021-2022学年高二上学期期中考试化学试题
解题方法
10 . NaOH被大量用于制皂、造纸和纺织品生产。回答下列问题。
(1)H元素位于元素周期表的第_______ 周期第IA族。
(2)Na元素位于第IA族H元素下方,Na的原子半径比H的_______ (填“大”或“小”)。
(3)NaOH所含的两种非金属元素中,非金属性较强的是_______ (填“H”或“O”)。
(4)Na的最高价氧化物对应的水化物的化学式为_______ 。
(1)H元素位于元素周期表的第
(2)Na元素位于第IA族H元素下方,Na的原子半径比H的
(3)NaOH所含的两种非金属元素中,非金属性较强的是
(4)Na的最高价氧化物对应的水化物的化学式为
您最近一年使用:0次



